Oxid xenonový - Xenon trioxide - Wikipedia
 | |
 | |
| Jména | |
|---|---|
| Názvy IUPAC Oxid xenonový Oxid xenon (VI) | |
| Ostatní jména Anhydrid kyseliny xenové | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
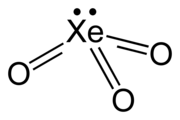
| XeO3 | |
| Molární hmotnost | 179,288 g / mol |
| Vzhled | bezbarvá krystalická pevná látka |
| Hustota | 4,55 g / cm3, pevný |
| Bod tání | 25 ° C (77 ° F; 298 K) Násilný rozklad |
| Rozpustný (s reakcí) | |
| Struktura | |
| trigonální pyramidální (C3v) | |
| Termochemie | |
Std entalpie of formace (ΔFH⦵298) | 402 kJ · mol−1[1] |
| Nebezpečí | |
Klasifikace EU (DSD) (zastaralý) | nezapsáno |
| NFPA 704 (ohnivý diamant) | |
| Související sloučeniny | |
Související sloučeniny | Xenon tetroxid Kyselina xenová |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Oxid xenonový je nestabilní sloučenina z xenon v jeho +6 oxidační stav. Je to velmi silné oxidační činidlo, a pomalu uvolňuje kyslík z vody, zrychlený vystavením slunečnímu záření. Při kontaktu s organickými materiály je nebezpečně výbušný. Když vybuchne, uvolní xenon a plynný kyslík.
Chemie
Oxid xenonový je silné oxidační činidlo a může oxidovat většinu látek, které jsou vůbec oxidovatelné. Je však pomalý a to snižuje jeho užitečnost.[2]
Při teplotě nad 25 ° C je oxid xenonový velmi náchylný k prudkému výbuchu:
Když se rozpustí ve vodě, kyselý roztok kyselina xenová je vytvořen:
- XeO3(aq) + H2O → H2XeO4 ⇌ H+ + HXeO−
4
Tento roztok je stabilní při teplotě místnosti a postrádá výbušné vlastnosti oxidu xenonového. Oxiduje karboxylové kyseliny kvantitativně do oxid uhličitý a voda.[3]
Alternativně se rozpouští v alkalických roztocích za vzniku xenáty. The HXeO−
4 anion je převládajícím druhem v xenátových roztocích.[4] Nejsou stabilní a začínají nepřiměřený do perxenáty (+8 oxidační stav) a xenon a plynný kyslík.[5] Obsahující pevné perxenáty XeO4−
6 byly izolovány reakcí XeO
3 s vodným roztokem hydroxidů. Oxid xenonový reaguje s anorganickými fluoridy, jako je KF, RbF nebo CsF, za vzniku stabilních pevných látek ve formě MXeO
3F.[6]
Fyzikální vlastnosti
Hydrolýza xenon hexafluorid nebo xenon tetrafluorid poskytuje roztok, ze kterého je bezbarvý XeO3 krystaly lze získat odpařením.[7] Krystaly jsou stabilní několik dní na suchém vzduchu, ale snadno absorbují vodu z vlhkého vzduchu a vytvářejí koncentrovaný roztok. Krystalová struktura je ortorombický s A = 6,163 Å, b = 8,115 Å, C = 5,234 Å a 4 molekuly na jednotku buňky. Hustota je 4,55 g / cm3.[8]
 |  |  |
krystalická struktura XeO3 |
Bezpečnost
XeO3 je třeba zacházet s velkou opatrností. Vzorky při pokojové teplotě nerušily. Suché krystaly reagují výbušně s celulózou.[8][9]
Reference
- ^ Zumdahl, Steven S. (2009). Chemické principy 6. vydání. Společnost Houghton Mifflin. str. A23. ISBN 978-0-618-94690-7.
- ^ Greenwood, N .; Earnshaw, A. (1997). Chemie prvků. Oxford: Butterworth-Heinemann.
- ^ Jaselskis B .; Krueger R. H. (červenec 1966). "Titrimetrické stanovení některých organických kyselin oxidací xenonoxidu". Talanta. 13 (7): 945–949. doi:10.1016/0039-9140(66)80192-3. PMID 18959958.
- ^ Peterson, J. L .; Claassen, H. H .; Appelman, E. H. (březen 1970). "Vibrační spektra a struktury iontů xenátu (VI) a perxenátu (VIII) ve vodném roztoku". Anorganická chemie. 9 (3): 619–621. doi:10.1021 / ic50085a037.
- ^ W. Henderson (2000). Chemie hlavní skupiny. Velká Británie: Royal Society of Chemistry. str.152 –153. ISBN 0-85404-617-8.
- ^ Egon Wiberg; Nils Wiberg; Arnold Frederick Holleman (2001). Anorganická chemie. Akademický tisk. str. 399. ISBN 0-12-352651-5.
- ^ John H. Holloway; Eric G. Hope (1998). A. G. Sykes (ed.). Nedávné pokroky v chemii ušlechtilých plynů. Advances in Anorganic Chemistry, svazek 46. Academic Press. str. 65. ISBN 0-12-023646-X.
- ^ A b Templeton, D. H .; Zalkin, A .; Forrester, J. D .; Williamson, S. M. (1963). "Krystalová a molekulární struktura oxidu xenonového". Journal of the American Chemical Society. 85 (6): 817. doi:10.1021 / ja00889a037.
- ^ Bartlett, N .; Rao, P. R. (1963). "Hydroxid xenonu: experimentální nebezpečí". Věda. 139 (3554): 506. Bibcode:1963Sci ... 139..506B. doi:10.1126 / science.139.3554.506. PMID 17843880.

