Skandium fluorid - Scandium fluoride
 | |
| Jména | |
|---|---|
| Název IUPAC Skandium (III) fluorid | |
| Ostatní jména Skandium trifluorid | |
| Identifikátory | |
3D model (JSmol ) | |
| Informační karta ECHA | 100.033.854 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| ScF3 | |
| Molární hmotnost | 101,95112 g / mol |
| Vzhled | zářivě bílý prášek |
| Hustota | 2,53 g / cm3 |
| Bod tání | 1552 ° C (2826 ° F; 1825 K)[1] |
| Bod varu | 1607 ° C (2925 ° F; 1880 K)[1] |
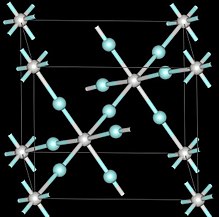
| Struktura | |
| Krychlový, Odpoledne3m | |
| Odpoledne3m, č. 221 | |
| Nebezpečí | |
| NFPA 704 (ohnivý diamant) | |
| Související sloučeniny | |
jiný anionty | Chlorid skandnatý (III) Bromid skandia (III) Jodid skandnatý (III) |
jiný kationty | Fluorid yttritý |
Související sloučeniny | Dusičnan skandia (III) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Skandium (III) fluorid, ScF3, je iontová sloučenina. Je mírně rozpustný ve vodě, ale rozpouští se v přítomnosti přebytečného fluoridu za vzniku ScF63− anion.[1]
Výroba
ScF3 lze vyrobit reakcí skandium a fluor.[2] Tvoří se také při těžbě z rudy thortveitite reakcí Sc2Ó3 s amonný bifluorid při vysoké teplotě:[3]
- Sc2Ó3 + 6 NH4HF2 → 2 ScF3 + 6 NH4F + 3 H2Ó
Výsledná směs obsahuje řadu fluoridů kovů a to se redukuje reakcí s kovem vápenatým při vysoké teplotě.[3] K výrobě použitelného kovového skandia jsou zapotřebí další kroky čištění.[3]
Vlastnosti
Skandium trifluorid vykazuje neobvyklou vlastnost negativní tepelná roztažnost, což znamená, že se při zahřátí zmenšuje. Tento jev je vysvětlen kvartickou oscilací fluoridových iontů. Energie uložená v ohybovém napětí fluoridového iontu je úměrná čtvrté síle úhlu posunutí, na rozdíl od většiny ostatních materiálů, kde je úměrná druhé mocnině posunutí. Atom fluoru je navázán na dva atomy skandia a jak se teplota zvyšuje, fluór osciluje více kolmo k jeho vazbám. Tento pohyb přitahuje atomy skandia dohromady skrz sypký materiál, který se smršťuje.[4] ScF3 vykazuje tuto vlastnost od nejméně 10 K do 1100 K, nad nimiž vykazuje normální pozitivní tepelnou roztažnost; dále má materiál kubickou symetrii v celém tomto teplotním rozsahu a až alespoň 1 600 K při okolním tlaku. Negativní tepelná roztažnost při velmi nízkých teplotách je poměrně silná (koeficient tepelné roztažnosti kolem -14 ppm / K mezi 60 a 110 K).[5]
Při tlacích okolí přijímá skandium trifluorid kubický krystalický systém pomocí perovskitová struktura s jednou kovovou pozicí volnou.[6] Rozměr jednotkové buňky je 4,01 Å.[6] Pod tlakem skandium trifluorid také tvoří různé krystalové struktury s rhombohedrálním a nad 3 GPa čtyřbokým.[6]
Reference
- ^ A b C Egon Wiberg, Arnold Frederick Holleman (2001) Anorganická chemie, Elsevier, ISBN 0-12-352651-5.
- ^ SA Cotton, Scandium, Yttrium and the Lanthanides: Anorganic and Coordination Chemistry, Encyclopedia of Anorganic Chemistry, 1994, John Wiley & Sons, ISBN 0-471-93620-0.
- ^ A b C Pradyot Patnaik, 2003, Handbook of Anorganic Chemicals, McGraw-Hill Professional, ISBN 0-07-049439-8.
- ^ Woo, Marcus (7. listopadu 2011). „Neuvěřitelný smršťovací materiál: Inženýři odhalují, jak se skandium trifluorid smršťuje teplem“. Physorg. Citováno 8. listopadu 2011.
- ^ Greve, Benjamin K .; Kenneth L. Martin; Peter L. Lee; Peter J. Chupas; Karena W. Chapman; Angus P. Wilkinson (19. října 2010). "Výrazná negativní teplotní expanze z jednoduché struktury: krychlový ScF3". Journal of the American Chemical Society. 132 (44): 15496–15498. doi:10.1021 / ja106711v. PMID 20958035.
- ^ A b C Aleksandrov, K. S .; V. N. Voronov; A. N. Vtyurin; A. S. Krylov; M. S. Molokeev; M. S. Pavlovskiĭ; S. V. Goryaĭnov; A. Yu. Likhacheva; A. I. Ancharov (2009). "Fázový přechod vyvolaný tlakem v krychlovém krystalu ScF3". Fyzika pevného stavu. 51 (4): 810–816. doi:10.1134 / S1063783409040295. ISSN 1063-7834. S2CID 119874020.
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |

