Konjugovaná kyselina - Conjugate acid
A konjugovaná kyselina, v rámci Brønsted – Lowryho acidobazická teorie, je chemická sloučenina vytvořená kyselinou daruje proton (H+ ) na a základna - jinými slovy, je to základna s vodík přidán iont, protože při reverzní reakci ztrácí vodíkový ion. Na druhou stranu a konjugovaná báze je to, co zbylo poté, co kyselina během chemické reakce darovala proton. Konjugovaná báze je tedy druh tvořený odstranění protonu z kyseliny, protože při reverzní reakci je schopen získat vodíkový iont.[1] Protože některé kyseliny jsou schopné uvolňovat více protonů, může být konjugovaná báze kyseliny sama o sobě kyselá.
V souhrnu to lze vyjádřit jako následující chemickou reakci:
- Acid + Base ⇌ Conjugate Base + Conjugate Acid


Johannes Nicolaus Brønsted a Martin Lowry představil Brønsted – Lowryovu teorii, která navrhovala, že jakákoli sloučenina, která může přenášet proton na jakoukoli jinou sloučeninu, je kyselina a sloučenina, která přijímá proton, je báze. Proton je jaderná částice s jednotkovým kladným elektrickým nábojem; je reprezentován symbolem H+ protože to představuje jádro vodíku atom,[2] to je, a vodíkový kation.
A kation může být konjugovaná kyselina a anion může být konjugovaná báze, v závislosti na tom látka je zapojen a který acidobazická teorie je hledisko. Nejjednodušší anion, kterým může být konjugovaná báze, je solvatovaný elektron jehož konjugovaná kyselina je atomový vodík.
Acidobazické reakce
V acidobazická reakce, kyselina plus báze reaguje za vzniku konjugované báze plus konjugované kyseliny:
Konjugáty se tvoří, když kyselina ztratí vodíkový proton nebo báze získá vodíkový proton. Viz následující obrázek:
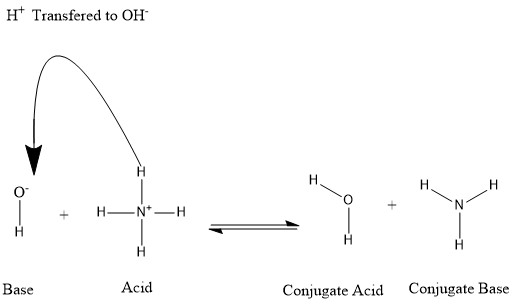
Říkáme, že molekula vody je konjugovaná kyselina hydroxidového iontu poté, co druhý dostal vodíkový proton darovaný amonný. Na druhou stranu, amoniak je konjugovaná báze pro kyselý amonium poté, co amonium darovalo vodíkový iont k produkci molekuly vody. Můžeme také označit OH- jako konjugovanou bázi H
2Ó, protože molekula vody daruje proton k produkci NH+
4 v reverzní reakci, což je v přírodě převládající proces díky síle báze NH
3 nad hydroxidovým iontem. Na základě těchto informací je zřejmé, že výrazy „kyselina“, „báze“, „konjugovaná kyselina“ a „konjugovaná báze“ nejsou pro určité chemické látky stanoveny; ale jsou zaměnitelné podle probíhající reakce.
Síla konjugátů
Síla konjugované kyseliny je přímo úměrná její disociační konstanta. Pokud je konjugovaná kyselina silná, bude mít její disociace vyšší rovnovážná konstanta a produkty reakce budou upřednostňovány. Síla konjugované báze může být viděna jako tendence druhu "přitahovat" vodíkové protony k sobě. Pokud je konjugovaná báze klasifikována jako silná, bude v roztoku „držet“ vodíkový proton a jeho kyselina nebude disociovat.
Pokud je druh klasifikován jako silná kyselina, jeho konjugovaná báze bude slabá.[3] Příkladem tohoto případu by byla disociace kyselina chlorovodíková HCl ve vodě. Protože HCl je silná kyselina (do značné míry disociuje), její konjugovaná báze (Cl−
) bude slabá konjugovaná báze. Proto je v tomto systému nejvíce H+
bude ve formě a hydronium ion H
3Ó+
místo připojení k Cl− anion a konjugovaná báze budou slabší než molekula vody.
Na druhou stranu, pokud je druh klasifikován jako slabá kyselina, jeho konjugovaná báze nebude nutně silnou bází. Uvažujme, že acetát, konjugovaná báze kyseliny octové, má disociační konstantu báze (Kb) přibližně 5,6x10−10, což z něj dělá slabou základnu. Aby druh měl silnou konjugovanou bázi, musí to být velmi slabá kyselina, například voda.
Identifikace konjugovaných párů kyselina-báze
Kyselina a konjugovaná báze, jakož i báze a konjugovaná kyselina jsou známé jako konjugované páry. Při hledání konjugované kyseliny nebo báze je důležité podívat se na reaktanty z chemická rovnice. V tomto případě jsou reaktanty kyseliny a zásady a kyselina odpovídá konjugované bázi na straně produktu chemické rovnice; stejně jako báze k konjugované kyselině na straně produktu rovnice.
K identifikaci konjugované kyseliny vyhledejte pár sloučenin, které jsou příbuzné. The acidobazická reakce lze zobrazit ve smyslu před a po. Předtím je strana reaktantu rovnice, po je produktová strana rovnice. Konjugovaná kyselina na druhé straně rovnice získává vodíkový iont, takže na předchozí straně rovnice je bází sloučenina, která má o jeden méně vodíkový iont konjugované kyseliny. Konjugovaná báze na druhé straně rovnice ztratila vodíkový iont, takže na předchozí straně rovnice je sloučeninou, která má ještě jeden vodíkový ion konjugované báze, kyselina.
Zvažte následující acidobazickou reakci:
- HNO
3 + H
2Ó → H
3Ó+
+ NE−
3
Kyselina dusičná (HNO
3) je kyselina protože daruje proton molekule vody a jejím konjugovaná báze je dusičnan (NE−
3). Molekula vody působí jako báze, protože přijímá vodíkový proton a jeho konjugovaná kyselina je hydronium ion (H
3Ó+
).
| Rovnice | Kyselina | Základna | Konjugovaná základna | Konjugovaná kyselina |
|---|---|---|---|---|
| HClO 2 + H 2Ó → ClO− 2 + H 3Ó+ | HClO 2 | H 2Ó | ClO− 2 | H 3Ó+ |
| ClO− + H 2Ó → HClO + ACH− | H 2Ó | ClO− | ACH− | HClO |
| HCl + H 2PO− 4 → Cl− + H 3PO 4 | HCl | H 2PO− 4 | Cl− | H 3PO 4 |
Aplikace
Jedno použití konjugovaných kyselin a zásad spočívá v pufrovacích systémech, které zahrnují a pufrovací roztok. V pufru se používá slabá kyselina a její konjugovaná báze (ve formě soli) nebo slabá báze a její konjugovaná kyselina, aby se omezila změna pH během titračního procesu. Pufry mají organické i neorganické chemické aplikace. Například kromě pufrů používaných v laboratorních procesech funguje naše krev jako pufr pro udržení pH. Nejdůležitějším nárazníkem v naší krvi je pufr s kyselinou uhličitou a hydrogenuhličitanem, který zabraňuje drastickým změnám pH, když CO
2 je představen. Toto funguje jako takové:
Dále je zde tabulka běžných vyrovnávacích pamětí.
Pufrovací prostředek pKA Užitečné rozmezí pH Kyselina citronová 3.13, 4.76, 6.40 2.1 - 7.4 Octová kyselina 4.8 3.8 - 5.8 KH2PO4, 7.2 6.2 - 8.2 CHES 9.3 8.3–10.3 Borate 9.24 8.25 - 10.25
Druhou běžnou aplikací s organickou sloučeninou by byla výroba pufru s kyselinou octovou. Pokud je kyselina octová, slabá kyselina se vzorcem CH
3COOH, byl vyroben do pufrovacího roztoku, bylo by ho třeba kombinovat s jeho konjugovanou bází CH
3VRKAT−
ve formě soli. Výsledná směs se nazývá acetátový pufr, sestávající z vodného roztoku CH
3COOH a vodné CH
3COONa. Kyselina octová spolu s mnoha dalšími slabými kyselinami slouží jako užitečné složky pufrů v různých laboratorních podmínkách, z nichž každá je užitečná ve svém vlastním rozsahu pH.
Příkladem anorganické sloučeniny by mohlo být lékařské použití konjugované báze kyseliny mléčné známé jako laktát v Ringerův laktátový roztok a Hartmannovo řešení. Kyselina mléčná má vzorec C
3H
6Ó
6 a jeho konjugovaná báze se používá v intravenózních tekutinách, které se skládají ze sodných a draselných kationtů spolu s laktátovými a chloridovými anionty v roztoku s destilovanou vodou. Tyto tekutiny jsou obvykle izotonické ve vztahu k lidské krvi a běžně se používají ke zvýšení hladiny tekutin v systému po těžké ztrátě krve v důsledku traumatu, chirurgického zákroku nebo popálení.
Tabulka kyselin a jejich konjugovaných bází
Níže je uvedeno několik příkladů kyselin a jejich konjugovaných bází; všimněte si, jak se liší pouze o jeden proton (H+ ion). Síla kyseliny klesá a síla konjugované báze se zvyšuje dolů po stole.
| Kyselina | Konjugovaná základna |
|---|---|
| H 2F+ Fluoronium ion | HF Fluorovodík |
| HCl Kyselina chlorovodíková | Cl− Chlorid ion |
| H2TAK4 Kyselina sírová | HSO− 4 Sírovodík ion |
| HNO3 Kyselina dusičná | NE− 3 Dusičnan ion |
| H3Ó+ Hydronium ion | H2Ó Voda |
| HSO− 4 Sírovodík ion | TAK2− 4 Síran ion |
| H3PO4 Kyselina fosforečná | H2PO− 4 Dihydrogenfosforečnan ion |
| CH3COOH Octová kyselina | CH3VRKAT− Acetát ion |
| HF Kyselina fluorovodíková | F− Fluorid ion |
| H2CO3 Kyselina uhličitá | HCO− 3 Hydrogenuhličitan ion |
| H2S Kyselina sírová | HS− Sirovodík ion |
| H2PO− 4 Dihydrogenfosforečnan ion | HPO2− 4 Fosforečnan vodíku ion |
| NH+ 4 Amoniak ion | NH3 Amoniak |
| H2O voda (pH =7) | ACH− Hydroxid ion |
| HCO− 3 Hydrogenuhličitan (hydrogenuhličitan) ion | CO2− 3 Uhličitan ion |
Tabulka bází a jejich konjugovaných kyselin
Naproti tomu je zde tabulka bází a jejich konjugovaných kyselin. Podobně klesá základní síla a zvyšuje se síla konjugované kyseliny v tabulce.
| Základna | Konjugovaná kyselina |
|---|---|
| C 2H 5NH 2 Ethylamin | C 2H 5NH+ 3 Ethylamonný iont |
| CH 3NH 2 Methylamin | CH 3NH+ 3 Methylamonium ion |
| NH 3 Amoniak | NH+ 4 Amoniak ion |
| C 5H 5N Pyridin | C 5H 6N+ Pyridinium |
| C 6H 5NH 2 Anilin | C 6H 5NH+ 3 Fenylamoniový iont |
| C 6H 5CO− 2 Benzoátový ion | C 6H 6CO 2 Kyselina benzoová |
| F− Fluorid ion | HF Fluorovodík |
| PO3− 4 Fosfát ion | HPO2− 4 Fosforečnan vodíku ion |
| ACH− Hydroxid ion | H2Ó Voda (neutrální, pH 7) |
Viz také
Reference
- ^ Zumdahl, Stephen S. a Zumdahl, Susan A. Chemie. Houghton Mifflin, 2007, ISBN 0618713700
- ^ "Brønsted – Lowryova teorie | chemie". Encyklopedie Britannica. Citováno 2020-02-25.
- ^ "Výuka chemie síly konjugovaných kyselin a zásad". www.ausetute.com.au. Citováno 2020-02-25.


