Tetrafluorid zirkoničitý - Zirconium tetrafluoride
 | |
| Jména | |
|---|---|
| Názvy IUPAC Fluorid zirkoničitý Tetrafluorid zirkoničitý | |
| Identifikátory | |
| |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.029.107 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| ZrF4 | |
| Molární hmotnost | 167,21 g / mol |
| Vzhled | bílý krystalický prášek |
| Hustota | 4,43 g / cm3 (20 ° C) |
| Bod tání | 910 ° C (1670 ° F; 1180 K) |
| 1,32 g / 100 ml (20 ° C) 1,388 g / 100 ml (25 ° C) | |
| Struktura | |
| Monoklinický, mS60 | |
| C12 / c1, č. 15 | |
| Nebezpečí | |
| Bod vzplanutí | Nehořlavé |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 98 mg / kg (orálně, myš) 98 mg / kg (orálně, potkan)[1] |
| Související sloučeniny | |
jiný anionty | Chlorid zirkoničitý Bromid zirkoničitý Jodid zirkoničitý |
jiný kationty | Fluorid titaničitý Fluorid hafnia (IV) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Fluorid zirkoničitý (ZrF4 ) je anorganické chemická sloučenina. Je to součást ZBLAN fluoridové sklo. Je nerozpustný ve vodě. Je hlavní složkou fluorozirkonátové brýle.
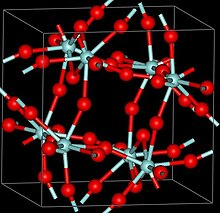
Tři krystalické fáze ZrF4 byly hlášeny, α (monoklinický ), β (čtyřúhelníkový, Pearsonův symbol tP40, vesmírná skupina P42 / m, č. 84) a γ (neznámá struktura). Fáze β a γ jsou nestabilní a při 400 ° C se nevratně transformují do fáze α.[2]
Fluorid zirkoničitý se používá jako zdroj zirkonia v aplikacích citlivých na kyslík, např. kovovýroba.[3] Fluorid zirkoničitý lze čistit pomocí destilace nebo sublimace.[4]
Podmínky / látky, kterým je třeba se vyhnout, jsou: vlhkost, aktivní kovy, kyseliny a oxidační činidla.
Fluorid zirkoničitý ve směsi s jinými fluoridy je chladicí kapalina pro reaktory s roztavenou solí. Ve směsi s Fluorid sodný je to chladicí kapalina kandidáta na Pokročilý vysokoteplotní reaktor.
Spolu s uranovou solí může být fluorid zirkoničitý součástí chladiva v reaktorech s roztavenou solí. Směs fluoridu sodného, fluoridu zirkoničitého a tetrafluorid uranu (53-41-6 mol.%) Byl použit jako chladivo v Experiment s leteckými reaktory. Směs fluorid lithný, fluorid berylnatý, fluorid zirkoničitý a tetrafluorid uranu 233 byl použit v Experiment reaktoru s roztavenou solí. (Uran-233 se používá v thoriový palivový cyklus reaktory.)
Reference
- ^ "Sloučeniny zirkonia (jako Zr)". Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Paul L. Brown; Federico J. Mompean; Jane Perrone; Myriam Illemassène (2005). Chemická termodynamika zirkonia. Gulf Professional Publishing. str. 144. ISBN 0-444-51803-7.
- ^ „Fluorid zirkoničitý“. Americké prvky. Citováno 2009-07-07.
- ^ „Způsob přípravy ultračistého tetrafluoridu zirkonia a hafnia. Patent USA 4578252“. Citováno 2009-07-07.
- ORNL / TM-2006/12 Posouzení kandidátských chladiv pro roztavenou sol pro Pokročilý vysokoteplotní reaktor (AHTR), březen 2006 (zpřístupněno 18. září 2008)
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
