Xenon oxytetrafluorid - Xenon oxytetrafluoride
 | |
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
| ChemSpider | |
| |
| |
| Vlastnosti | |
| XeOF4 | |
| Molární hmotnost | 223,23 g / mol |
| Vzhled | bezbarvá kapalina |
| Hustota | 3,17 g / cm3, kapalný |
| Bod tání | -46,2 ° C (-51,2 ° F; 227,0 K) |
| Reaguje s vodou | |
| Struktura | |
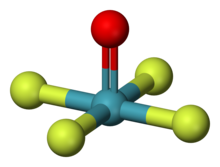
| čtvercový pyramidální[1][2] | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Xenon oxytetrafluorid (XeÓF4) je anorganické chemická sloučenina. Je to bezbarvá stabilní kapalina[3][2] s teplotou tání -46,2 ° C[4] které lze syntetizovat částečnou hydrolýzou XeF
6, nebo reakce XeF
6 s oxid křemičitý[3] nebo NaNO
3:[5]
- NaNO
3 + XeF
6 → NaF + XeOF
4 + FNO
2
Syntéza s vysokým výtěžkem probíhá reakcí XeF
6 s POF
3 při -196 ° C.[6]
Stejně jako většina oxidů xenonu je extrémně reaktivní a nestabilní a hydrolyzuje ve vodě za vzniku nebezpečně nebezpečných a korozivních produktů, včetně fluorovodík:
- 2 XeOF4 + 4 H2O → 2 Xe + 8 HF + 3 O2
Navíc některé ozón a také se tvoří fluor. Tato reakce je extrémně nebezpečná, a proto by měl být xenonoxytetrafluorid za všech podmínek udržován mimo jakoukoli stopu vody nebo vodní páry.
Reakce
XeOF4 reaguje s H2O v následujících krocích:
- XeOF4 + H2O → XeO2F2 + 2 HF
- XeO2F2 + H2O → XeO3 + 2 HF
The XeO3 vytvořená je nebezpečná výbušnina, která se výbušně rozkládá na Xe a O2:
- 2 XeO3 → 2 Xe + 3 O2
V tekuté formě XeOF
4 vykazuje amfoterní chování a tvoří komplexy s oběma silnými Lewisovými bázemi CsF a silné Lewisovy kyseliny jako SbF
5.[7] Tvoří adukt 1: 1 s XeF
2, isostrukturální s XeF
2·LI
5,[8] stejně jako různé těžké fluoridy alkalických kovů.[4]
Reakce XeOF
4 s XeO
3 poskytuje pohodlný způsob syntézy pro XeO
2F
2.[9]
externí odkazy
Reference
- ^ Joseph Martins; E. Bright Wilson Jr. (1964). "Mikrovlnné spektrum xenon oxytetrafluoridu". J. Chem. Phys. 41 (570): 570–571. doi:10.1063/1.1725910.
- ^ A b D. F. Smith (24. května 1963). "Xenon Oxyfluorid". Věda. 140 (3569): 899–900. doi:10.1126 / science.140.3569.899. PMID 17810680. S2CID 42752536.
- ^ A b James A. Ibers (říjen 1965). "Molekulární struktura". Roční přehled fyzikální chemie. 16: 375–396. doi:10.1146 / annurev.pc.16.100165.002111.
- ^ A b Henry Selig (1. února 1966). "Komplexy tetrafluoridu xenonoxidu". Inorg. Chem. 5 (2): 183–186. doi:10.1021 / ic50036a004.CS1 maint: datum a rok (odkaz)
- ^ Karl O. Christe; William W. Wilson (duben 1988). "Pohodlná syntéza tetrafluoridu xenonoxidu". Inorg. Chem. 27 (7): 1296–1297. doi:10.1021 / ic00280a043.CS1 maint: datum a rok (odkaz)
- ^ Nielsen, Jon B .; Kinkead, Scott A .; Eller, P. Gary (1. září 1990). „Nová syntéza xenon oxytetrafluoridu, XeOF
4". Inorg. Chem. 29 (18): 3621–3622. doi:10.1021 / ic00343a063.CS1 maint: datum a rok (odkaz) - ^ D. Martin-Rovet; C.Angelié; M.Cauchetier; GJ Schrobilgen (září 1982). „Různé aspekty reaktivity xenon (VI) oxyfluoridu: XeOF
4". Journal of Fluorine Chemistry. 21 (1): 10. doi:10.1016 / S0022-1139 (00) 85330-0. - ^ N. Bartlett; M. Wechsberg (říjen 1971). „Komplexy xenon-difluoridu XeF
2 · XeOF
4; XeF
2 · XeF
6 · AsF
5 a XeF
2 · 2 XeF
6 · 2 AsF
5 a jejich význam pro polaritu vazby a schopnost dárců fluoridových iontů XeF
2 a XeF
6". Z. Anorg. Allg. Chem. 385 (1). doi:10.1002 / zaac.19713850103. - ^ John L. Huston (září 1967). "Difluorid xenoničitý: izolace a některé vlastnosti". J. Phys. Chem. 71 (10): 3339–3341. doi:10.1021 / j100869a035.CS1 maint: datum a rok (odkaz)
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
