Tetrafluorid platiny - Platinum tetrafluoride
 | |
| Jména | |
|---|---|
| Název IUPAC Platina (IV) fluorid | |
| Ostatní jména Platina tetafluorid | |
| Identifikátory | |
3D model (JSmol ) | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| F4Pt | |
| Molární hmotnost | 271.078[1] |
| Vzhled | červenooranžová pevná látka[1] |
| Hustota | 7,08 g / cm3 (kal.)[2] |
| Bod tání | 600 ° C (1112 ° F; 873 K)[1] |
| +455.0·10−6 cm3/ mol | |
| Struktura | |
| Ortorombický, oF40 | |
| Fdd2, č. 43[2] | |
A = 0,9284 nm, b = 0,959 nm, C = 0,5712 nm | |
| Související sloučeniny | |
jiný anionty | Platina (IV) bromid Chlorid platičitý |
Související sloučeniny | Platina (V) fluorid Platina (VI) fluorid |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Tetrafluorid platiny je anorganická sloučenina s chemickým vzorcem PtF
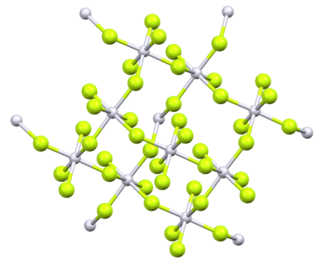
4. V pevném stavu má sloučenina v sobě platinu (IV) oktaedrická koordinační geometrie.[2]
Příprava
Sloučenina byla poprvé hlášena Henri Moissan podle fluorace platinového kovu za přítomnosti fluorovodík.[3] Moderní syntéza zahrnuje tepelný rozklad hexafluorid platiny.[4]
Vlastnosti
Pára tetrafluoridu platiny při 298,15 K sestává z jednotlivých molekul. Entalpie sublimace je 210 kJmol−1.[5] Původní analýza práškového PtF4 navrhl a čtyřboká molekulární geometrie, ale pozdější analýza několika metod ji identifikovala jako oktaedrickou, přičemž čtyři ze šesti fluorů na každé platině přemostily sousední platinová centra.[6]
Reakce
Roztok tetrafluoridu platiny ve vodě je zbarven červenohnědě, ale rychle se rozkládá, uvolňuje teplo a vytváří oranžově zbarvenou oxid platičitý hydrátová sraženina a kyselina fluorovodíková.[7]Při zahřátí na červeně horkou teplotu se platina tetrafluoridová rozloží na kov platiny a plynný fluor. Při zahřívání ve styku se sklem tetrafluorid křemičitý spolu s kovem se vyrábí plyn.[7]
Tetrafluorid platiny může tvořit adukty s tetrafluorid seleničitý a bromtrifluorid.[7] Těkavé krystalické adukty se také tvoří v kombinaci s BF3, PF3, BCl3a PCl3.[7]
Související sloučeniny
The fluoroplatináty jsou soli obsahující PtF62− ion. Kyselina fluorovodíková H2PtF6 tvoří žluté krystaly, které absorbují vodu ze vzduchu. Ve vodě jsou rozpustné amonné, sodné, hořečnaté, vápenaté, stronciové a vzácné zeminy, včetně solí fluorolatnatanu lanthanitého.[7] Soli draslíku, rubidia, cesia a barya jsou nerozpustné ve vodě.[7]
Reference
- ^ A b C Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92. vydání). Boca Raton, FL: CRC Press. p. 4,81. ISBN 1439855110.
- ^ A b C Mueller, B. G .; Serafin, M. (1992). „Vyšetřování monokrystalů na PtF4 a PtF5". European Journal of Solid State Anorganic Chemistry. 29: 625–633. doi:10.1002 / brada.199245006.[úplná citace nutná ]
- ^ Moissan, H. "Tetrafluorid platiny". Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences. 109: 807–9.
- ^ Slivnik, J. E .; Z̆emva, B .; Druz̆ina, B. (1980). "Nové syntézy platiny (IV) a platiny (VI) fluoridů". Journal of Fluorine Chemistry. 15 (4): 351. doi:10.1016 / S0022-1139 (00) 81471-2.
- ^ Bondarenko, A.A .; Korobov, M.V .; Mitkin, V.N; Sidorov, L.N (březen 1988). "Entalpie sublimace tetrafluoridu platiny". Žurnál chemické termodynamiky. 20 (3): 299–303. doi:10.1016/0021-9614(88)90125-5.
- ^ "Solid State Structure of the Binary Fluorides of the Transition Metals". Pokroky v anorganické chemii a radiochemii. 27. Akademický tisk. 1983. Oddíl V: Tetrafluoridy, strany 97–103. ISBN 9780080578767.
- ^ A b C d E F Derek Harry Lohmann (říjen 1961). Fluoridy platiny a příbuzných sloučenin (Teze). University of British Columbia.
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
