Omacetaxin mepesukcinát - Omacetaxine mepesuccinate - Wikipedia
 | |
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Synribo |
| AHFS /Drugs.com | Monografie |
| Licenční údaje | |
| Těhotenství kategorie |
|
| Trasy z správa | Podkožní, intravenózní infuze |
| ATC kód | |
| Právní status | |
| Právní status |
|
| Farmakokinetické data | |
| Vazba na bílkoviny | 50% |
| Metabolismus | Většinou prostřednictvím plazmatických esteráz |
| Odstranění poločas rozpadu | 6 hodin |
| Vylučování | Moč (≤15% beze změny) |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.164.439 |
| Chemické a fyzikální údaje | |
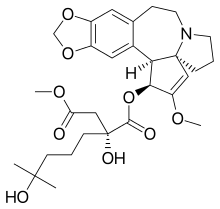
| Vzorec | C29H39NÓ9 |
| Molární hmotnost | 545.629 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
Omacetaxin mepesukcinát (HOSPODA, obchodní jména Synribo ), dříve pojmenovaný jako homoharringtonin nebo HHT, je farmaceutická léčivá látka, která je indikována k léčbě chronická myeloidní leukémie (CML).
HHT je přírodní rostlinný alkaloid odvozený od Cephalotaxus fortunei. HHT a příbuzné estery cefalotaxinu byly popsány poprvé v roce 1970 a byly předmětem intenzivního výzkumného úsilí čínských vyšetřovatelů objasnit jejich roli protirakovinných a antileukemických látek od 70. let do současnosti.[1] Byl schválen americkým úřadem FDA v říjnu 2012 pro léčbu dospělých pacientů s CML s rezistencí a / nebo intolerancí ke dvěma nebo více inhibitory tyrosinkinázy (TKI).[2]
Lékařské použití
Omacetaxin / homoharringtonin je indikován k použití jako léčba pacientů s chronická myeloidní leukémie kteří jsou rezistentní nebo netolerují inhibitory tyrosinkinázy.[3][4][5]
V červnu 2009 výsledky dlouhodobé otevřený Byly publikovány studie fáze II, které zkoumaly použití infuzí omacetaxinu u pacientů s CML. Po dvanácti měsících léčby vykazovala asi jedna třetina pacientů a cytogenetický Odezva.[6] Studie u pacientů, u nichž selhal imatinib a kteří měli mutaci T315I rezistentní na léky, dosáhla podle předběžných údajů cytogenetické odpovědi u 28% pacientů a hematologické odpovědi u 80% pacientů.[7]
Studie fáze I zahrnující malý počet pacientů prokázaly přínos léčby myelodysplastický syndrom (MDS, 25 pacientů)[8] a akutní myeloidní leukémie (AML, 76 pacientů).[9] Pacienti se solidními nádory neměli prospěch z omacetaxinu.[10]
Nepříznivé účinky
Podle frekvence:[2][3]
Velmi časté (> 10% frekvence):
- Průjem
- Myelosuprese†
- Reakce v místě vpichu
- Nevolnost
- Únava
- Horečka
- Svalová slabost
- Bolest kloubů
- Bolest hlavy
- Kašel
- Ztráta vlasů
- Zácpa
- Krvácení z nosu
- Bolest v horní části břicha
- Bolest v končetinách
- Otok
- Zvracení
- Bolesti zad
- Hyperglykémie, někdy extrémní
- Dna
- Vyrážka
- Nespavost
Časté (frekvence 1–10%):
- Záchvaty
- Krvácení
† Myelosuprese, včetně: trombocytopenie, anémie, neutropenie a lymfopenie, v sestupném pořadí podle frekvence.
Omacetaxin mepesukcinát může při podávání těhotné ženě způsobit poškození plodu. Ženy užívající HHT by se během užívání HHT měly vyvarovat otěhotnění a také by se neměly kojit.[11]
Mechanismus účinku
Omacetaxin je bílkovina překlad inhibitor. Inhibuje translaci proteinu tím, že brání počátečnímu kroku prodloužení syntézy proteinů. Interaguje s ribozomálním A-místem a brání správnému umístění postranních řetězců aminokyselin příchozích aminoacyl-tRNA. Omacetaxin působí pouze v počátečním kroku translace proteinu a neinhibuje syntézu proteinů z mRNA, které již zahájily translaci.[12]
Reference
- ^ Kantarjian HM, O'Brien S, Cortes J (říjen 2013). „Homoharringtonin / omacetaxin mepesukcinát: dlouhá a klikatá cesta ke schválení podávání potravin a léků“. Klinický lymfom, myelom a leukémie. 13 (5): 530–3. doi:10.1016 / j.clml.2013.03.017. PMC 3775965. PMID 23790799.
- ^ A b „Dávkování Synribo (omacetaxin), indikace, interakce, nežádoucí účinky a další“. Referenční příručka Medscape. WebMD. Citováno 18. února 2014.
- ^ A b "Injekce SYNRIBO (omacetaxin mepesukcinát), prášek, lyofilizovaný, pro roztok [Cephalon, Inc.]". DailyMed. Cephalon, Inc. říjen 2012. Citováno 18. února 2014.
- ^ Sweetman, S, ed. (14. listopadu 2012). "Omacetaxin mepesukcinát". Martindale: The Complete Drug Reference. Léky kompletní. Pharmaceutical Press.
- ^ Lacroix M (2014). Cílené terapie rakoviny. Hauppauge, NY: Vydavatelé Nova Sciences. ISBN 978-1-63321-687-7. Archivovány od originál dne 26.06.2015. Citováno 2014-07-13.
- ^ Li YF, Deng ZK, Xuan HB, Zhu JB, Ding BH, Liu XN, Chen BA (červen 2009). "Prodloužená chronická fáze u chronické myeloidní leukémie po léčbě homoharringtoninem". Čínský lékařský deník. 122 (12): 1413–7. PMID 19567163.
- ^ Quintás-Cardama A, Kantarjian H, Cortes J (prosinec 2009). „Homoharringtonin, omacetaxin mepesukcinát a chronická myeloidní leukémie kolem roku 2009“. Rakovina. 115 (23): 5382–93. doi:10.1002 / cncr.24601. PMID 19739234.
- ^ Wu L, Li X, Su J, Chang C, He Q, Zhang X a kol. (Září 2009). „Vliv režimu podávání základní dávky cytarabinu, homoharringtoninu a faktoru stimulujícího kolonie granulocytů na pacienty s pokročilým myelodysplastickým syndromem nebo akutní myeloidní leukémií transformovanou z myelodysplastického syndromu. Leukémie a lymfom. 50 (9): 1461–7. doi:10.1080/10428190903096719. PMID 19672772.
- ^ Gu LF, Zhang WG, Wang FX, Cao XM, Chen YX, He AL a kol. (Červen 2011). „Nízká dávka homoharringtoninu a cytarabinu v kombinaci s faktorem stimulujícím kolonie granulocytů na základě výsledku relabující nebo refrakterní akutní myeloidní leukémie.“ Journal of Cancer Research and Clinical Oncology. 137 (6): 997–1003. doi:10.1007 / s00432-010-0947-z. PMID 21152934.
- ^ Kantarjian HM, Talpaz M, Santini V, Murgo A, Cheson B, O'Brien SM (září 2001). „Homoharringtonin: historie, současný výzkum a budoucí směřování“. Rakovina. 92 (6): 1591–605. doi:10.1002 / 1097-0142 (20010915) 92: 6 <1591 :: AID-CNCR1485> 3.0.CO; 2-U. PMID 11745238.
- ^ „Štítek léčiva SYNRIBOTM (omacetaxin mepesukcinát)“ (PDF). FDA.
- ^ Wetzler M, Segal D (2011). „Omacetaxin jako protirakovinné léčivo: to, co je staré, je znovu nové“. Současný farmaceutický design. 17 (1): 59–64. doi:10.2174/138161211795049778. PMID 21294709.
