Melengestrol - Melengestrol
 | |
| Klinické údaje | |
|---|---|
| ATC kód |
|
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.024.613 |
| Chemické a fyzikální údaje | |
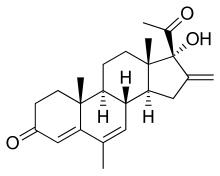
| Vzorec | C23H30Ó3 |
| Molární hmotnost | 354.490 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| | |
Melengestrol (HOSPODA, ZÁKAZ ) je steroidní progestin z 17a-hydroxyprogesteron skupina a antineoplastický lék který nikdy nebyl uveden na trh.[1] An acylovaný derivát, melengestrol-acetát, se používá jako růstový promotor u zvířat.[1]
Zatímco melengestrol se někdy používá jako synonymum pro melengestrol-acetát, na co se obvykle odkazuje, je melengestrol-acetát a ne melengestrol.
Syntéza
6-methyl-16-dehydropregnenolon-acetát (5) je klíčovým meziproduktem pro přípravu jak melengesterol acetátu, tak i medrogeston. Petrov a jeho spolupracovníci vymysleli několik zajímavých schémat, která sahají zpět diosgenin jako výchozí bod. Tato schémata provádějí nezbytné modifikace v kruzích A a B s postranním řetězcem sapogeninu stále na místě. V podstatě tento přístup využívá tento postranní řetězec jako chránící skupinu pro budoucí 16-dehydro-20-ketonovou funkci. V jedné z těchto cest se diosgenin nejprve převede na 3-toluensulfonát (1). Solvolýza tohoto derivátu homoallylkoholu poskytuje 3,5-cyklosteroid (2) prostřednictvím cyklopropylu karbinyl ion (karbeniový ion ) (nezobrazeno). (Tato obecná reakce byla pravděpodobně poprvé nalezena ve steroidech a nesla název „i- přeskupení steroidů. ") Oxidace produktu pomocí PCC poskytuje keton. Reakce tohoto s jodid methylmagnesium poskytuje dva izomerní karbinoly s převládajícím α-izomerem (3). Solvolýza v přítomnosti nukleofilu, jako je kyselina octová, obrátí cyklopropylkarbinyl transformaci za vzniku homoallyl-acetátu. Odstranění postranního řetězce sapogeninu vede k požadovanému produktu (5).[2]

Bylo zjištěno, že substituce na pozici 16 vedla k dalšímu potenciaci progestační aktivity. Reakce s diazomethan na konjugované dvojné vazbě v 16 dává nejprve pyrazol (6). Tento heterocyklus poskytuje 16 methyl enone na pyrolýza (7). Selektivní epoxidace konjugované dvojné vazby na 16,17α-epoxid se více než 5,6 dosáhne oxidací bázickými peroxid vodíku (8). Otevření tohoto tetrasubstituovaného oxirane kruh v kyselině postupuje se ztrátou protonu z polohy β (16 methyl) (9) za získání požadované 16-methylen-17a-hydroxy-20-ketonové funkce v D kruhu (10). Produkt je zmýdelněn a poté předmětem Oppenauerova oxidace, který se poté dehydrogenuje na 4,6-dien s chloranil (11). Acetylace za nutných podmínek dokončí syntézu melengesterol-acetátu.
Viz také
Reference
- ^ A b Macdonald F (1997). Slovník farmakologických látek. CRC Press. p. 1269. ISBN 978-0-412-46630-4. Citováno 30. května 2012.
- ^ Burn D, Ellis B, Petrow V, Stuart-Webb IA, Williamson DM (1957). "809. Modifikované steroidní hormony. Část IV. Deriváty 6-methylpregnanu". Journal of the Chemical Society (obnoveno): 4092. doi:10.1039 / JR9570004092.
- ^ Kirk DN, Petrow V, Williamson DM (1961). "550. Modifikované steroidní hormony. Část XXII. 6a, 16p-dimetylprogesteron a 17p-acetoxy-6p-methyl-16-methylenprogesteron". Journal of the Chemical Society (obnoveno): 2821. doi:10.1039 / JR9610002821.
| Tento lék článek týkající se genito-močový systém je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
| Tento článek o a steroid je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
