Pyridiniumchlorchromát - Pyridinium chlorochromate
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Pyridiniumchlorchromát | |||
| Ostatní jména PCC; Corey-Suggsovo činidlo | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.043.253 | ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C5H6ClCrNO3 | |||
| Molární hmotnost | 215,56 g / mol | ||
| Vzhled | žlutooranžová pevná látka[1] | ||
| Bod tání | 205 ° C (401 ° F; 478 K) | ||
| Rozpustnost v jiných rozpouštědlech | rozpustný v aceton, acetonitril, THF | ||
| Nebezpečí | |||
| Hlavní nebezpečí | Podezření na karcinogen a látku znečišťující životní prostředí | ||
| Bezpečnostní list | externí bezpečnostní list | ||
| Piktogramy GHS |     | ||
| H350, H272, H317, H410 | |||
| P201, P280, P273, P221, P308 + 313, P302 + 352 | |||
| NFPA 704 (ohnivý diamant) | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
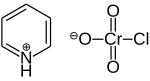
Pyridiniumchlorchromát (PCC) je žlutooranžový sůl s vzorec [C5H5NH]+[CrO3Cl]−. Je to činidlo v organická syntéza používá se především pro oxidace z alkoholy tvořit karbonyly. Je známa řada podobných sloučenin s podobnou reaktivitou. PCC nabízí výhodu selektivní oxidace alkoholů na aldehydy nebo ketony, zatímco mnoho jiných reagencií je méně selektivních.[1]
Struktura a příprava
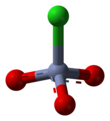
PCC se skládá z a pyridinium kation, [C.5H5NH]+a čtyřboký chlorchromanový anion [CrO3Cl]−. Jsou také známy příbuzné soli, jako je 1-butylpyridiniumchlorchromát, [C.5H5N (C.4H9)] [CrO3Cl] a chlorchroman draselný.
PCC je komerčně dostupný. Objeveno náhodou,[3] činidlo bylo původně připraveno přidáním pyridin do studeného roztoku oxid chromitý koncentrovaně kyselina chlorovodíková:[4]
- C5H5N + HCl + CrO3 → [C.5H5NH] [CrO3Cl]
V jedné alternativní metodě je tvorba chromylchlorid (CrO2Cl2) výpary během přípravy výše uvedeného roztoku byly minimalizovány pouhou změnou pořadí přidávání: ke pevnému oxidu chrómu byl za míchání přidán studený roztok pyridinu v koncentrované kyselině chlorovodíkové.[5]
Použití
Oxidace alkoholů
PCC se používá jako oxidant. Ukázalo se zejména, že je vysoce efektivní v oxidující primární a sekundární alkoholy na aldehydy a ketony, resp. Činidlo je selektivnější než příbuzné Jonesovo činidlo, takže existuje jen malá šance, že dojde k nadměrné oxidaci karboxylové kyseliny pokud není v reakční směsi voda. Typická oxidace PCC zahrnuje přidání alkoholu k suspenzi PCC v dichlormethan.[6][7][8] Obecná reakce je:
- 2 [C.5H5NH] [CrO3Cl] + 3 R2CHOH → 2 [C5H5NH] Cl + Cr2Ó3 + 3 R.2C = O + 3 H2Ó
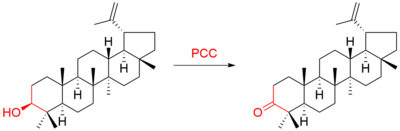
Například triterpen lupeol byl oxidován na lupenon:[9]
Další reakce
S terciárními alkoholy ester chromanu vytvořený z PCC může izomerizovat pomocí a [3,3] -sigmatropní reakce, Bablerova oxidace. Další běžná oxidační činidla obvykle vedou k dehydrataci, protože takové alkoholy nelze přímo oxidovat.
PCC také převádí vhodné nenasycené alkoholy a aldehydy na cyklohexenony. Tato cesta, oxidační kationtový cyklizace, je ilustrována převodem (-) -citronellol do (-) -pulegone. PCC také ovlivňuje allylové oxidace například při převodu dihydrofurany na furanony.[1]
Související činidla
Další vhodnější nebo méně toxická činidla pro oxidaci alkoholy zahrnout dimethylsulfoxid, který se používá v Swern a Pfitzner – Moffatt oxidace a hypervalentní sloučeniny jódu, tak jako Dess – Martin periodinane.
Bezpečnost
Jednou z nevýhod použití PCC je jeho toxicita, kterou sdílí s ostatními šestimocný chrom sloučeniny.
Viz také
Reference
- ^ A b C Piancatelli, G .; Luzzio, F. A. (2007). "Pyridinium Chlorochromate". e-EROS Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002 / 9780470842898.rp288.pub2.
- ^ „Bezpečnostní list“. Acros Organics. 2015. Citováno 2016-06-10.
- ^ Lowe, Derek. „Stará věc“. V potrubí. Věda. Citováno 2015-11-21.
- ^ Corey, E. J .; Suggs, J. W. (1975). "Pyridiniumchlorchromát. Účinné činidlo pro oxidaci primárních a sekundárních alkoholů na karbonylové sloučeniny". Tetrahedron Lett. 16 (31): 2647–2650. doi:10.1016 / S0040-4039 (00) 75204-X.
- ^ Agarwal, S .; Tiwari, H. P .; Sharma, J. P. (1990). „Pyridiniumchlorchromát: Vylepšená metoda pro jeho syntézu a použití bezvodé kyseliny octové jako katalyzátoru pro oxidační reakce“. Čtyřstěn. 46 (12): 4417–4420. doi:10.1016 / S0040-4020 (01) 86776-4.
- ^ Paquette, L. A .; Earle, M. J .; Smith, G. F. (1996). "(4R)-(+)-tert-Butyldimethylsiloxy-2-cyklopenten-1-on ". Organické syntézy. 73: 36.CS1 maint: více jmen: seznam autorů (odkaz); Kolektivní objem, 9, str. 132
- ^ Tu, Y .; Frohn, M .; Wang, Z.-X .; Shi, Y. (2003). „Syntéza 1,2: 4,5-diÓ-izopropyliden-D-erythro-2,3-hexodiulo-2,6-pyranóza. Vysoce enantioselektivní ketonový katalyzátor pro epoxidaci ". Organické syntézy. 80: 1.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ White, J. D .; Grether, USA; Lee, C.-S. (2005). "(R) - (+) - 3,4-dimethylcyklohex-2-en-1-on ". Organické syntézy. 82: 108.CS1 maint: více jmen: seznam autorů (odkaz); Kolektivní objem, 11, str. 100
- ^ Lao, A .; Fujimoto, Y .; Tatsuno, T. (1984). "Studie o složkách Artemisia argyi Lévl & Vant". Chem. Pharm. Býk. 32 (2): 723–727. doi:10,1248 / cpb.32.723. Citováno 2016-06-05.
Další čtení
- Tojo, G .; Fernández, M. (2006). Tojo, G. (ed.). Oxidace alkoholů na aldehydy a ketony: Průvodce současnou běžnou praxí. Základní reakce v organické syntéze. New York: Springer. ISBN 978-0-387-23607-0.