Faktor nekrózy nádorů - Tumor necrosis factor
tento článek může být pro většinu čtenářů příliš technická na to, aby je pochopili. Prosím pomozte to vylepšit na aby to bylo srozumitelné pro neodborníky, aniž by byly odstraněny technické podrobnosti. (Leden 2020) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
Faktor nekrózy nádorů (TNF, kachexinnebo cachectin; kdysi pojmenovaný jako faktor nekrózy nádorů alfa nebo TNFa) je buněčná signalizace bílkoviny (cytokin ) zapojený do systémového zánět a je jedním z cytokinů, které tvoří reakce akutní fáze. Vyrábí se hlavně aktivací makrofágy, ačkoli to může být produkováno mnoha jinými typy buněk, jako je T pomocné buňky, přirozené zabijácké buňky, neutrofily, žírné buňky, eosinofily, a neurony.[5] TNF je členem TNF nadčeleď, skládající se z různých transmembránové proteiny s homologní doménou TNF.
Primární role TNF je v regulaci imunitní buňky. TNF, který je endogenní pyrogen, je schopen vyvolat horečka, apoptotická buněčná smrt, kachexie, zánět a inhibovat tumorigeneze, virová replikace a reagovat na sepse přes IL-1 a IL-6 - produkující buňky. Dysregulace produkce TNF byla zapletena u různých lidí nemoci počítaje v to Alzheimerova choroba,[6] rakovina,[7] velká deprese,[8] psoriáza[9] a zánětlivé onemocnění střev (IBD).[10] Ačkoli jsou kontroverzní, studie deprese a IBD byly spojeny se zvýšenými hladinami TNF.[11][12] Rekombinantní TNF se používá jako imunostimulant pod HOSPODA tasonermin. TNF může být produkován ektopicky v podmínkách malignity a paralelně s parathormonem jak při způsobování sekundární hyperkalcémie, tak při rakovině, s níž je spojena nadměrná produkce.
Objev
Teorie protinádorový reakce imunitní systém in vivo byl uznán lékařem William B.Coley. V roce 1968 Gale A Granger z University of California, Irvine, uvádí cytotoxický faktor produkovaný lymfocyty a pojmenoval to lymfotoxin (LT).[13] Zásluhu na tomto objevu sdílí Nancy H. Ruddle z univerzita Yale, kteří uvedli stejnou aktivitu v sérii článků, které byly zveřejněny ve stejném měsíci.[14] Následně v roce 1975 Lloyd J. Old z Memorial Sloan-Kettering Cancer Center New York uvádí další cytotoxický faktor produkovaný makrofágy a pojmenovali jej faktor nádorové nekrózy (TNF).[15] Oba faktory byly popsány na základě jejich schopnosti zabíjet myši fibrosarkom Buňky L-929. Tyto koncepty byly rozšířeny na systémové onemocnění v roce 1981, kdy Ian A. Clark, od Australská národní univerzita, ve spolupráci s Elizabeth Carswell ve skupině Olda, pracující s údaji z doby před sekvenováním, usoudili, že nadměrná produkce TNF způsobuje malárii a otravu endotoxiny.[16][17]
The cDNA kódující LT a TNF byly naklonovaný v roce 1984[18] a bylo odhaleno, že jsou podobné. Vazba TNF na jeho receptor a jeho vytěsnění pomocí LT potvrdilo funkčnost homologie mezi těmito dvěma faktory. Sekvenční a funkční homologie TNF a LT vedla k přejmenování TNF na TNFa a LT as TNFp. V roce 1985 Bruce A. Beutler a Anthony Cerami objevili ten kachektin (hormon, který indukuje kachexie ) byl ve skutečnosti TNF.[19] Poté identifikovali TNF jako mediátora smrtícího endotoxin otrava.[20] Kevin J. Tracey a Cerami objevili klíčovou roli zprostředkovatele TNF ve smrtelném stavu septický šok a identifikovali terapeutické účinky monoklonálních anti-TNF protilátek.[21][22]
Výzkum v laboratoři Mark Mattson ukázal, že TNF může zabránit smrti /apoptóza neuronů mechanismem zahrnujícím aktivaci transkripčního faktoru NF-kB který vyvolává výraz antioxidační enzymy a Bcl-2.[23][24]
Gen
Lidský TNF gen byl klonován v roce 1985.[25] Mapuje se na chromozom 6p 21,3, zabírá asi 3 kilobáze a obsahuje 4 exony. Poslední exon sdílí podobnost s lymfotoxin alfa (LTA, jednou pojmenovaná jako TNF-β).[26] The tři primární nepřeložená oblast (3'-UTR) TNF obsahuje Element bohatý na AU (ARE).
Struktura
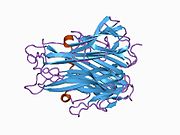
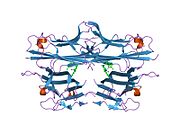
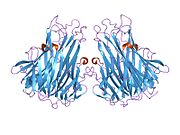
TNF se primárně vyrábí jako 233-aminokyselina -dlouho transmembránový protein typu II uspořádány ve stabilních homotrimerech.[27][28] Z této membránou integrované formy se rozpustný homotrimerický cytokin (sTNF) uvolňuje proteolytickým štěpením metaloproteázou TNF alfa konvertujícím enzym (TACE, také nazývaný 17. ADAM ).[29] Rozpustný 51 kDa trimerní sTNF má tendenci disociovat v koncentracích pod nanomolárním rozsahem, čímž ztrácí svou bioaktivitu. Vylučovaná forma lidského TNF získává trojúhelníkový tvar pyramidy a váží kolem 17 kDa. Vylučované i na membránu vázané formy jsou biologicky aktivní, i když jejich specifické funkce jsou kontroverzní. Ale obě formy mají překrývající se a odlišné biologické aktivity.[30]
Společný domácí myší TNF a lidský TNF se strukturně liší.[31] 17-kilodalton (kDa) TNF protomery (dlouhé 185 aminokyselin) jsou složeny ze dvou antiparalelní β skládané listy s antiparalelní β-řetězce, tvořící β-strukturu „želé rolky“, typickou pro rodinu TNF, ale také v virové kapsidové proteiny.
Buněčná signalizace
TNF může vázat dva receptory, TNFR1 (TNF receptor typ 1; CD120a; p55 / 60) a TNFR2 (TNF receptor typu 2; CD120b; p75 / 80). TNFR1 je 55-kDa a TNFR2 je 75-kDa.[32] TNFR1 je exprimován ve většině tkání a může být plně aktivován jak membránově vázanou, tak rozpustnou trimerní formou TNF, zatímco TNFR2 se typicky nachází v buňkách imunitní systém a reaguje na membránově vázanou formu homotrimeru TNF. Protože většina informací týkajících se signalizace TNF je odvozena z TNFR1, je role TNFR2 pravděpodobně podceňována. Alespoň částečně, protože TNRF2 nemá žádnou doménu intracelulární smrti, TNFR2 ano neuroprotektivní.[24]

Při kontaktu s jejich ligand TNF receptory také tvoří trimery, jejichž špičky zapadají do drážek vytvořených mezi TNF monomery. Tato vazba způsobuje konformační změnu v receptoru, což vede k disociaci inhibičního proteinu SODD z domény intracelulární smrti. Tato disociace umožňuje adaptační protein OBCHOD vázat se na smrtící doménu, která slouží jako platforma pro následnou vazbu na protein. Po navázání TRADD lze zahájit tři cesty.[33][34]
- Aktivace NF-kB: TRADD rekrutuje TRAF2 a RIP. TRAF2 na oplátku získává vícesložkový protein kináza IKK, umožňující serin-threonin kináza RIP jej aktivujte. Inhibiční protein, IκBα, který se normálně váže na NF-kB a inhibuje jeho translokaci, je fosforylovaný IKK a následně degradován, uvolňující NF-kB. NF-kB je heterodimerní transkripční faktor který se přemístí do jádro a zprostředkovává transkripci velkého množství proteinů podílejících se na přežití a proliferaci buněk, zánětlivá reakce a anti-apoptotický faktory.
- Aktivace MAPK cesty: z tři hlavní kaskády MAPK TNF indukuje silnou aktivaci stres -příbuzný JNK skupina, vyvolává umírněnou reakci skupiny p38-MAPK, a je zodpovědný za minimální aktivaci klasického ERK. TRAF2 / Rac aktivuje JNK -indukování proti proudu kinázy z MLK2 /MLK3,[35] TAK1, MEKK1 a POŽÁDAT1 (buď přímo, nebo prostřednictvím GCK a Trx). Osa SRC- Vav- Rac aktivuje MLK2 / MLK3 a tyto kinázy fosforylát MKK7, který se poté aktivuje JNK. JNK translokuje do jádra a aktivuje se transkripční faktory jako c-červen a ATF2. The JNK cesta je zapojena do diferenciace buněk šíření a je obecně pro-apoptotický.
- Indukce signalizace smrti: Jako všichni členové nadrodiny TNFR obsahující smrtící doménu je TNFR1 zapojen do signalizace smrti.[36] TNF-indukovaná buněčná smrt však hraje jen malou roli ve srovnání s jejími ohromnými funkcemi v zánětlivém procesu. Jeho schopnost vyvolávat smrt je ve srovnání s ostatními členy rodiny (např Fas ), a často maskovaný anti-apoptotický účinky NF-κB. Přesto se TRADD váže FADD, který poté rekrutuje cysteinová proteáza kaspáza-8. Vysoká koncentrace kaspáza -8 indukuje jeho autoproteolytickou aktivaci a následné štěpení efektoru kaspázy, což vede k buňce apoptóza.
Nesčetné a často protichůdné účinky zprostředkované výše uvedenými cestami naznačují existenci rozsáhlého vzájemného rozhovoru. Například NF-kB zvyšuje transkripci C-FLIP, Bcl-2, a cIAP1 / cIAP2, inhibiční proteiny, které interferují se signalizací smrti. Na druhé straně aktivované kaspázy štěpí několik složek dráhy NF-kB, včetně RIP, IKK a podjednotek samotného NF-kB. Další faktory, jako je typ buňky, současná stimulace jiných cytokiny nebo částka reaktivní formy kyslíku (ROS) může posunout rovnováhu ve prospěch jedné nebo druhé cesty.[Citace je zapotřebí ] Taková komplikovaná signalizace zajišťuje, že kdykoli se uvolní TNF, na které mohou všechny buňky s nesmírně rozmanitými funkcemi a podmínkami náležitě reagovat zánět.[Citace je zapotřebí ] Obě proteinové molekuly faktor nekrózy nádoru alfa a keratin 17 se zdají být v souvislosti s orální submukózní fibrózou příbuzné.[37]
U zvířecích modelů TNF selektivně zabíjí autoreaktivní T buňky.[38]
Regulace enzymů
Tento protein může používat morpheein model alosterická regulace.[39]
Fyziologie
Předpokládalo se, že TNF vyrábí především makrofágy,[40] ale je produkován také širokou škálou typů buněk včetně lymfoidní buňky, žírné buňky, endoteliální buňky, srdeční myocyty, tuková tkáň, fibroblasty, a neurony.[5] V reakci na uvolňuje se velké množství TNF lipopolysacharid, jiný bakteriální výrobky a Interleukin-1 (IL-1). V kůži se zdá, že žírné buňky jsou hlavním zdrojem předem vytvořeného TNF, který se může uvolňovat při zánětlivém stimulu (např. LPS).[41]
Má řadu akcí na různé orgánové systémy, obvykle společně s IL-1 a Interleukin-6 (IL-6):
- Na hypotalamus:
- Stimulace osa hypotalamus-hypofýza-nadledviny stimulací uvolňování hormon uvolňující kortikotropin (CRH)
- Potlačení chuť
- Horečka
- Na játra: stimulace reakce akutní fáze, což vede ke zvýšení C-reaktivní protein a řada dalších mediátorů. Také vyvolává rezistence na inzulín podporou serin-fosforylace substrát inzulínového receptoru-1 (IRS-1), což zhoršuje signalizaci inzulínu
- Je to silný chemoatraktant pro neutrofily, a podporuje expresi adhezních molekul na endoteliální buňky, pomáhání neutrofily migrovat.
- Na makrofágech: stimuluje fagocytóza a produkce IL-1 oxidantů a zánětlivých lipidů Prostaglandin E2 (PGE2)
- Na jiných tkáních: zvyšuje se rezistence na inzulín. TNF fosforyluje serinové zbytky inzulínového receptoru a blokuje signální transdukci.
- Na metabolismus a příjem potravy: reguluje vnímání hořké chuti.[42]
Místní zvýšení koncentrace TNF způsobí výskyt hlavních příznaků zánětu: teplo, otoky, zarudnutí, bolest a ztrátu funkce.
Zatímco vysoké koncentrace TNF indukují příznaky podobné šoku, může mít za následek dlouhodobé vystavení nízkým koncentracím TNF kachexie syndrom plýtvání. To lze najít například v rakovina pacientů.
Said a kol. ukázaly, že TNF způsobuje IL-10 závislou inhibici expanze a funkce T-buněk CD4 zvýšením regulace hladin PD-1 na monocytech, což vede k produkci IL-10 monocyty po navázání PD-1 na PD-L.[43]
Výzkum Pedersena a kol. naznačuje, že nárůst TNF v reakci na sepse je inhibován cvičením vyvolanou produkcí myokiny. Ke studiu, zda akutní cvičení vyvolává skutečnou protizánětlivou reakci, byl zaveden model „nízkého stupně zánětu“, ve kterém byla nízká dávka E. coli endotoxin byl podáván zdravým dobrovolníkům, kteří byli randomizováni buď k odpočinku nebo cvičení před podáním endotoxinu. U klidových subjektů vyvolal endotoxin 2 až 3násobné zvýšení cirkulujících hladin TNF. Naproti tomu, když subjekty prováděly 3 hodiny cyklování ergometru a dostaly bolí endotoxinu za 2,5 hodiny, byla reakce TNF úplně otupená.[44] Tato studie poskytuje určité důkazy, že akutní cvičení může inhibovat produkci TNF.[45]
TNF může chránit před excitotoxicita.[24] TNF v neuronech podporuje jejich přežití, zatímco TNF v makrofágech a mikrogliích vede k neurotoxinům, které indukují apoptózu.[24]
Farmakologie
TNF podporuje zánětlivou reakci, která zase způsobuje mnoho klinických problémů spojených s autoimunitními poruchami, jako je revmatoidní artritida, ankylozující spondylitida, zánětlivé onemocnění střev, psoriáza, hidradenitis suppurativa a žáruvzdorný astma. Tyto poruchy se někdy léčí pomocí a TNF inhibitor. Této inhibice lze dosáhnout pomocí a monoklonální protilátka jako infliximab (Remicade) vazba přímo na TNF, adalimumab (Humira), certolizumab pegol (Cimzia) nebo s návnadou cirkulujícím receptorem fúzní protein jako etanercept (Enbrel), který se váže na TNF s větší afinitou než TNFR.[46]
Na druhé straně se u některých pacientů léčených inhibitory TNF objeví zhoršení jejich onemocnění nebo nový nástup autoimunity. Zdá se, že TNF má také imunosupresivní aspekt. Jedním z vysvětlení možného mechanismu je toto pozorování, na které má TNF pozitivní vliv regulační T buňky (Tregs), díky své vazbě na receptor 2 faktoru nekrotizující nádory (TNFR2).[47]
Terapie anti-TNF prokázala při léčbě rakoviny pouze mírné účinky. Léčba karcinom ledvin s infliximab vedlo k prodloužené stabilizaci onemocnění u některých pacientů. Etanercept byl testován na léčbu pacientů s rakovina prsu a rakovina vaječníků vykazující prodlouženou stabilizaci nemoci u určitých pacientů prostřednictvím downregulace IL-6 a CCL2. Na druhou stranu přidávání infliximab nebo etanercept na gemcitabin pro léčbu pacientů s pokročilým rakovina slinivky nebyl ve srovnání s placebem spojen s rozdíly v účinnosti.[48]
Interakce
Bylo prokázáno, že TNF komunikovat s TNFRSF1A.[49][50]
Nomenklatura
Protože LTα již není označován jako TNFp [51], TNFα, jako předchozí genový symbol, se nyní jednoduše nazývá TNF, jak je znázorněno na HGNC Databáze (Výbor pro genovou nomenklaturu HUGO).
Reference
- ^ A b C ENSG00000230108, ENSG00000223952, ENSG00000204490, ENSG00000228321, ENSG00000232810, ENSG00000228849, ENSG00000206439 GRCh38: Ensembl uvolnění 89: ENSG00000228978, ENSG00000230108, ENSG00000223952, ENSG00000204490, ENSG00000228321, ENSG00000232810, ENSG00000228849, ENSG00000206439 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000024401 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b 9218250
- ^ Swardfager W, Lanctôt K, Rothenburg L, Wong A, Cappell J, Herrmann N (2010). „Metaanalýza cytokinů u Alzheimerovy choroby“. Biol psychiatrie. 68 (10): 930–941. doi:10.1016 / j.biopsych.2010.06.012. PMID 20692646. S2CID 6544784.
- ^ Locksley RM, Killeen N, Lenardo MJ (2001). "TNF a TNF receptorové superrodiny: integrace biologie savců". Buňka. 104 (4): 487–501. doi:10.1016 / S0092-8674 (01) 00237-9. PMID 11239407. S2CID 7657797.
- ^ Dowlati Y, Herrmann N, Swardfager W, Liu H, Sham L, Reim EK, Lanctôt KL (2010). „Metaanalýza cytokinů při závažné depresi“. Biol psychiatrie. 67 (5): 446–457. doi:10.1016 / j.biopsych.2009.09.033. PMID 20015486. S2CID 230209.
- ^ Victor FC, Gottlieb AB (2002). „TNF-alfa a apoptóza: důsledky pro patogenezi a léčbu psoriázy“. J Drug Dermatol. 1 (3): 264–75. PMID 12851985.
- ^ Brynskov J, Foegh P, Pedersen G, Ellervik C, Kirkegaard T, Bingham A, Saermark T (2002). „Aktivita enzymu přeměňujícího faktor nekrózy alfa (TACE) na sliznici tlustého střeva pacientů se zánětlivým onemocněním střev“. Střevo. 51 (1): 37–43. doi:10,1136 / střeva. 51.1.37. PMC 1773288. PMID 12077089.
- ^ Mikocka-Walus AA, Turnbull DA, Molding NT, Wilson IG, Andrews JM, Holtmann GJ (2007). „Spory o komorbiditě deprese a úzkosti u pacientů se zánětlivým onemocněním střev: přehled literatury“. Zánětlivá onemocnění střev. 13 (2): 225–234. doi:10.1002 / ibd.20062. PMID 17206706.
- ^ Bobińska K, Gałecka E, Szemraj J, Gałecki P, Talarowska M (2017). „Existuje souvislost mezi expresí genu TNF a kognitivními deficity u deprese?“. Acta Biochim. Pol. 64 (1): 65–73. doi:10.18388 / abp.2016_1276. PMID 27991935.
- ^ Kolb WP, Granger GA (1968). "Cytotoxicita lymfocytů in vitro: charakterizace lidského lymfotoxinu". Proc. Natl. Acad. Sci. USA. 61 (4): 1250–5. Bibcode:1968PNAS ... 61,1250 tis. doi:10.1073 / pnas.61.4.1250. PMC 225248. PMID 5249808.
- ^ Ruddle NH, Waksman BH (prosinec 1968). "Cytotoxicita zprostředkovaná rozpustným antigenem a lymfocyty při opožděné přecitlivělosti. 3. Analýza mechanismu". J. Exp. Med. 128 (6): 1267–79. doi:10.1084 / jem.128.6.1267. PMC 2138574. PMID 5693925.
- ^ Carswell EA, Old LJ, Kassel RL, Green S, Fiore N, Williamson B (1975). „Endotoxinem indukovaný sérový faktor, který způsobuje nekrózu nádorů“. Proc. Natl. Acad. Sci. USA. 72 (9): 3666–70. Bibcode:1975PNAS ... 72,3666C. doi:10.1073 / pnas.72.9.3666. PMC 433057. PMID 1103152.
- ^ Clark IA, Virelizier JL, Carswell EA, Wood PR (červen 1981). „Možný význam mediátorů odvozených od makrofágů při akutní malárii“. Infikovat. Immun. 32 (3): 1058–66. doi:10.1128 / IAI.32.3.1058-1066.1981. PMC 351558. PMID 6166564.
- ^ Clark IA (červenec 1982). „Navrhovaný význam monokinů v patofyziologii endotoxinového šoku a malárie“. Klin. Wochenschr. 60 (14): 756–8. doi:10.1007 / BF01716573. PMID 6181289. S2CID 26446784.
- ^ Pennica D, Nedwin GE, Hayflick JS, Seeburg PH, Derynck R, Palladino MA, Kohr WJ, Aggarwal BB, Goeddel DV (1984). "Faktor nekrózy lidského nádoru: struktura prekurzoru, exprese a homologie s lymfotoxinem". Příroda. 312 (5996): 724–9. Bibcode:1984Natur.312..724P. doi:10.1038 / 312724a0. PMID 6392892. S2CID 4245957.
- ^ Beutler B, Greenwald D, Hulmes JD, Chang M, Pan YC, Mathison J, Ulevitch R, Cerami A (1985). "Identita faktoru nekrózy nádoru a makrochágem vylučovaného faktoru kachektinu". Příroda. 316 (6028): 552–4. Bibcode:1985 Natur.316..552B. doi:10.1038 / 316552a0. PMID 2993897. S2CID 4339006.
- ^ Beutler B, Milsark IW, Cerami AC (srpen 1985). „Pasivní imunizace proti faktoru nekrotizující kachektin / nádor chrání myši před letálním účinkem endotoxinu“. Věda. 229 (4716): 869–71. Bibcode:1985Sci ... 229..869B. doi:10.1126 / science.3895437. PMID 3895437.
- ^ Tracey KJ, Beutler B, Lowry SF, Merryweather J, Wolpe S, Milsark IW, Hariri RJ, Fahey TJ, Zentella A, Albert JD (říjen 1986). "Šok a poškození tkáně vyvolané rekombinantním lidským kachektinem". Věda. 234 (4775): 470–74. Bibcode:1986Sci ... 234..470T. doi:10.1126 / science.3764421. PMID 3764421.
- ^ Tracey KJ, Fong Y, Hesse DG, Manogue KR, Lee AT, Kuo GC, Lowry SF, Cerami A (prosinec 1987). „Anti-cachectin / TNF monoklonální protilátky zabraňují septickému šoku během smrtelné bakterémie“. Příroda. 330 (6149): 662–64. Bibcode:1987Natur.330..662T. doi:10.1038 / 330662a0. PMID 3317066. S2CID 4308324.
- ^ Mattson MP, Meffert MK (2006). "Role pro NF-kappaB v přežití nervových buněk, plasticitě a nemoci". Smrt buněk a diferenciace. 13 (5): 852–860. doi:10.1038 / sj.cdd.4401837. PMID 16397579.
- ^ A b C d Chadwick W, Magnus T, poslanec Mattson, Maudsley S (2008). „Cílení na receptory TNF-alfa pro neuroterapeutika“. Trendy v neurovědách. 31 (10): 504–511. doi:10.1016 / j.tins.2008.07.005. PMC 2574933. PMID 18774186.
- ^ Old LJ (1985). "Faktor nekrózy nádoru (TNF)". Věda. 230 (4726): 630–2. Bibcode:1985Sci ... 230..630O. doi:10.1126 / science.2413547. PMID 2413547.
- ^ Nedwin GE, Naylor SL, Sakaguchi AY, Smith D, Jarrett-Nedwin J, Pennica D, Goeddel DV, Gray PW (1985). „Geny pro lidský lymfotoxin a faktor nekrotizující nádory: struktura, homologie a chromozomální lokalizace“. Nucleic Acids Res. 13 (17): 6361–73. doi:10.1093 / nar / 13.17.6361. PMC 321958. PMID 2995927.
- ^ Kriegler M, Perez C, DeFay K, Albert I, Lu SD (1988). „Novou formou TNF / kachektinu je cytotoxický transmembránový protein na buněčném povrchu: důsledky komplexní fyziologie TNF.“ Buňka. 53 (1): 45–53. doi:10.1016/0092-8674(88)90486-2. PMID 3349526. S2CID 31789769.
- ^ Tang P, Klostergaard J (1996). „Lidský pro-tumorový nekrotický faktor je homotrimer“. Biochemie. 35 (25): 8216–25. doi:10.1021 / bi952182t. PMID 8679576.
- ^ Black RA, Rauch CT, Kozlosky CJ, Peschon JJ, Slack JL, Wolfson MF, Castner BJ, Stocking KL, Reddy P, Srinivasan S, Nelson N, Boiani N, Schooley KA, Gerhart M, Davis R, Fitzner JN, Johnson RS Paxton RJ, March CJ, Cerretti DP (1997). „Metaloproteináza desintegrin, který uvolňuje faktor nekrózy nádorů alfa z buněk“. Příroda. 385 (6618): 729–33. Bibcode:1997 Natur.385..729B. doi:10.1038 / 385729a0. PMID 9034190. S2CID 4251053.
- ^ Palladino MA, Bahjat FR, Theodorakis EA, Moldawer LL (září 2003). „Anti-TNF-α terapie: nová generace“. Recenze přírody Objev drog. 2 (9): 736–46. Bibcode:2003Natur.002..736B. doi:10.1038 / nrd1175. PMID 12951580. S2CID 1028523.
- ^ Olszewski MB, Groot AJ, Dastych J, Knol EF (květen 2007). „Přenos TNF do granulí lidských mastocytů: zralá endocytóza závislá na řetězci“. J. Immunol. 178 (9): 5701–9. doi:10,4049 / jimmunol.178.9.5701. PMID 17442953.
V lidských buňkách, na rozdíl od výsledků dříve získaných v modelu hlodavců, se zdá, že TNF není glykosylovaný, a proto je obchodování nezávislé na sacharidech. Ve snaze lokalizovat aminokyselinový motiv odpovědný za cílení na granule jsme zkonstruovali další fúzní proteiny a analyzovali jejich přenos a dospěli jsme k závěru, že sekvence zaměřené na granule jsou lokalizovány ve zralém řetězci TNF a že cytoplazmatický konec je použitelný pro endocytotické třídění. cytokin, čímž se vylučují přímé interakce s proteiny intracelulárního adaptéru
- ^ Theiss. A. L. a kol. 2005. Tumorový nekrotický faktor (TNF) alfa zvyšuje akumulaci a proliferaci kolagenu ve střevních myofibrobastech prostřednictvím TNF Receptor 2. The Journal of Biological Chemistry. [Online] 2005. Dostupné na: http://www.jbc.org/content/280/43/36099.long Přístup: 21/10/14
- ^ Wajant H, Pfizenmaier K, Scheurich P (2003). "Signalizace faktoru nekrózy nádoru". Buněčná smrt se liší. 10 (1): 45–65. doi:10.1038 / sj.cdd.4401189. PMID 12655295.
- ^ Chen G, Goeddel DV (2002). „Signalizace TNF-R1: krásná cesta“. Věda. 296 (5573): 1634–5. Bibcode:2002Sci ... 296.1634C. doi:10.1126 / science.1071924. PMID 12040173. S2CID 25321662.
- ^ Kant S, Swat W, Zhang S, Zhang ZY, Neel BG, Flavell RA, Davis RJ (2011). "Aktivace MAP kinázy stimulovaná TNF zprostředkovaná signální cestou GTPasy rodiny Rho". Genes Dev. 25 (19): 2069–78. doi:10.1101 / gad.17224711. PMC 3197205. PMID 21979919.
- ^ Gaur U, Aggarwal BB (2003). „Regulace proliferace, přežití a apoptózy členy nadrodiny TNF“. Biochem. Pharmacol. 66 (8): 1403–8. doi:10.1016 / S0006-2952 (03) 00490-8. PMID 14555214.
- ^ Ghada A. Abd El Latif, Tumorový nekrotický faktor alfa a exprese keratinu 17 v orální submukózní fibróze na modelu krysy, E.D.J. Sv. 65, (1), str. 277-288; 2019. DOI: 10.21608 / edj.2015.71414
- ^ Ban L, Zhang J, Wang L, Kuhtreiber W, Burger D, Faustman DL (2008). "Selektivní smrt autoreaktivních T buněk u lidského diabetu TNF nebo agonismem TNF receptoru 2". PNAS. 105 (36): 13644–13649. doi:10.1073 / pnas.0803429105. PMC 2533243. PMID 18755894.
- ^ Selwood T, Jaffe EK (2011). „Dynamické disociační homo-oligomery a řízení funkce proteinu“. Oblouk. Biochem. Biophys. 519 (2): 131–43. doi:10.1016 / j.abb.2011.11.020. PMC 3298769. PMID 22182754.
- ^ Olszewski a kol. (2007). „Obchodování s TNF na granule lidských mastocytů: zralá endocytóza závislá na řetězci“. The Journal of Immunology. 178 (9): 5701–5709. doi:10,4049 / jimmunol.178.9.5701. PMID 17442953.
- ^ Walsh LJ, Trinchieri G, Waldorf HA, Whitaker D, Murphy GF (květen 1991). „Lidské dermální žírné buňky obsahují a uvolňují tumor nekrotizující faktor alfa, který indukuje molekulu adheze endoteliálních leukocytů 1“. Proc. Natl. Acad. Sci. USA. 88 (10): 4220–4. Bibcode:1991PNAS ... 88,4220W. doi:10.1073 / pnas.88.10.4220. PMC 51630. PMID 1709737.
- ^ Feng P, Jyotaki M, Kim A, Chai J, Simon N, Zhou M, Bachmanov AA, Huang L, Wang H (říjen 2015). „Regulace reakcí hořké chuti faktorem nekrózy nádoru“. Mozek, chování a imunita. 49: 32–42. doi:10.1016 / j.bbi.2015.04.001. PMC 4567432. PMID 25911043.
- ^ Řekli EA, Dupuy FP, Trautmann L, Zhang Y, Shi Y, El-Far M, Hill BJ, Noto A, Ancuta P, Peretz Y, Fonseca SG, Van Grevenynghe J, Boulassel MR, Bruneau J, Shoukry NH, Routy JP , Douek DC, Haddad EK, Sekaly RP (duben 2010). „Programovaná produkce interleukinu-10 indukovaná smrtí 1 monocyty zhoršuje aktivaci CD4 + T buněk během infekce HIV“. Nat. Med. 16 (4): 452–9. doi:10,1038 / nm. 2106. PMC 4229134. PMID 20208540.
- ^ Starkie R, Ostrowski SR, Jauffred S, Febbraio M, Pedersen BK (2003). „Cvičení a infuze IL-6 inhibují endotoxinem indukovanou produkci TNF-a u lidí“. FASEB J. 17 (8): 884–886. doi:10.1096 / fj.02-0670fje. PMID 12626436. S2CID 30200779.
- ^ Pedersen BK (prosinec 2009). „Nemoc fyzické nečinnosti - a role myokinů při křížové komunikaci sval-tuk“. J. Physiol. 587 (23): 5559–5568. doi:10.1113 / jphysiol.2009.179515. PMC 2805368. PMID 19752112.
- ^ Haraoui, B; Bykerk, V (2007). "Etanercept v léčbě revmatoidní artritidy". Terapeutika a řízení klinických rizik. 3 (1): 99–105. doi:10.2147 / tcrm.2007.3.1.99. PMC 1936291. PMID 18360618.
- ^ Salomon BL, Leclerc M, Tosello J, Ronin E, Piaggio E, Cohen JL (2018). „Tumorový nekrotický faktor α a regulační T buňky v onkoimunologii“. Přední. Immunol. 9: 444. doi:10.3389 / fimmu.2018.00444. PMC 5857565. PMID 29593717.
- ^ Korneev, KV; Atretkhany, KN; Drutskaya, MS; Grivennikov, SI; Kuprash, DV; Nedospasov, SA (leden 2017). "TLR-signální a prozánětlivé cytokiny jako hybné síly tumorigeneze". Cytokin. 89: 127–135. doi:10.1016 / j.cyto.2016.01.021. PMID 26854213.
- ^ Bouwmeester T, Bauch A, Ruffner H, Angrand PO, Bergamini G, Croughton K, Cruciat C, Eberhard D, Gagneur J, Ghidelli S, Hopf C, Huhse B, Mangano R, Michon AM, Schirle M, Schlegl J, Schwab M , Stein MA, Bauer A, Casari G, Drewes G, Gavin AC, Jackson DB, Joberty G, Neubauer G, Rick J, Kuster B, Superti-Furga G (únor 2004). "Fyzická a funkční mapa transdukční cesty signálu lidského TNF alfa / NF-kappa B". Nat. Cell Biol. 6 (2): 97–105. doi:10.1038 / ncb1086. PMID 14743216. S2CID 11683986.
- ^ Micheau O, Tschopp J (červenec 2003). „Indukce apoptózy zprostředkované TNF receptorem I prostřednictvím dvou sekvenčních signálních komplexů“ (PDF). Buňka. 114 (2): 181–90. doi:10.1016 / S0092-8674 (03) 00521-X. PMID 12887920. S2CID 17145731.
- ^ Clark IA (červen – srpen 2007). "Jak byl TNF uznán jako klíčový mechanismus nemoci". Cytokinový růstový faktor Rev. 18 (3–4): 335–343. doi:10.1016 / j.cytogfr.2007.04.002. PMID 17493863.
externí odkazy
- "Tasonermin". Informační portál o drogách. Americká národní lékařská knihovna.
- „Faktor alfa nekrózy nádoru“. Informační portál o drogách. Americká národní lékařská knihovna.
- Faktor alfa nekrózy nádorů v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: P01375 (Faktor nekrózy nádorů) na PDBe-KB.