Hexafluorfosfát - Hexafluorophosphate
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Hexafluorfosfát | |||
| Systematický název IUPAC | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.111.656 | ||
| 2704 | |||
PubChem CID | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| [PF6]− | |||
| Molární hmotnost | 144,964181 g mol−1 | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
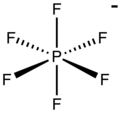
Hexafluorfosfát je anion s chemickým vzorcem PF−
6. Je to osmistěn druh. Svým solím nepřidává žádnou barvu. PF−
6 je izoelektronický s fluorid sírový, SF6a hexafluorokřemičitan dianion, SiF2−
6, a fluoroantimonate SbF−
6. Být špatně nukleofilní, hexafluorfosfát je klasifikován jako a nekoordinující anion.[2][3]
Syntéza

Hexafluorfosfátové soli lze připravit reakcí chlorid fosforečný a alkalický nebo halogenid amonný v roztoku kyselina fluorovodíková:[4]
- PCl5 + MCl + 6 HF → MPF6 + 6 HCl
Kyselina hexafluorfosforečná lze připravit přímou reakcí fluorovodík s pentafluorid fosforečný.[5] Je to silný Bronstedova kyselina který je obvykle generován in situ bezprostředně před použitím.
- PF5 + HF → HPF6
Tyto reakce vyžadují specializované vybavení pro bezpečné zvládnutí rizik spojených s kyselinou fluorovodíkovou a fluorovodíkem.
Kvantitativní analýza
Několik metod kvantitativní analýza pro hexafluorfosfátový iont byly vyvinuty. Tetraphenylarsonium chlorid, [(C6H5)4Jako] Cl, byl použit pro oba titrační[6] a gravimetrické[7] kvantifikace hexafluorfosfátu. Obě tato stanovení závisí na tvorbě tetrafenylarsonium hexafluorfosfátu:
- [(C6H5)4Tak jako]+ + PF−
6 → [(C.6H5)4Jako] PF6
Lze také určit hexafluorfosfát spektrofotometricky s ferroin.[8]
Reakce
Hydrolýza je za základních podmínek extrémně pomalejší.[9] Kyselinou katalyzované hydrolýza do fosfát iont je také pomalý.[10] Hexafluorfosfát je nicméně náchylný k rozkladu za uvolňování fluorovodíku iontové kapaliny.[11]

Organokovová a anorganická syntéza
Hexafluorfosfát je běžným protianionem pro kationtový kovové komplexy. Je to jeden ze tří široce používaných nekoordinujících aniontů: hexafluorfosfát, tetrafluorborát BF−
4, a chloristan ClO−
4. Z nich má hexafluorfosfátový ion nejméně koordinační tendenci.[12]
Soli hexafluorfosforečnanu lze připravit reakcí sloučeniny hexafluorfosforečnan stříbrný s halogenidovými solemi. Srážení nerozpustného halogenidu stříbrného napomáhá dokončení této reakce. Protože soli hexafluorfosforečnanu jsou často nerozpustné ve vodě, ale rozpustné v polárních organických rozpouštědlech, dokonce i přidání hexafluorfosforečnan amonný (NH4PF6) na vodné roztoky mnoha organických a anorganických solí poskytuje pevné sraženiny hexafluorfosfátových solí. Jedním příkladem je syntéza rhodoceniové soli:[13] Celková konverzní rovnice je
- RhCl3·XH2O + 2 ° C5H6 + NH4PF6 → [(η5-C5H5)2Rh] PF6 + 2 HCl + NH4Cl + X H2Ó
Tetrakis (acetonitril) hexafluorfosforečnan měďnatý se vyrábí přidáním kyseliny hexafluorfosforečné k suspenzi oxid měďnatý v acetonitrilu:[14]
- Cu2O + 2 HPF6 + 8 CH3CN → 2 [Cu (CH3CN)4] PF6 + H2Ó
Hydrolýza hexafluorfosfátových komplexů
I když je hexafluorfosfátový ion obecně inertní, a proto vhodný protiion, své solvolýza mohou být indukovány vysoce elektrofilními kovovými centry. Například tris (rozpouštědlo ) rhodium komplex [(η5-C5Mě5) Rh (já2CO)3] (PF6)2 po zahřátí prochází solvolýzou aceton, tvořící a difluorfosfát -mostěný komplex [(η5-C5Mě5) Rh (μ-OPF2Ó)3Rh (η5-C5Mě5)] PF6.[15][16]
Aplikace
Praktické použití hexafluorfosfátového iontu obvykle využívá jednu nebo více z následujících vlastností: že se jedná o a nekoordinující anion; že hexafluorfosfátové sloučeniny jsou obvykle rozpustné v organických rozpouštědlech, zejména polární ale mají nízkou rozpustnost v vodný roztok; nebo že má vysoký stupeň stability, včetně odolnosti vůči kyselým i zásaditým hydrolýza.
Sekundární baterie
Hlavní komerční použití hexafluorfosfátu je jako jeho lithná sůl, hexafluorfosforečnan lithný. Tato sůl v kombinaci s dimethylkarbonát, je běžný elektrolyt v reklamě sekundární baterie jako lithium-iontové články. Tato aplikace využívá vysokou rozpustnost hexafluorfosfátových solí v organických rozpouštědlech a odolnost těchto solí vůči redukci katodou alkalického kovu.[17] Protože lithiové ionty v těchto bateriích jsou obecně přítomny jako koordinační komplexy v elektrolytu,[18] nekoordinační povaha hexafluorfosfátového iontu je také užitečnou vlastností pro tyto aplikace.
Iontové kapaliny
Iontové kapaliny o pokojové teplotě, jako např 1-butyl-3-methylimidazolium hexafluorfosfát (obvykle zkráceno jako bmimPF6) byly připraveny.[19] Výhodou aniontové výměny ve prospěch nekoordinujícího aniontu je, že výsledná iontová kapalina má mnohem větší tepelnou stabilitu. 1-Butyl-3-methylimidazoliumchlorid se rozkládá na N-methylimidazol a 1-chlorbutan nebo do N-butylimidazol a chlormethan. Takové rozklady nejsou pro bmimPF možné6. Tepelné rozklady hexafluorfosfátových iontových kapalin se však generují fluorovodík plyn je známý.[11]
Reference
- ^ A b „Hexafluorfosfát (1-) (CHEBI: 30201)“. Chemické entity biologického zájmu (ChEBI). UK: Evropský bioinformatický institut.
- ^ Davies, J. A. (1996). Syntetická koordinační chemie: principy a praxe. World Scientific. p. 165. ISBN 981-02-2084-7.
- ^ Constant, S .; Lacour, J. (2005). J.-P. Major (ed.). Nové trendy v chemii fosforu koordinované hexy. Nové aspekty v chemii fosforu. 5. Springer. p. 3. ISBN 3-540-22498-X.
- ^ Woyski, M. M. (1950). „Hexafluorfosfáty sodíku, amoniaku a draslíku“. Inorg. Synth. 3: 111–117. doi:10.1002 / 9780470132340.ch29.
- ^ Molnar, A .; Surya Prakash, G. K .; Sommer, J. (2009). Superkyselinová chemie (2. vyd.). Wiley-Interscience. p. 44. ISBN 0-471-59668-X.
- ^ Affsprung, H. E .; Archer, V. S. (1963). "Stanovení hexafluorfosfátu amperometrickou titrací tetrafenylarsoniumchloridem". Anální. Chem. 35 (8): 976–978. doi:10.1021 / ac60201a017.
- ^ Affsprung, H. E .; Archer, V. S. (1963). "Gravimetrické stanovení hexafluorfosfátu jako tetrafenylarsonium hexafluorfosfátu". Anální. Chem. 35 (12): 1912–1913. doi:10.1021 / ac60205a036.
- ^ Archer, V. S .; Doolittle, F. G. (1967). "Spektrofotometrické stanovení hexafluorfosfátu s ferroinem". Anální. Chem. 39 (3): 371–373. doi:10.1021 / ac60247a035.
- ^ Ryss, I. G .; Tulchinskii, V. B. (1964). „Kinetika Gidroliza Iona Geksaftorofosfata PF−
6". Zh. Neorg. Khim. 9 (4): 836–840. - ^ Gebala, A.E .; Jones, M. M. (1969). "Kyselinou katalyzovaná hydrolýza hexafluorfosfátu". J. Inorg. Nucl. Chem. 31 (3): 771–776. doi:10.1016/0022-1902(69)80024-2.
- ^ A b Dyson, P. J. (2005). Geldbach, T. J. (ed.). Reakce katalyzované kovem v iontových kapalinách. Katalýza kovovými komplexy. 29. Springer Science & Business. p. 27. ISBN 1-4020-3914-X.
- ^ Mayfield, H. G .; Bull, W. E. (1971). „Koordinační tendence hexafluorfosfátového iontu“. J. Chem. Soc. A (14): 2279–2281. doi:10.1039 / J19710002279.
- ^ Baghurst, D. R .; Mingos, D. M. P.; Watson, M. J .; Watson, Michael J. (1989). „Aplikace účinků ohřevu mikrovlnné dielektrické ztráty pro rychlou a pohodlnou syntézu organokovových sloučenin“. J. Organomet. Chem. 368 (3): C43 – C45. doi:10.1016 / 0022-328X (89) 85418-X.
- ^ Kubas, G. J. (1979). „Tetrakis (acetonitiril) měď (I) hexaflurorfosfát“. Inorg. Synth. 19: 90–91. doi:10.1002 / 9780470132593.ch15.
- ^ Thompson, S. J .; Bailey, P. M .; White, C .; Peter Maitlis (1976). „Solvolýza hexafluorfosfátového iontu a struktura [tris (μ-difluorfosfato) bis (penta-methylcyklopentadienylrhodium)] hexafluorfosfátu“. Angew. Chem. Int. Vyd. 15 (8): 490–491. doi:10,1002 / anie.197604901.
- ^ White, C .; Thompson, S. J .; Peter Maitlis (1977). „Komplexy pentamethylcyklopentadienyl-rhodia a -iridia XIV. Solvolýza koordinovaných druhů rozpouštědel acetonu na Tris (μ-difluorfosfát) bis [η5-pentamethylcyklopentadienylrhodium (III)] hexafluorfosforečnan, k η5- (2,4-dimethyl-1-oxapenta-1,3-dienyl) (pentamethylcyklopentadienyl) iridiový kation nebo do η5- (2-hydroxy-4-methylpentadienyl) (η5-pentamethylcyklopentadienyl) iridium Cation ". Journal of Organometallic Chemistry. 134 (3): 319–325. doi:10.1016 / S0022-328X (00) 93278-9.
- ^ Goodenough, J. B .; Kim, Y. (2010). "Výzvy pro dobíjecí Li baterie". Chem. Mater. 22 (3): 587–603. doi:10,1021 / cm901452z.
- ^ „Bezpečnostní list: Lithium-iontové baterie National Power Corp“ (PDF). tek.com. Tektronix Inc. 7. května 2004. Archivovány od originál (PDF) dne 26. června 2011. Citováno 11. června 2010.
- ^ Gordon, C. M .; John D. Holbrey; Alan R. Kennedy; Kenneth R. Seddon (1998). "Iontové kapalné krystaly: hexafluorfosfátové soli". Journal of Materials Chemistry. 8 (12): 2627–2636. doi:10.1039 / a806169f.