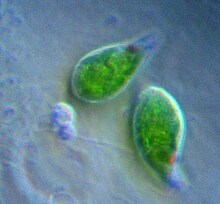
Chloroplast - Chloroplast


Chloroplasty /ˈkl.rəˌpl…sts,-plɑːsts/[1][2] jsou organely toto chování fotosyntéza, kde je fotosyntetický pigment chlorofyl zachycuje energie z sluneční světlo, převádí jej a ukládá do molekul akumulujících energii ATP a NADPH při osvobozování kyslík z vody dovnitř rostlina a řasa buňky. Potom používají ATP a NADPH k výrobě organických molekul oxid uhličitý v procesu známém jako Calvinův cyklus. Chloroplasty plní řadu dalších funkcí, včetně syntéza mastných kyselin, hodně aminokyselina syntéza a imunitní odpověď v rostlinách. Počet chloroplastů na buňku se pohybuje od jedné v jednobuněčných řasách až po 100 v rostlinách jako Arabidopsis a pšenice.
Chloroplast je typ organely známé jako plastid, charakterizovaný jeho dvě membrány a vysoká koncentrace chlorofyl. Jiné typy plastidů, například leukoplast a chromoplast obsahují málo chlorofylu a neprovádějí fotosyntézu.
Chloroplasty jsou vysoce dynamické - cirkulují a občas se pohybují v rostlinných buňkách štípnout na dvě části reprodukovat. Jejich chování je silně ovlivňováno faktory prostředí, jako je barva světla a intenzita. Chloroplasty, jako mitochondrie obsahují vlastní DNA, o kterém se předpokládá, že je zděděn od jejich předka - fotosyntetický sinice to bylo pohlcen brzy eukaryotický buňka.[3] Chloroplasty nemohou být vyrobeny rostlinnou buňkou a během dělení buněk je musí zdědit každou dceřinou buňkou.
Až na jednu výjimku ( améboid Paulinella chromatophora), všechny chloroplasty lze pravděpodobně vysledovat zpět k jedinému endosymbiotická událost, když byla sinice pohlcena eukaryotem. Navzdory tomu lze chloroplasty nalézt v extrémně širokém souboru organismů, některé dokonce přímo nesouvisejí - důsledek mnoha sekundární a dokonce terciární endosymbiotické události.
Slovo chloroplast je odvozen z řeckých slov chloros (χλωρός), což znamená zelenou, a plasty (πλάστης), což znamená „ten, kdo tvoří“.[4]
Objev
První definitivní popis chloroplastu (Chlorophyllkörnen„zrno chlorofylu“) bylo dáno Hugo von Mohl v roce 1837 jako diskrétní těla v zelené rostlinné buňce.[5] V roce 1883 Andreas Franz Wilhelm Schimper pojmenoval by tato těla jako „chloroplastidy“ (Chloroplastiden).[6] V roce 1884 Eduard Strasburger přijal termín „chloroplasty“ (Chloroplasten).[7][8][9]
Počty řádků a vývoj
Chloroplasty jsou jedním z mnoha typů organel v rostlinné buňce. Má se za to, že se vyvinuli z endosymbiotikum sinice. Mitochondrie se předpokládá, že pocházejí z podobné události endosymbiózy, kde aerobní prokaryot byl pohlcen.[10] Tento původ chloroplastů poprvé navrhl ruský biolog Konstantin Mereschkowski v roce 1905[11] po Andreas Franz Wilhelm Schimper pozorováno v roce 1883, že chloroplasty se velmi podobají sinice.[6] Chloroplasty se nacházejí pouze v rostliny, řasy,[12] a améboid Paulinella chromatophora.
Rodičovská skupina: Sinice
Chloroplasty jsou považovány za endosymbiotické sinice.[13] Sinice se někdy nazývají modrozelené řasy i když jsou prokaryoty. Jsou různorodé kmen z bakterie schopné provádět fotosyntéza, a jsou gramnegativní, což znamená, že mají dvě buněčné membrány. Sinice také obsahují a peptidoglykanová buněčná stěna, který je silnější než v jiných gramnegativních bakteriích a který se nachází mezi jejich dvěma buněčnými membránami.[14] Stejně jako chloroplasty mají tylakoidy v rámci.[15] Na tylakoidních membránách jsou fotosyntetické pigmenty, počítaje v to chlorofyl A.[16] Phycobilins jsou také běžné pigmenty sinic, obvykle uspořádané do polokulovitých phycobilisomes připojené k vnějšku tylakoidních membrán (fykobiliny však nejsou sdíleny se všemi chloroplasty).[16][17]
Primární endosymbióza
![Primární endosymbióza Eukaryot s mitochondriemi pohltil sinice v případě sériové primární endosymbiózy a vytvořil linii buněk s oběma organelami. [10] Je důležité si uvědomit, že cyanobakteriální endosymbiont již měl dvojitou membránu - membrána odvozená od fagosomální vakuoly byla ztracena. [18]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b8/Chloroplast_endosymbiosis_simple.svg/440px-Chloroplast_endosymbiosis_simple.svg.png)
Eukaryota s mitochondrie pohltil a sinice v případě seriál primární endosymbióza, vytvoření a linie buněk s oběma organelami.[10] Je důležité si uvědomit, že sinice endosymbiont už měl dvojitou membránu - fagozomální vakuola -odvozená membrána byla ztracena.[18]
Asi před 1 až 2 miliardami let[19][20][21]svobodný život sinice vstoupil předčasně eukaryotický buňka, buď jako potravina, nebo jako vnitřní parazit,[10] ale podařilo se mu uniknout fagocytická vakuola bylo obsaženo v.[16] Dva nejvnitřnější lipidové dvojvrstevné membrány[22] které obklopují všechny chloroplasty, odpovídají vnějšímu a vnitřnímu membrány sinic předků gram negativní buněčná stěna,[18][23][24] a ne fagozomální membrána z hostitele, která byla pravděpodobně ztracena.[18]Nový buněčný obyvatel se rychle stal výhodou, protože poskytoval jídlo eukaryotickému hostiteli, což mu umožnilo žít v něm.[10] Postupem času byla sinice asimilována a mnoho z jejích genů bylo ztraceno nebo přeneseno na jádro hostitele.[25] Z genomů, které pravděpodobně původně obsahovaly více než 3000 genů, zůstalo v chloroplastech současných rostlin jen asi 130 genů.[20] Některé z jeho proteinů byly poté syntetizovány v cytoplazmě hostitelské buňky a importovány zpět do chloroplastů (dříve sinic).[25][26] Samostatně, někde před 90–140 miliony let, se to stalo znovu a vedlo k améboid Paulinella chromatophora.[21]
Tato událost se nazývá endosymbióza, nebo „buňka žijící uvnitř jiné buňky se vzájemným přínosem pro oba“. Vnější buňka se běžně označuje jako hostitel zatímco vnitřní buňka se nazývá endosymbiont.[10]
Předpokládá se, že chloroplasty vznikly později mitochondrie, protože všichni eukaryoty obsahují mitochondrie, ale ne všechny mají chloroplasty.[10][27] Tomu se říká sériová endosymbióza —Časná eukaryota pohlcující mitochondrie předchůdce a někteří jeho potomci poté pohltili předka chloroplastů a vytvořili buňku s chloroplasty i mitochondriemi.[10]
Zda primární chloroplasty pocházely či nikoli z jedné endosymbiotické události nebo z mnoha nezávislých pohlcení napříč různými eukaryotickými liniemi, byla dlouho diskutována. Nyní se obecně předpokládá, že organismy s primárními chloroplasty sdílejí jediný předek který vzal v sinice Před 600–2 000 miliony let.[19][21] Bylo navrženo, že toto je nejbližší žijící příbuzný této bakterie Gloeomargarita lithophora.[28][29][30] Výjimkou je améboid Paulinella chromatophora, který pochází z předka, který přijal a Prochlorococcus sinice Před 90–500 miliony let.[31][30][21]
Tyto chloroplasty, které lze vysledovat zpět přímo k předku sinic, jsou známé jako hlavní plastidy[32] ("plastid " v této souvislosti znamená téměř totéž jako chloroplast[10]). Všechny primární chloroplasty patří do jedné ze čtyř linií chloroplastů - do glaukofyt linie chloroplastů améboid Paulinella chromatophora linie, rodofyt (červená řasa) linie chloroplastů nebo chloroplastidan (zelená) linie chloroplastů.[33] The rodofyt a chloroplastidan počty řádků jsou největší,[18] s chloroplastidan (zelená) je ta, která obsahuje suchozemské rostliny.[18]
Glaucophyta
Za událost endosymbiózy se obvykle považuje, že k ní došlo v Archaeplastida, v rámci kterého glaucophyta jako možná nejdříve odlišná linie.[26][13] Skupina chloroplastů glaukophytu je nejmenší ze tří primárních linií chloroplastů a vyskytuje se pouze u 13 druhů,[18] a je považován za ten, který se rozvětvil nejdříve.[18][19][34] Glaukofyty mají chloroplasty, které si zachovávají a stěna peptidoglykanu mezi jejich dvojitými membránami,[32] jako jejich sinice rodič.[14] Z tohoto důvodu jsou chloroplasty glaukophytu také známé jako „muroplasty“[32] (kromě „kyanoplastů“ nebo „kyanel“). Glaukofytové chloroplasty také obsahují koncentrický neskládaný tylakoidy, které obklopují a carboxysome - an icosahedral struktura, kterou si chloroplasty a sinice uchovávají uhlíková fixace enzym RuBisCO in. Škrob, který syntetizují, se shromažďuje mimo chloroplasty.[16] Stejně jako sinice jsou i tylakoidy chloroplastů glaukophytu a rodofytu poseté strukturami sběru světla zvanými phycobilisomes.[16][32] Z těchto důvodů jsou chloroplasty glaukophytu považovány za primitivní meziprodukt mezi sinicemi a více vyvinutými chloroplasty v červené řasy a rostliny.[32]
Rhodophyceae (červené řasy)
The rodofyt nebo červené řasy chloroplastová skupina je další velká a různorodá linie chloroplastů.[18] Také se nazývají chloroplasty rudofytů rhodoplasty,[32] doslova „červené chloroplasty“.[36]
Rhodoplasty mají dvojitou membránu s mezimembránovým prostorem a fykobilin pigmenty uspořádané do phycobilisomes na tylakoidních membránách a brání jejich stohování.[16] Některé obsahují pyrenoidy.[32] Rhodoplasty mají chlorofyl A a fykobiliny[34] pro fotosyntetické pigmenty; fykobilin fykoerytrin je zodpovědný za to, že dává mnoha červeným řasám jejich osobitost Červené barva.[35] Protože však také obsahují modrozelenou chlorofyl A a další pigmenty, mnohé z této kombinace jsou načervenalé až fialové.[32] Červený fykoerytherinový pigment je adaptací, která pomáhá červeným řasám zachytit více slunečního světla v hluboké vodě[32]—Jako takové, některé červené řasy, které žijí v mělké vodě, mají ve svých rhodoplastech méně fykoerytrinu a mohou vypadat zeleněji.[35] Rhodoplasty syntetizují formu zvaného škrobu floridský škrob,[32] který se shromažďuje do granulí mimo rodoplast, v cytoplazmě červené řasy.[16]
Chloroplastida (zelené řasy a rostliny)
The chloroplastida chloroplasty nebo zelená chloroplasty, jsou další velkou, velmi různorodou primární řadou chloroplastů. Jejich hostitelské organismy jsou obecně známé jako zelené řasy a suchozemské rostliny.[37] Liší se od chloroplastů glaukophytu a červených řas tím, že ztratili phycobilisomes a obsahují chlorofyl b namísto.[16] Většina zelených chloroplastů je (samozřejmě) zelená, i když některé nejsou, jako některé formy Hæmatococcus pluvialis, kvůli doplňkovým pigmentům, které potlačují zelené barvy chlorofylů. Chloroplastida chloroplasty ztratily stěna peptidoglykanu mezi jejich dvojitou membránou a ponechávají mezimembránový prostor.[16] Nějaký rostliny Zdá se, že udržel geny pro syntézu peptidoglykanová vrstva, i když byly znovu použity pro použití v chloroplastové dělení namísto.[38]
Většina chloroplastů zobrazených v tomto článku jsou zelené chloroplasty.
Zelené řasy a rostliny si zachovávají své škrob uvnitř jejich chloroplasty,[16][34][37] a v rostlinách a některých řasách jsou chloroplastové tylakoidy uspořádány do hromádek grana. Některé chloroplasty zelených řas obsahují strukturu zvanou a pyrenoid,[16] který je funkčně podobný glaukophytu carboxysome v tom je to kde RuBisCO a CO2 jsou koncentrovány v chloroplastech.[39]

Helicosporidium je rod nefotosyntetických parazitických zelených řas, o nichž se předpokládá, že obsahují zbytkový chloroplast.[34] Geny z chloroplastů[40] a jaderné geny indikující přítomnost chloroplastu byly nalezeny v Helicosporidium[34] i když samotný chloroplast nikdo neviděl.[34]
Paulinella chromatophora
Zatímco většina chloroplastů pochází z první sady endosymbiotických událostí, Paulinella chromatophora je výjimka, která nedávno získala fotosyntetický cyanobakteriální endosymbiont. Není jasné, zda tento symbiont úzce souvisí s rodovým chloroplastem jiných eukaryot.[18] Být v raných fázích endosymbiózy, Paulinella chromatophora může nabídnout pohled na to, jak se chloroplasty vyvinuly.[25][41] Paulinella buňky obsahují jednu nebo dvě klobásovité modrozelené fotosyntetizující struktury zvané chromatofory,[25][41] pocházející z sinic Synechococcus. Chromatofory nemohou přežít mimo svého hostitele.[25] Chromatoforová DNA je asi milion základní páry dlouhý, obsahující přibližně 850 kódujících proteinů geny - méně než tři miliony párů bází Synechococcus genom,[25] ale mnohem větší než přibližně 150 000 genomů párů bází asimilovaného chloroplastu.[42][43][44] Chromatofory přenesly mnohem méně své DNA do jádra svého hostitele. Asi 0,3–0,8% jaderné DNA v Paulinella je z chromatoforu, ve srovnání s 11–14% z chloroplastů v rostlinách.[41]
Sekundární a terciární endosymbióza
Mnoho dalších organismů získalo chloroplasty z primárních linií chloroplastů prostřednictvím sekundární endosymbiózy - pohlcující červenou nebo zelenou řasu, která obsahovala chloroplasty. Tyto chloroplasty jsou známé jako sekundární plastidy.[32]
Zatímco primární chloroplasty mají dvojitou membránu od svých sinice předchůdce, sekundární chloroplasty mají další membrány mimo původní dva, v důsledku sekundární endosymbiotické události, když je nefotosyntetická eukaryot pohltil řasu obsahující chloroplasty, ale nedokázal ji strávit - podobně jako sinice na začátku tohoto příběhu.[18] Zachycená řasa byla rozložena a zůstal pouze její chloroplast a někdy i jeho buněčná membrána a jádro, tvořící chloroplast se třemi nebo čtyřmi membránami[45]- dvě membrány sinic, někdy buněčná membrána snědené řasy, a fagozomální vakuola z buněčné membrány hostitele.[18]


Geny v jádru fagocytované eukaryoty se často přenášejí do jádra sekundárního hostitele.[18]Kryptomonády a chlorarachniofyty zachovat fagocytované jádro eukaryotu, objekt zvaný a nukleomorf,[18] umístěné mezi druhou a třetí membránou chloroplastu.[16][26]
Všechny sekundární chloroplasty pocházejí zelená a červené řasy —Žádné sekundární chloroplasty z glaukofyty byly pozorovány pravděpodobně proto, že glaukofyty jsou v přírodě relativně vzácné, takže je méně pravděpodobné, že by byly přijaty jinou eukaryotou.[18]
Chloroplasty odvozené od zelených řas
Zelené řasy byly přijaty euglenidi, chlorarachniofyty, linie z dinoflageláty,[34] a možná předchůdce linie CASH (kryptomonády, alveoláty, stramenopiles a haptophyty )[46] ve třech nebo čtyřech samostatných pohlceních.[47] Mnoho chloroplastů odvozených od zelených řas obsahuje pyrenoidy, ale na rozdíl od chloroplastů v jejich předcích zelených řas se akumulační produkt shromažďuje v granulích mimo chloroplasty.[16]
Euglenofyty
Euglenofyty jsou skupina společných bičované protistů které obsahují chloroplasty odvozené od zelené řasy.[18] Euglenofyt chloroplasty mají tři membrány - předpokládá se, že membrána primárního endosymbiontu byla ztracena a zanechala membrány sinic a fagozomální membránu sekundárního hostitele.[18] Chloroplasty Euglenophyte mají a pyrenoid a tylakoidy naskládané ve skupinách po třech. Fotosyntetický produkt je uložen ve formě paramylon, který je obsažen v granulích vázaných na membránu v cytoplazmě euglenofytu.[16][34]

Chlorarachniophytes
Chlorarachniophytes /ˌkl.rəˈr…knioʊˌFaɪts/ jsou vzácnou skupinou organismů, které také obsahují chloroplasty získané ze zelených řas,[18] ačkoli jejich příběh je složitější než příběh euglenofytů. Předchůdce chlorarachniofytů je považován za eukaryota s a Červené chloroplast odvozený z řas. Poté se předpokládá, že ztratil svůj první chloroplast z červené řasy a později pohltil zelenou řasu, čímž získal svůj druhý chloroplast odvozený od zelené řasy.[34]
Chlorparachniofytové chloroplasty jsou ohraničeny čtyřmi membránami, s výjimkou blízkosti buněčné membrány, kde chloroplastové membrány fúzují do dvojité membrány.[16] Jejich tylakoidy jsou uspořádány do volných hromádek po třech.[16] Chlorarachniofyty mají formu polysacharidu zvaného chrysolaminarin, které uchovávají v cytoplazmě,[34] často se shromažďují kolem chloroplastů pyrenoid, který vyboulí do cytoplazmy.[16]
Chlorparachniofyt chloroplasty jsou pozoruhodné, protože zelená řasa, z níž jsou odvozeny, nebyla zcela rozložena - její jádro stále přetrvává jako nukleomorf[18] nalezen mezi druhou a třetí chloroplastovou membránou[16]—The periplastidový prostor, což odpovídá cytoplazmě zelené řasy.[34]
Chloroplast dinofytů odvozených od prasinofytů
Lepidodinium viride a jeho blízcí příbuzní jsou dinofyty (viz níže), které ztratily svůj původní peridinin chloroplast a nahradily jej chloroplastem získaným ze zelených řas (konkrétněji prasinofyt ).[16][48] Lepidodinium je jediný dinofyt, který má chloroplast, který není z rhodoplast linie. Chloroplast je obklopen dvěma membránami a nemá nukleomorf - všechny nukleomorfní geny byly přeneseny do dinofytu jádro.[48] Endosymbiotická událost, která vedla k tomuto chloroplastu, byla sériová sekundární endosymbióza spíše než terciární endosymbióza - endosymbiont byl zelená řasa obsahující primární chloroplast (tvořící sekundární chloroplast).[34]
Chloroplasty odvozené od červených řas
Kryptofyty
Kryptofyty nebo kryptomonády jsou skupina řas, které obsahují chloroplast odvozený od červené řasy. Kryptofytové chloroplasty obsahují nukleomorf, který povrchně připomíná nukleomorf chlorarachniofyty.[18] Kryptofytové chloroplasty mají čtyři membrány, z nichž nejvzdálenější je spojitá s hrubé endoplazmatické retikulum. Syntetizují obyčejné škrob, který je uložen v granulích nalezených v periplastidový prostor —Vně původní dvojité membrány, na místě, které odpovídá cytoplazmě červené řasy. Uvnitř kryptofytových chloroplastů je a pyrenoid a tylakoidy po dvou.[16]
Jejich chloroplasty nemají phycobilisomes,[16] ale mají fykobilinové pigmenty které uchovávají ve svém thylakoidním prostoru, místo aby byly ukotveny na vnější straně jejich tylakoidních membrán.[16][18]
Kryptophyty mohly hrát klíčovou roli při šíření chloroplastů na bázi červených řas.[49][50]
Haptophyty
Haptophyty jsou podobné a úzce souvisí s kryptofyty nebo heterokontofyty.[34] Jejich chloroplastům chybí nukleomorf,[16][18] jejich tylakoidy jsou v hromádkách po třech a syntetizují se chrysolaminarin cukr, který ukládají úplně mimo chloroplast, v cytoplazmě haptophytu.[16]
Heterokontofyty (stramenopiles)

The heterokontophyty, také známí jako stramenopiles, jsou velmi velkou a různorodou skupinou eukaryot. Fotoautotrofní linie, Ochrophyta, včetně rozsivky a hnědé řasy, zlaté řasy,[35] a žlutozelené řasy, také obsahuje chloroplasty odvozené od červených řas.[34]
Heterokontové chloroplasty jsou velmi podobné haptophytovým chloroplastům, které obsahují a pyrenoid, triplet tylakoidů a až na některé výjimky[16] mající čtyřvrstvý plastidový obal, nejvzdálenější epiplastidová membrána připojená k endoplazmatické retikulum. Stejně jako haptophyty, i heterokontophyty ukládají cukr dovnitř chrysolaminarin granule v cytoplazmě.[16] Heterokontophyte chloroplasty obsahují chlorofyl A a až na několik výjimek[16] chlorofyl C,[18] ale také mít karotenoidy které jim dodávají mnoho barev.[35]
Apicomplexans, chromeridy a dinofyty
Alveoláty jsou hlavní třídou jednobuněčných eukaryot autotrofních i heterotrofních členů. Nejpozoruhodnější společnou charakteristikou je přítomnost kortikálních (vnějších) alveol (vaků). Jedná se o zploštělé vezikuly (vaky) zabalené do souvislé vrstvy těsně pod membránou a podporující ji, obvykle tvořící pružnou pelikulu (tenkou slupku). V dinoflagellates často tvoří pancéřové desky. Mnoho členů obsahuje plastid odvozený od červených řas. Jednou z pozoruhodných charakteristik této rozmanité skupiny je častá ztráta fotosyntézy. Většina těchto heterotrofů však nadále zpracovává nefotosyntetický plastid.[51]
- Apicomplexans
Apicomplexans jsou skupina alveolátů. Jako helikosproidie, jsou parazitní a mají nefotosyntetický chloroplast.[34] Kdysi se o nich myslelo, že souvisejí s helicosproidiemi, ale nyní je známo, že helicosproida jsou spíše zelené řasy než součást linie CASH.[34] Mezi apicomplexany patří Plasmodium, malárie parazit. Mnoho apicomplexanů udržuje a zakrnělé chloroplast odvozený od červené řasy[52][34] volal apicoplast, které zdědili po svých předcích. Ostatní apicomplexans jako Cryptosporidium úplně ztratili chloroplast.[52] Apicomplexans ukládají svou energii dovnitř amylopektin granule, které se nacházejí v jejich cytoplazmě, i když nejsou fotosyntetické.[16]
Apikoplasty ztratily veškerou fotosyntetickou funkci a neobsahují žádné fotosyntetické pigmenty ani skutečné tylakoidy. Jsou ohraničeny čtyřmi membránami, ale membrány nejsou spojeny s endoplazmatické retikulum.[16] Skutečnost, že apikomplexany stále udržují své nefotosyntetické chloroplasty, ukazuje, jak chloroplast plní jiné důležité funkce než fotosyntéza. Rostlina chloroplasty poskytují rostlinným buňkám kromě cukru mnoho důležitých věcí a apikoplasty se nijak neliší - syntetizují se mastné kyseliny, isopentenylpyrofosfát, klastry železo-síra, a provádět část heme cesta.[52] Díky tomu je apikoplast atraktivním cílem pro léky k léčbě nemocí souvisejících s apikomplexanem.[32] Nejdůležitější funkcí apikoplastu je isopentenylpyrofosfát syntéza - ve skutečnosti apikomplexany umírají, když něco zasahuje do této funkce apikoplastů, a když jsou apikomplexany pěstovány v médiu bohatém na isopentenylpyrofosfát, skládkují organelu.[52]
- Chromeridy
The Chromerida je nově objevená skupina řas z australských korálů, která zahrnuje některé blízké fotosyntetické příbuzné apicomplexans. První člen, Chromera velia, byl objeven a poprvé izolován v roce 2001. Objev Chromera velia s podobnou strukturou jako apicomplexanss poskytuje důležitý článek v evoluční historii apicomplexanů a dinofytů. Jejich plastidy mají čtyři membrány, chybí jim chlorofyl c a používají formu typu II RuBisCO získané z horizontální přenosové události.[53]
- Dinofyty
The dinoflageláty jsou další velmi velkou a různorodou skupinou protistů, přibližně polovina z nich je (alespoň částečně ) fotosyntetický.[35][48]
Většina chloroplastů dinofytů je sekundární červená řasa odvozené chloroplasty. Mnoho dalších dinofytů ztratilo chloroplast (stává se nefotosyntetickým druhem dinoflagelátu), nebo ho nahradilo terciární endosymbióza[54]- pohlcení další eukaryotické řasy obsahující chloroplast odvozený od červené řasy. Jiní nahradili své původní chloroplasty a zelená řasa odvozený.[18][34][48]
Většina chloroplastů dinofytů obsahuje formu II RuBisCO, přinejmenším fotosyntetické pigmenty chlorofyl A, chlorofyl C2, beta-karoten a alespoň jeden jedinečný dinofyt xantofyl (peridinin, dinoxanthin nebo diadinoxanthin ), což mnohým dává zlatohnědou barvu.[51][48] Všechny dinofyty uchovávají škrob ve své cytoplazmě a většina z nich má chloroplasty s tylakoidy uspořádanými do tří.[16]

Nejběžnějším dinofytem chloroplastem je peridinin -typ chloroplastu, charakterizovaný karotenoid pigment peridinin v jejich chloroplastech spolu s chlorofyl A a chlorofyl C2.[18][48] Peridinin se nenachází v žádné jiné skupině chloroplastů.[48] Peridinin chloroplast je vázán třemi membránami (příležitostně dvěma),[16] ztratil původní buněčnou membránu červeného řas endosymbionta.[18][34] Vnější membrána není spojena s endoplazmatickým retikulem.[16][48] Obsahují a pyrenoid a mají tripletově naskládané tylakoidy. Škrob se nachází mimo chloroplasty.[16] Důležitým rysem těchto chloroplastů je, že jejich chloroplastová DNA je velmi snížena a roztříštěné do mnoha malých kruhů. Většina genomu migrovala do jádra a v chloroplastu zůstávají pouze kritické geny související s fotosyntézou.[48]
Peridinin chloroplast je považován za „původní“ chloroplast dinofytů,[48] který byl ztracen, omezen, nahrazen nebo má společnost v několika dalších liniích dinofytů.[34]
Chloroplasty dinofytů obsahujících fukoxanthin (odvozené od haptophytu)

The fucoxanthin řády dinofytů (včetně Karlodinium a Karenia )[34] ztratili svůj původní chloroplast odvozený z červené řasy a nahradili jej novým chloroplastem odvozeným od a haptofyt endosymbiont. Karlodinium a Karenia pravděpodobně absorboval různé heterokontofyty.[34] Vzhledem k tomu, že haptophytový chloroplast má čtyři membrány, lze očekávat, že terciární endosymbióza vytvoří šest membránový chloroplast a přidá haptophytový buněčná membrána a dinofyty fagozomální vakuola.[56] Haptopyt však byl silně redukován, zbaven několika membrán a jeho jádra, takže zůstal pouze jeho chloroplast (s původní dvojitou membránou) a možná jedna nebo dvě další membrány kolem něj.[34][56]
Chloroplasty obsahující fukoxanthin se vyznačují tím, že mají pigment fucoxanthin (vlastně 19'-hexanoyloxy-fukoxanthin a / nebo 19'-butanoyloxy-fukoxanthin ) a žádný peridinin. Fucoxanthin se také nachází v haptophytových chloroplastech, což poskytuje důkazy o původu.[48]

Diatomem odvozené chloroplasty dinofytů
Některé dinofyty, jako Kryptoperidinium a Durinskia[34] mít rozsivka (heterokontophyte ) odvozený chloroplast.[18] Tyto chloroplasty jsou ohraničeny až Pět membrány,[18] (v závislosti na tom, zda se celý diatom endosymbiont počítá jako chloroplast, nebo jen chloroplast odvozený od červené řasy). Endosymbiont rozsivky byl redukován relativně málo - stále si zachovává svůj původní mitochondrie,[34] a má endoplazmatické retikulum, ribozomy, a jádro a samozřejmě chloroplasty odvozené od červených řas - prakticky kompletní buňka,[57] vše uvnitř hostitele lumen endoplazmatického retikula.[34] Avšak rozsivkový endosymbiont nemůže skladovat své vlastní jídlo - jeho ukládací polysacharid se místo toho nachází v granulích v cytoplazmě hostitele dinofytů.[16][57] Jádro rozsivkového endosymbiontu je přítomno, ale pravděpodobně jej nelze nazvat a nukleomorf protože nevykazuje žádné známky redukce genomu a možná dokonce byli rozšířený.[34] Diatomy byly pohlceny dinoflageláty nejméně třikrát.[34]
Rozsivkový endosymbiont je ohraničen jedinou membránou,[48] uvnitř jsou chloroplasty se čtyřmi membránami. Stejně jako předek rozsivky endosymbionta, mají chloroplasty tripletové tylakoidy a pyrenoidy.[57]
V některých z nich rody, chloroplasty rozsivkového endosymbiontu nejsou jedinými chloroplasty v dinofytech. Původní chloroplast peridinin se třemi membránami je stále kolem, přeměněn na eyespot.[18][34]
Kleptoplastidy
V některých skupinách mixotrofní protistů, jako někteří dinoflageláty (např. Dinofýza ), chloroplasty jsou odděleny od zachycené řasy a dočasně použity. Tyto klepto chloroplasty může mít životnost pouze několik dní a poté jsou vyměněny.[58][59]
Chloroplast dinofytů odvozených od kryptofytů
Členové rodu Dinofýza mít fykobilin -obsahující[56] chloroplast odebraný z a kryptofyt.[18] Kryptofyt však není endosymbiont - zdá se, že byl odebrán pouze chloroplast a chloroplast byl zbaven nukleomorf a nejvzdálenější dvě membrány, takže zbyl jen chloroplast se dvěma membránami. Kryptophytové chloroplasty vyžadují, aby se jejich nukleomorf udržoval, a Dinofýza druhy pěstované v buněčná kultura sám nemůže přežít, takže je možné (ale nepotvrzené), že Dinofýza chloroplast je a kleptoplast - pokud ano, Dinofýza chloroplasty se opotřebovávají a Dinofýza druhy musí neustále pohlcovat kryptofyty, aby získaly nové chloroplasty, které nahradí ty staré.[48]
Chloroplastová DNA
Chloroplasty mají své vlastní DNA,[60] často zkráceně ctDNA,[61] nebo cpDNA.[62] To je také známé jako plastom. Jeho existence byla poprvé prokázána v roce 1962,[42] a poprvé sekvenováno v roce 1986 - když dva japonské výzkumné týmy sekvenovaly DNA chloroplastů z jaterník a tabák.[63] Od té doby byly stovky chloroplastových DNA z různých druhů seřazeno, ale jsou to většinou ti z suchozemské rostliny a zelené řasy —glaukofyty, červené řasy a další skupiny řas jsou extrémně nedostatečně zastoupeny, což může některé zavést zaujatost z pohledu „typické“ struktury a obsahu DNA chloroplastů.[64]
Molekulární struktura

Až na několik výjimek má většina chloroplastů celý svůj genom chloroplastů sloučený do jedné velké kruhové molekuly DNA,[64] obvykle 120 000–170 000 základní páry dlouho.[42][43][44][20] Mohou mít délku obrysu přibližně 30–60 mikrometrů a hmotnost přibližně 80–130 milionů daltony.[65]
I když je obvykle myšlenka jako kruhová molekula, existují určité důkazy, že molekuly chloroplastové DNA častěji přijímají a lineární tvar.[64][66]
Obrácené opakování
Mnoho chloroplastových DNA obsahuje dvě obrácené opakování, které oddělují dlouhou sekci s jednou kopií (LSC) od sekce s krátkou jednou kopií (SSC).[44]Zatímco daná dvojice obrácených repetic je zřídka úplně identická, vždy jsou si navzájem velmi podobné, zjevně vyplývající z společná evoluce.[64]
Invertované repetice se divoce liší v délce, od 4 000 do 25 000 základní páry každý dlouhý a obsahující jen čtyři nebo až více než 150 genů.[64] Obrácené repetice v rostlinách bývají na horním konci tohoto rozmezí, přičemž každá je dlouhá 20 000–25 000 párů bází.[44][67]
Obrácené oblasti opakování jsou vysoce konzervovaný mezi suchozemskými rostlinami a hromadí několik mutací.[44][67] Podobné obrácené repetice existují v genomech sinic a dalších dvou liniích chloroplastů (glaucophyta a rhodophyceae ), což naznačuje, že předcházejí chloroplastu,[64] ačkoli některé chloroplastové DNA od té doby ztratily[67][68] nebo převrátil obrácené opakování (což z nich dělá přímé opakování).[64] Je možné, že invertované repetice pomáhají stabilizovat zbytek genomu chloroplastů, protože DNA chloroplastů, které ztratily některé z invertovaných repetičních segmentů, mají tendenci se více přeskupovat.[68]
Nukleoidy
Nové chloroplasty mohou obsahovat až 100 kopií jejich DNA,[42] i když počet kopií chloroplastové DNA klesá s věkem chloroplastů na přibližně 15–20.[69] Obvykle jsou zabaleny do nukleoidy, který může obsahovat několik identických kruhů DNA chloroplastů. V každém chloroplastu lze nalézt mnoho nukleoidů.[65]V primitivním červené řasy, chloroplastové DNA nukleoidy jsou seskupeny ve středu chloroplastu, zatímco v zelených rostlinách a zelené řasy ", jsou nukleoidy rozptýleny po celém stroma.[70]
Ačkoli DNA chloroplastů není spojena s pravdou histony,[10] v červené řasy, podobné proteiny, které pevně zabalí každý kruh DNA chloroplastů do a nukleoid byl nalezen.[70]
Oprava DNA
V chloroplastech mechu Physcomitrella patens, Oprava nesouladu DNA protein Msh1 interaguje s rekombinační opravit bílkoviny RecA a RecG k udržení chloroplastů genom stabilita.[71] V chloroplastech rostliny Arabidopsis thaliana the RecA Protein udržuje integritu DNA chloroplastu procesem, který pravděpodobně zahrnuje rekombinační opravu Poškození DNA.[72]
replikace DNA
Přední model replikace cpDNA

Mechanismus replikace chloroplastové DNA (cpDNA) nebyl přesvědčivě určen, ale byly navrženy dva hlavní modely. Vědci se pokusili pozorovat replikaci chloroplastů pomocí elektronová mikroskopie od 70. let.[73][74] Výsledky mikroskopických experimentů vedly k myšlence, že DNA chloroplastů se replikuje pomocí smyčky s dvojitým posunem (D-loop). As the D-loop moves through the circular DNA, it adopts a theta intermediary form, also known as a Cairns replication intermediate, and completes replication with a rolling circle mechanism.[73][66] Transcription starts at specific points of origin. Multiple replication forks open up, allowing replication machinery to transcribe the DNA. As replication continues, the forks grow and eventually converge. The new cpDNA structures separate, creating daughter cpDNA chromosomes.
In addition to the early microscopy experiments, this model is also supported by the amounts of deaminace seen in cpDNA.[73] Deamination occurs when an amino group is lost and is a mutation that often results in base changes. When adenine is deaminated, it becomes hypoxanthine. Hypoxanthine can bind to cytosine, and when the XC base pair is replicated, it becomes a GC (thus, an A → G base change).[75]

Odminování
In cpDNA, there are several A → G deamination gradients. DNA becomes susceptible to deamination events when it is single stranded. When replication forks form, the strand not being copied is single stranded, and thus at risk for A → G deamination. Therefore, gradients in deamination indicate that replication forks were most likely present and the direction that they initially opened (the highest gradient is most likely nearest the start site because it was single stranded for the longest amount of time).[73] This mechanism is still the leading theory today; however, a second theory suggests that most cpDNA is actually linear and replicates through homologous recombination. It further contends that only a minority of the genetic material is kept in circular chromosomes while the rest is in branched, linear, or other complex structures.[73][66]
Alternative model of replication
One of competing model for cpDNA replication asserts that most cpDNA is linear and participates in homologní rekombinace and replication structures similar to the linear and circular DNA structures of bakteriofág T4.[66][76] It has been established that some plants have linear cpDNA, such as maize, and that more species still contain complex structures that scientists do not yet understand.[66] When the original experiments on cpDNA were performed, scientists did notice linear structures; however, they attributed these linear forms to broken circles.[66] If the branched and complex structures seen in cpDNA experiments are real and not artifacts of concatenated circular DNA or broken circles, then a D-loop mechanism of replication is insufficient to explain how those structures would replicate.[66] At the same time, homologous recombination does not expand the multiple A --> G gradients seen in plastomes.[73] Because of the failure to explain the deamination gradient as well as the numerous plant species that have been shown to have circular cpDNA, the predominant theory continues to hold that most cpDNA is circular and most likely replicates via a D loop mechanism.
Gene content and protein synthesis
The chloroplast genome most commonly includes around 100 genes[26][43] that code for a variety of things, mostly to do with the protein pipeline a fotosyntéza. Jako v prokaryoty, genes in chloroplast DNA are organized into operony.[26] Na rozdíl od prokaryotický DNA molecules, chloroplast DNA molecules contain introny (plant mitochondrial DNAs do too, but not human mtDNAs).[77]
Among land plants, the contents of the chloroplast genome are fairly similar.[44]
Chloroplast genome reduction and gene transfer
Over time, many parts of the chloroplast genome were transferred to the nuclear genome of the host,[42][43][78] a process called endosymbiotic gene transfer. As a result, the chloroplast genome is heavily snížena compared to that of free-living cyanobacteria. Chloroplasts may contain 60–100 genes whereas cyanobacteria often have more than 1500 genes in their genome.[79] Recently, a plastid without a genome was found, demonstrating chloroplasts can lose their genome during endosymbiotic the gene transfer process.[80]
Endosymbiotic gene transfer is how we know about the lost chloroplasts in many CASH lineages. Even if a chloroplast is eventually lost, the genes it donated to the former host's nucleus persist, providing evidence for the lost chloroplast's existence. Například zatímco rozsivky (A heterokontophyte ) now have a red algal derived chloroplast, the presence of many green algal genes in the diatom nucleus provide evidence that the diatom ancestor had a green algal derived chloroplast at some point, which was subsequently replaced by the red chloroplast.[46]
In land plants, some 11–14% of the DNA in their nuclei can be traced back to the chloroplast,[41] up to 18% in Arabidopsis, corresponding to about 4,500 protein-coding genes.[81] There have been a few recent transfers of genes from the chloroplast DNA to the nuclear genome in land plants.[43]
Of the approximately 3000 proteins found in chloroplasts, some 95% of them are encoded by nuclear genes. Many of the chloroplast's protein complexes consist of subunits from both the chloroplast genome and the host's nuclear genome. Jako výsledek, proteosyntéza must be coordinated between the chloroplast and the nucleus. The chloroplast is mostly under nuclear control, though chloroplasts can also give out signals regulating genová exprese in the nucleus, called retrograde signaling.[82]
Proteosyntéza
Protein synthesis within chloroplasts relies on two RNA polymerases. One is coded by the chloroplast DNA, the other is of jaderný původ. The two RNA polymerases may recognize and bind to different kinds of promotéři within the chloroplast genome.[83] The ribozomy in chloroplasts are similar to bacterial ribosomes.[84]
Tato sekce potřebuje expanzi with: Genome size differences between algae and land plants, chloroplast stuff coded by the nucleus. Můžete pomoci přidávat k tomu. (Leden 2013) |
Protein targeting and import
Because so many chloroplast genes have been moved to the nucleus, many bílkoviny that would originally have been přeloženo in the chloroplast are now synthesized in the cytoplasm of the plant cell. These proteins must be directed back to the chloroplast, and imported through at least two chloroplast membranes.[85]
Curiously, around half of the protein products of transferred genes aren't even targeted back to the chloroplast. Many became exaptations, taking on new functions like participating in buněčné dělení, protein routing, a dokonce disease resistance. A few chloroplast genes found new homes in the mitochondriální genom —most became nonfunctional pseudogeny, though a few tRNA genes still work in the mitochondrie.[79] Some transferred chloroplast DNA protein products get directed to the secretory pathway,[79] though many secondary plastids are bounded by an outermost membrane derived from the host's buněčná membrána, and therefore topologically outside of the cell because to reach the chloroplast from the cytosol, buněčná membrána must be crossed, which signifies entrance into the extracellular space. In those cases, chloroplast-targeted proteins do initially travel along the secretory pathway.[34]
Because the cell acquiring a chloroplast již měl mitochondrie (a peroxisomy a buněčná membrána for secretion), the new chloroplast host had to develop a unique protein targeting system to avoid having chloroplast proteins being sent to the wrong organela.[85]
![Dva konce polypeptidu se nazývají N-konec nebo amino konec a C-konec nebo karboxylový konec. [86] Tento polypeptid má čtyři aminokyseliny spojené dohromady. Vlevo je N-konec se zelenou aminoskupinou (H2N). Modrý C-konec s karboxylovou skupinou (CO2H) je vpravo.](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c0/Tetrapeptide_structural_formulae.svg/370px-Tetrapeptide_structural_formulae.svg.png)
In most, but not all cases, nuclear-encoded chloroplast proteins are přeloženo s cleavable transit peptide that's added to the N-terminus of the protein precursor. Sometimes the transit sequence is found on the C-terminus of the protein,[87] or within the functional part of the protein.[85]
Transport proteins and membrane translocons
After a chloroplast polypeptid is synthesized on a ribozom v cytosol enzym charakteristický to chloroplast proteins[88] fosforyláty, or adds a fosfátová skupina to many (but not all) of them in their transit sequences.[85]Phosphorylation helps many proteins bind the polypeptide, keeping it from skládací prematurely.[85] This is important because it prevents chloroplast proteins from assuming their active form and carrying out their chloroplast functions in the wrong place—the cytosol.[89][90] At the same time, they have to keep just enough shape so that they can be recognized by the chloroplast.[89] These proteins also help the polypeptide get imported into the chloroplast.[85]
From here, chloroplast proteins bound for the stroma must pass through two protein complexes—the TOC complex nebo translocon na Óuter Chloroplast membranea TIC translocon nebo translocon on the inner Chloroplast membrane translocon.[85] Chloroplast polypeptide chains probably often travel through the two complexes at the same time, but the TIC complex can also retrieve preproteins lost in the mezimembránový prostor.[85]
Struktura
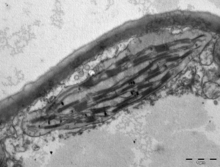
v suchozemské rostliny, chloroplasts are generally lens-shaped, 3–10 μm in diameter and 1–3 μm thick.[91][20] Corn seedling chloroplasts are ≈20 µm3 in volume.[20] Greater diversity in chloroplast shapes exists among the řasy, which often contain a single chloroplast[16] that can be shaped like a net (e.g., Oedogonium ),[92] a cup (e.g., Chlamydomonas ),[93] a ribbon-like spiral around the edges of the cell (e.g., Spirogyra ),[94] or slightly twisted bands at the cell edges (e.g., Sirogonium ).[95] Some algae have two chloroplasts in each cell; they are star-shaped in Zygnema,[96] or may follow the shape of half the cell in objednat Desmidiales.[97] In some algae, the chloroplast takes up most of the cell, with pockets for the jádro and other organelles,[16] for example, some species of Chlorella have a cup-shaped chloroplast that occupies much of the cell.[98]
All chloroplasts have at least three membrane systems—the outer chloroplast membrane, the inner chloroplast membrane, and the thylakoid Systém. Chloroplasts that are the product of secondary endosymbiosis may have additional membranes surrounding these three.[45] Inside the outer and inner chloroplast membranes is the chloroplast stroma, a semi-gel-like fluid[32] that makes up much of a chloroplast's volume, and in which the thylakoid system floats.

There are some common misconceptions about the outer and inner chloroplast membranes. The fact that chloroplasts are surrounded by a double membrane is often cited as evidence that they are the descendants of endosymbiotic sinice. This is often interpreted as meaning the outer chloroplast membrane is the product of the host's buněčná membrána infolding to form a vesicle to surround the ancestral sinice —which is not true—both chloroplast membranes are homologní to the cyanobacterium's original double membranes.[18]
The chloroplast double membrane is also often compared to the mitochondriální double membrane. This is not a valid comparison—the inner mitochondria membrane is used to run proton pumps and carry out oxidační fosforylace across to generate ATP energie. The only chloroplast structure that can considered analogický to it is the internal thylakoid system. Even so, in terms of "in-out", the direction of chloroplast H+ ion flow is in the opposite direction compared to oxidative phosphorylation in mitochondria.[32][99] In addition, in terms of function, the inner chloroplast membrane, which regulates metabolite passage and synthesizes some materials, has no counterpart in the mitochondrion.[32]
Outer chloroplast membrane
The outer chloroplast membrane is a semi-porous membrane that small molecules and ionty can easily diffuse across.[100] However, it is not permeable to larger bílkoviny, so chloroplast polypeptidy being synthesized in the cell cytoplazma must be transported across the outer chloroplast membrane by the TOC complex nebo translocon na Óuter Chloroplast membrána.[85]
The chloroplast membranes sometimes protrude out into the cytoplasm, forming a stromule nebo stromA -containing tubule. Stromules are very rare in chloroplasts, and are much more common in other plastidy jako chromoplasts a amyloplasts in petals and roots, respectively.[101][102] They may exist to increase the chloroplast's plocha povrchu for cross-membrane transport, because they are often branched and tangled with the endoplazmatické retikulum.[103] When they were first observed in 1962, some plant biologists dismissed the structures as artifactual, claiming that stromules were just oddly shaped chloroplasts with constricted regions or dividing chloroplasts.[104] However, there is a growing body of evidence that stromules are functional, integral features of plant cell plastids, not merely artifacts.[105]
Intermembrane space and peptidoglycan wall
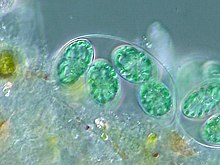
Usually, a thin intermembrane space about 10–20 nanometry thick exists between the outer and inner chloroplast membranes.[106]
Glaucophyte algal chloroplasts have a peptidoglykan layer between the chloroplast membranes. It corresponds to the peptidoglycan cell wall Jejich cyanobacterial ancestors, which is located between their two cell membranes. These chloroplasts are called muroplasts (z latiny "mura", meaning "wall"). Other chloroplasts have lost the cyanobacterial wall, leaving an intermembrane space between the two chloroplast envelope membranes.[32]
Inner chloroplast membrane
The inner chloroplast membrane borders the stroma and regulates passage of materials in and out of the chloroplast. After passing through the TOC complex in the outer chloroplast membrane, polypeptidy must pass through the TIC complex (translocon na inner Chloroplast membrane) which is located in the inner chloroplast membrane.[85]
In addition to regulating the passage of materials, the inner chloroplast membrane is where mastné kyseliny, lipidy, a karotenoidy are synthesized.[32]
Peripheral reticulum
Some chloroplasts contain a structure called the chloroplast peripheral reticulum.[106] It is often found in the chloroplasts of C4 rostliny, though it has also been found in some C3 krytosemenné rostliny,[32] and even some gymnospermy.[107] The chloroplast peripheral reticulum consists of a maze of membranous tubes and vesicles continuous with the inner chloroplast membrane that extends into the internal stromal fluid of the chloroplast. Its purpose is thought to be to increase the chloroplast's plocha povrchu for cross-membrane transport between its stroma and the cell cytoplazma. The small vesicles sometimes observed may serve as transport vesicles to shuttle stuff between the thylakoids and intermembrane space.[108]
Stroma
The protein -rich,[32] zásaditý,[99] vodný fluid within the inner chloroplast membrane and outside of the thylakoid space is called the stroma,[32] which corresponds to the cytosol originálu sinice. Nucleoids z chloroplast DNA, chloroplast ribozomy, the thylakoid system with plastoglobuli, škrob granules, and many bílkoviny can be found floating around in it. The Calvinův cyklus, which fixes CO2 do G3P takes place in the stroma.
Chloroplast ribosomes

Chloroplasts have their own ribosomes, which they use to synthesize a small fraction of their proteins. Chloroplast ribosomes are about two-thirds the size of cytoplasmic ribosomes (around 17 nm vs 25 nm ).[106] They take mRNA transcribed from the chloroplast DNA a translate them into protein. While similar to bacterial ribosomes,[10] chloroplast translation is more complex than in bacteria, so chloroplast ribosomes include some chloroplast-unique features.[109]Small subunit ribosomal RNAs v několika Chlorophyta a euglenid chloroplasts lack motifs for shine-dalgarno sequence recognition,[110] which is considered essential for translation initiation in most chloroplasts and prokaryoty.[111][112] Such loss is also rarely observed in other plastidy and prokaryotes.[110][113]
Plastoglobuli
Plastoglobuli (singular plastoglobulus, někdy hláskované plastoglobule(s)), are spherical bubbles of lipidy a bílkoviny[32] about 45–60 nanometers across.[114] They are surrounded by a lipid monolayer.[114] Plastoglobuli are found in all chloroplasts,[106] but become more common when the chloroplast is under oxidační stres,[114] or when it ages and transitions into a gerontoplast.[32] Plastoglobuli also exhibit a greater size variation under these conditions.[114] They are also common in etioplasts, but decrease in number as the etioplasts mature into chloroplasts.[114]
Plastoglubuli contain both structural proteins and enzymes involved in syntéza lipidů a metabolismus. They contain many types of lipidy počítaje v to plastoquinone, vitamin E., karotenoidy a chlorofyly.[114]
Plastoglobuli were once thought to be free-floating in the stroma, but it is now thought that they are permanently attached either to a thylakoid or to another plastoglobulus attached to a thylakoid, a configuration that allows a plastoglobulus to exchange its contents with the thylakoid network.[114] In normal green chloroplasts, the vast majority of plastoglobuli occur singularly, attached directly to their parent thylakoid. In old or stressed chloroplasts, plastoglobuli tend to occur in linked groups or chains, still always anchored to a thylakoid.[114]
Plastoglobuli form when a bubble appears between the layers of the lipidová dvojvrstva of the thylakoid membrane, or bud from existing plastoglubuli—though they never detach and float off into the stroma.[114] Practically all plastoglobuli form on or near the highly curved edges of the thylakoid disks or sheets. They are also more common on stromal thylakoids than on granal ty.[114]
Starch granules
Starch granules are very common in chloroplasts, typically taking up 15% of the organelle's volume,[115] though in some other plastids like amyloplasts, they can be big enough to distort the shape of the organelle.[106] Starch granules are simply accumulations of starch in the stroma, and are not bounded by a membrane.[106]
Starch granules appear and grow throughout the day, as the chloroplast synthesizes cukry, and are consumed at night to fuel dýchání and continue sugar export into the phloem,[116] though in mature chloroplasts, it is rare for a starch granule to be completely consumed or for a new granule to accumulate.[115]
Starch granules vary in composition and location across different chloroplast lineages. v červené řasy, starch granules are found in the cytoplazma rather than in the chloroplast.[117] v C4 rostliny, mesophyll chloroplasts, which do not synthesize sugars, lack starch granules.[32]
RuBisCO
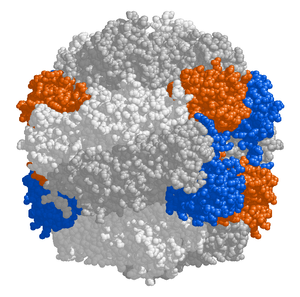
The chloroplast stroma contains many proteins, though the most common and important is RuBisCO, which is probably also the most abundant protein on the planet.[99] RuBisCO is the enzyme that fixes CO2 into sugar molecules. v C3 rostliny, RuBisCO is abundant in all chloroplasts, though in C4 rostliny, it is confined to the bundle sheath chloroplasts, where the Calvinův cyklus is carried out in C4 rostliny.[118]
Pyrenoids
The chloroplasts of some hornworts[119] and algae contain structures called pyrenoids. They are not found in higher plants.[120] Pyrenoids are roughly spherical and highly refractive bodies which are a site of starch accumulation in plants that contain them. They consist of a matrix opaque to electrons, surrounded by two hemispherical starch plates. The starch is accumulated as the pyrenoids mature.[121] In algae with carbon concentrating mechanisms, the enzyme RuBisCO is found in the pyrenoids. Starch can also accumulate around the pyrenoids when CO2 is scarce.[120] Pyrenoids can divide to form new pyrenoids, or be produced "de novo".[121][122]
Thylakoid system

(Top) 10-nm-thick STEM tomographic slice of a lettuce chloroplast. Grana stacks are interconnected by unstacked stromal thylakoids, called “stroma lamellae”. Round inclusions associated with the thylakoids are plastoglobules. Scalebar = 200 nm. See.[123]
(Bottom) Large-scale 3D model generated from segmentation of tomographic reconstructions by STEM. grana = yellow; stroma lamellae = green; plastoglobules = purple; chloroplast envelope = blue. Vidět [123].
Thylakoids (sometimes spelled thylakoïds),[124] are small interconnected sacks which contain the membranes that the light reactions of photosynthesis take place on. Slovo thylakoid pochází z řeckého slova thylakos which means "sack".[125]
Suspended within the chloroplast stroma is the thylakoid system, a highly dynamic collection of membranous sacks called thylakoids kde chlorofyl is found and the light reactions z fotosyntéza happen.[15]Ve většině cévnatá rostlina chloroplasts, the thylakoids are arranged in stacks called grana,[126] though in certain C4 rostlina chloroplasty[118] a nějaký řasa chloroplasts, the thylakoids are free floating.[16]
Thylakoid structure

Používat light microscope, it is just barely possible to see tiny green granules—which were named grana.[106] S elektronová mikroskopie, it became possible to see the thylakoid system in more detail, revealing it to consist of stacks of flat thylakoids which made up the grana, and long interconnecting stromal thylakoids which linked different grana.[106]V transmission electron microscope, thylakoid membranes appear as alternating light-and-dark bands, 8.5 nanometers thick.[106]
For a long time, the three-dimensional structure of the thylakoid membrane system had been unknown or disputed. Many models have been proposed, the most prevalent being the spirálovitý model, in which granum stacks of thylakoids are wrapped by helical stromal thylakoids.[127] Another model known as the 'bifurcation model', which was based on the first electron tomography study of plant thylakoid membranes, depicts the stromal membranes as wide lamellar sheets perpendicular to the grana columns which bifurcates into multiple parallel discs forming the granum-stroma assembly.[128] The helical model was supported by several additional works,[126][129] but ultimately it was determined in 2019 that features from both the helical and bifurcation models are consolidated by newly-discovered left-handed helical membrane junctions.[123] Likely for ease, the thylakoid system is still commonly depicted by older "hub and spoke" models where the grana are connected to each other by tubes of stromal thylakoids.[130]
Grana consist of a stacks of flattened circular granal thylakoids that resemble pancakes. Each granum can contain anywhere from two to a hundred thylakoids,[106] though grana with 10–20 thylakoids are most common.[126] Wrapped around the grana are multiple parallel right-handed helical stromal thylakoids, also known as frets or lamellar thylakoids. The helices ascend at an angle of ~20°, connecting to each granal thylakoid at a bridge-like slit junction.[126][129][123]
The stroma lamellae extend as large sheets perpendicular to the grana columns. These sheets are connected to the right-handed helices either directly or through bifurcations that form left-handed helical membrane surfaces.[123] The left-handed helical surfaces have a similar tilt angle to the right-handed helices (~20°), but ¼ the pitch. Approximately 4 left-handed helical junctions are present per granum, resulting in a pitch-balanced array of right- and left-handed helical membrane surfaces of different radii and pitch that consolidate the network with minimal surface and bending energies.[123] While different parts of the thylakoid system contain different membrane proteins, the thylakoid membranes are continuous and the thylakoid space they enclose form a single continuous labyrinth.[126]
Thylakoid composition
Embedded in the thylakoid membranes are important protein complexes which carry out the light reactions z fotosyntéza. Photosystem II a photosystem I obsahovat light-harvesting complexes s chlorofyl a karotenoidy that absorb light energy and use it to energize electrons. Molecules in the thylakoid membrane use the energized electrons to pump vodíkové ionty into the thylakoid space, decreasing the pH and turning it acidic. ATP syntáza is a large protein complex that harnesses the koncentrační gradient of the hydrogen ions in the thylakoid space to generate ATP energy as the hydrogen ions flow back out into the stroma—much like a dam turbine.[99]
There are two types of thylakoids—granal thylakoids, which are arranged in grana, and stromal thylakoids, which are in contact with the stroma. Granal thylakoids are pancake-shaped circular disks about 300–600 nanometers in diameter. Stromal thylakoids are helicoid sheets that spiral around grana.[126] The flat tops and bottoms of granal thylakoids contain only the relatively flat photosystem II protein complex. This allows them to stack tightly, forming grana with many layers of tightly appressed membrane, called granal membrane, increasing stability and plocha povrchu for light capture.[126]
V porovnání, photosystem I a ATP syntáza are large protein complexes which jut out into the stroma. They can't fit in the appressed granal membranes, and so are found in the stromal thylakoid membrane—the edges of the granal thylakoid disks and the stromal thylakoids. These large protein complexes may act as spacers between the sheets of stromal thylakoids.[126]
The number of thylakoids and the total thylakoid area of a chloroplast is influenced by light exposure. Shaded chloroplasts contain larger and more grana with more thylakoid membrane area than chloroplasts exposed to bright light, which have smaller and fewer grana and less thylakoid area. Thylakoid extent can change within minutes of light exposure or removal.[108]
Pigments and chloroplast colors
Inside the photosystems embedded in chloroplast thylakoid membranes are various photosynthetic pigments, which absorb and transfer light energy. The types of pigments found are different in various groups of chloroplasts, and are responsible for a wide variety of chloroplast colorations.

Chlorophylls
Chlorofyl A is found in all chloroplasts, as well as their cyanobacterial předci. Chlorofyl A je modrá zelená pigment[131] partially responsible for giving most cyanobacteria and chloroplasts their color. Other forms of chlorophyll exist, such as the accessory pigments chlorofyl b, chlorofyl C, chlorofyl d,[16] a chlorofyl F.
Chlorofyl b je olive green pigment found only in the chloroplasts of rostliny, zelené řasy, any secondary chloroplasts obtained through the secondary endosymbiosis of a green alga, and a few sinice.[16] It is the chlorophylls A a b together that make most plant and green algal chloroplasts green.[131]
Chlorofyl C is mainly found in secondary endosymbiotic chloroplasts that originated from a červená řasa, although it is not found in chloroplasts of red algae themselves. Chlorofyl C is also found in some zelené řasy a sinice.[16]
Chlorophylls d a F are pigments found only in some cyanobacteria.[16][132]
Karotenoidy
![Delesseria sanguinea, červená řasa, má chloroplasty, které obsahují červené pigmenty, jako je fykoerytherin, které maskují jejich modrozelený chlorofyl a. [35]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/19/Delesseria_sanguinea_Helgoland.JPG/250px-Delesseria_sanguinea_Helgoland.JPG)
Navíc chlorofyly, another group of žlutá –oranžový[131] pigments called karotenoidy are also found in the photosystems. There are about thirty photosynthetic carotenoids.[133] They help transfer and dissipate excess energy,[16] and their bright colors sometimes override the chlorophyll green, like during the podzim, when the leaves of some land plants change color.[134] β-karoten is a bright red-orange carotenoid found in nearly all chloroplasts, like chlorofyl A.[16] Xanthophylls, especially the orange-red zeaxanthin, are also common.[133] Many other forms of carotenoids exist that are only found in certain groups of chloroplasts.[16]
Phycobilins
Phycobilins are a third group of pigments found in sinice, a glaucophyte, red algal, a cryptophyte chloroplasty.[16][135] Phycobilins come in all colors, though phycoerytherin is one of the pigments that makes many red algae red.[136] Phycobilins often organize into relatively large protein complexes about 40 nanometers across called phycobilisomes.[16] Jako photosystem I a ATP syntáza, phycobilisomes jut into the stroma, preventing thylakoid stacking in red algal chloroplasts.[16] Cryptophyte chloroplasts and some cyanobacteria don't have their phycobilin pigments organized into phycobilisomes, and keep them in their thylakoid space instead.[16]
| Photosynthetic pigments Table of the presence of various pigments across chloroplast groups. Colored cells represent pigment presence.[16][133][135] | |||||||||
| ChlorofylA | Chlorofylb | ChlorofylC | Chlorofyl d a F | Xanthophylls | α-carotene | β-karoten | Phycobilins | ||
| Land plants | |||||||||
| Zelené řasy | |||||||||
| Euglenofyty a Chlorarachniophytes | |||||||||
| Multicellular red algae | |||||||||
| Unicellular red algae | |||||||||
| Haptophyty a Dinophytes | |||||||||
| Kryptofyty | |||||||||
| Glaukofyty | |||||||||
| Sinice | |||||||||
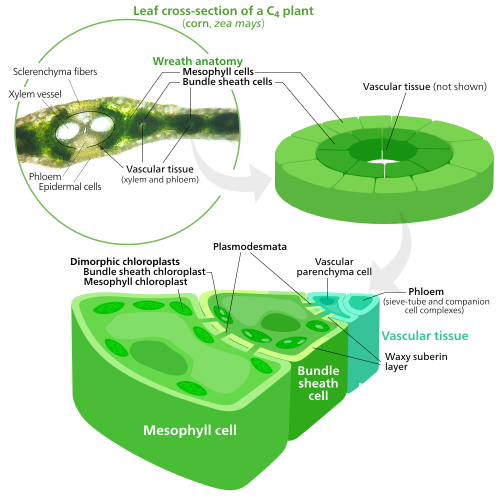
Specialized chloroplasts in C4 rostliny
To fix oxid uhličitý into sugar molecules in the process of fotosyntéza, chloroplasts use an enzyme called RuBisCO. RuBisCO has a problem—it has trouble distinguishing between oxid uhličitý a kyslík, so at high oxygen concentrations, RuBisCO starts accidentally adding oxygen to sugar precursors. This has the end result of ATP energy being wasted and CO
2 being released, all with no sugar being produced. This is a big problem, since O2 is produced by the initial light reactions of photosynthesis, causing issues down the line in the Calvinův cyklus which uses RuBisCO.[137]
C4 rostliny evolved a way to solve this—by spatially separating the light reactions and the Calvin cycle. The light reactions, which store light energy in ATP a NADPH, are done in the mesophyll cells of a C4 list. The Calvin cycle, which uses the stored energy to make sugar using RuBisCO, is done in the bundle sheath cells, a layer of cells surrounding a žíla v list.[137]
As a result, chloroplasts in C4 mesophyll cells and bundle sheath cells are specialized for each stage of photosynthesis. In mesophyll cells, chloroplasts are specialized for the light reactions, so they lack RuBisCO, and have normal grana a thylakoids,[118] which they use to make ATP and NADPH, as well as oxygen. They store CO
2 in a four-carbon compound, which is why the process is called C4 fotosyntéza. The four-carbon compound is then transported to the bundle sheath chloroplasts, where it drops off CO
2 and returns to the mesophyll. Bundle sheath chloroplasts do not carry out the light reactions, preventing oxygen from building up in them and disrupting RuBisCO activity.[137] Because of this, they lack thylakoids organized into grana stacks—though bundle sheath chloroplasts still have free-floating thylakoids in the stroma where they still carry out cyclic electron flow, a light-driven method of synthesizing ATP to power the Calvin cycle without generating oxygen. They lack photosystem II, and only have photosystem I —the only protein complex needed for cyclic electron flow.[118][137] Because the job of bundle sheath chloroplasts is to carry out the Calvin cycle and make sugar, they often contain large škrob zrna.[118]
Both types of chloroplast contain large amounts of chloroplast peripheral reticulum,[118] which they use to get more plocha povrchu to transport stuff in and out of them.[107][108] Mesophyll chloroplasts have a little more peripheral reticulum than bundle sheath chloroplasts.[138]
Umístění
Distribution in a plant
Not all cells in a multicellular plant contain chloroplasts. All green parts of a plant contain chloroplasts—the chloroplasts, or more specifically, the chlorofyl in them are what make the photosynthetic parts of a plant green.[15] The rostlinné buňky which contain chloroplasts are usually parenchyma cells, though chloroplasts can also be found in collenchyma tkáň.[139] A plant cell which contains chloroplasts is known as a chlorenchyma cell. Typický chlorenchyma buňka suchozemské rostliny obsahuje asi 10 až 100 chloroplastů.

V některých rostlinách, jako je kaktusy, chloroplasty se nacházejí v stonky,[140] ačkoli ve většině rostlin jsou chloroplasty koncentrovány v listy. Jeden čtverec milimetr listové tkáně může obsahovat půl milionu chloroplastů.[15] V listu se chloroplasty nacházejí hlavně v mezofyl vrstvy a list a strážní buňky z průduchy. Palisádový mezofyl buňky mohou obsahovat 30–70 chloroplastů na buňku, zatímco stomatální ochranné buňky obsahují pouze kolem 8–15 na buňku a mnohem méně chlorofyl. Chloroplasty lze také nalézt v plášť svazku buňky listu, zejména v C4 rostliny, které provádějí Calvinův cyklus v buňkách jejich svazku. Často chybí v pokožka listu.[141]
Mobilní umístění
Pohyb chloroplastů
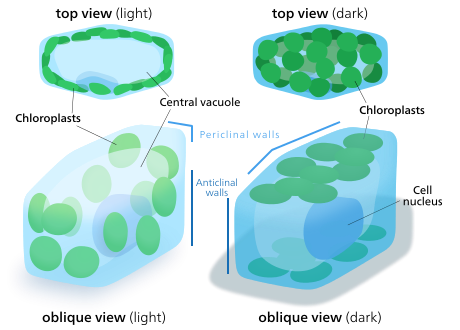
Chloroplasty rostlinných a řasových buněk se mohou orientovat tak, aby co nejlépe vyhovovaly dostupnému světlu. Za špatných světelných podmínek se budou šířit v archu - maximalizovat plochu, aby absorbovaly světlo. Pod intenzivním světlem budou hledat úkryt vyrovnáním ve svislých sloupcích podél rostlinné buňky buněčná stěna nebo se otočit do strany, aby je světlo zasáhlo hranou. To snižuje expozici a chrání je před fotooxidační poškození.[142] Tato schopnost distribuovat chloroplasty, aby se mohly uchýlit za sebe nebo se rozložit, může být důvodem, proč se suchozemské rostliny vyvinuly tak, že místo mnoha velkých měly mnoho malých chloroplastů.[143]Pohyb chloroplastů je považován za jeden z nejvíce regulovaných systémů stimulace a odezvy, které lze v rostlinách najít.[144] Mitochondrie Bylo také pozorováno, že při pohybu sledují chloroplasty.[145]
U vyšších rostlin je pohyb chloroplastů řízen fototropiny, modré světlo fotoreceptory také zodpovědný za rostlinu fototropismus. U některých řas mechy, kapradiny, a kvetoucí rostliny, pohyb chloroplastů je ovlivněn kromě modrého také červeným světlem,[142] i když velmi dlouhé červené vlnové délky spíše brání pohybu než ho zrychlují. Modré světlo obecně způsobuje, že chloroplasty hledají úkryt, zatímco červené světlo je přitahuje, aby maximalizovalo absorpci světla.[145]
Studie z Vallisneria gigantea, vodní kvetoucí rostlina, ukázali, že chloroplasty se mohou pohybovat do pěti minut od expozice světla, i když zpočátku nevykazují žádnou směrovost sítě. Mohou se pohybovat dál mikrofilament stopy a skutečnost, že síť z mikrofilamentů mění svůj tvar a vytváří voštinovou strukturu obklopující chloroplasty poté, co byly přesunuty, naznačuje, že mikrofilamenta mohou pomoci ukotvit chloroplasty na místě.[144][145]
Funkce a chemie
Chraňte buněčné chloroplasty
Tato sekce potřebuje expanzi s: určené funkce, kontroverzní funkce, charakteristiky a populace. Můžete pomoci přidávat k tomu. (srpen 2013) |
Na rozdíl od většiny epidermálních buněk je strážní buňky rostliny průduchy obsahují relativně dobře vyvinuté chloroplasty.[141] Přesně to, co dělají, je však kontroverzní.[146]
Rostlinná vrozená imunita
Rostliny chybí specializované imunitní buňky —V rostlině se účastní všechny rostlinné buňky imunitní odpověď. Chloroplasty spolu s jádro, buněčná membrána, a endoplazmatické retikulum,[147] jsou klíčoví hráči patogen obrana. Díky své roli v imunitní odpovědi rostlinné buňky se patogeny často zaměřují na chloroplasty.[147]
Rostliny mají dvě hlavní imunitní odpovědi - hypersenzitivní reakce, ve kterém se infikované buňky uzavírají a podstupují programovaná buněčná smrt, a systémová získaná rezistence, kde infikované buňky uvolňují signály varující zbytek rostliny před přítomností patogenu. Chloroplasty stimulují obě reakce záměrným poškozením jejich fotosyntetického systému a produkují reaktivní formy kyslíku. Vysoká hladina reaktivních forem kyslíku způsobí hypersenzitivní reakce. Reaktivní formy kyslíku také přímo zabíjejí všechny patogeny v buňce. Iniciují se nižší hladiny reaktivních forem kyslíku systémová získaná rezistence, který vyvolává produkci obranných molekul ve zbytku rostliny.[147]
U některých rostlin je známo, že chloroplasty se přibližují k místu infekce a jádro během infekce.[147]
Chloroplasty mohou sloužit jako buněčné senzory. Po detekci stresu v buňce, který může být způsoben patogenem, chloroplasty začnou produkovat podobné molekuly kyselina salicylová, kyselina jasmonová, oxid dusnatý a reaktivní formy kyslíku které mohou sloužit jako obranné signály. Jako buněčné signály jsou reaktivní formy kyslíku nestabilní molekuly, takže pravděpodobně neopouštějí chloroplast, ale místo toho předávají svůj signál neznámé druhé molekule posla. Všechny tyto molekuly iniciují retrográdní signalizace —Signály z chloroplastů, které regulují genová exprese v jádře.[147]
Kromě obranné signalizace, chloroplasty, s pomocí peroxisomy,[148] pomozte syntetizovat důležitou obrannou molekulu, jasmonát. Chloroplasty syntetizují vše mastné kyseliny v rostlinné buňce[147][149]—kyselina linolová, mastná kyselina, je předchůdcem jasmonátu.[147]
Fotosyntéza
Jednou z hlavních funkcí chloroplastu je jeho role v fotosyntéza, proces, při kterém se světlo přeměňuje na chemickou energii a následně produkuje jídlo ve formě cukry. Voda (H2O) a oxid uhličitý (CO.)2) se používají při fotosyntéze a cukru a kyslík (Ó2) je vyroben pomocí světelná energie. Fotosyntéza je rozdělena do dvou fází - na světelné reakce, kde se voda štěpí za vzniku kyslíku, a temné reakce nebo Calvinův cyklus, který vytváří molekuly cukru z oxidu uhličitého. Obě fáze jsou spojeny nosiči energie adenosintrifosfát (ATP) a nikotinamid adenin dinukleotid fosfát (NADP+).[150][151]
Světelné reakce

Světelné reakce probíhají na tylakoidních membránách. Vzali světelná energie a uložte jej NADPH, forma NADP+, a ATP na palivo temné reakce.
Nosiče energie
ATP je fosforylovaná verze adenosindifosfát (ADP), který ukládá energii v buňce a řídí většinu buněčných aktivit. ATP je energizovaná forma, zatímco ADP je (částečně) vyčerpaná forma. NADP+ je elektronový nosič, který přepravuje vysokoenergetické elektrony. Ve světelných reakcích to dopadne snížena, což znamená, že sbírá elektrony, stává se NADPH.
Fotofosforylace
Stejně jako mitochondrie používají chloroplasty potenciální energie uloženo v H+ nebo gradient vodíkových iontů pro generování energie ATP. Dva fotosystémy zachytit světelnou energii k energizaci elektrony vzáno z voda a uvolněte je dolů elektronový transportní řetězec. The molekuly mezi fotosystémy využívá energii elektronů k čerpání vodíkových iontů do tylakoidního prostoru a vytváří a koncentrační gradient, s více vodíkovými ionty (až tisíckrát tolik)[99] uvnitř tylakoidního systému než ve stromatu. Vodíkové ionty pak v prostoru tylakoidů šířit zpět dolů jejich koncentrační gradient, proudící zpět ven do stromatu ATP syntáza. ATP syntáza využívá energii z proudících vodíkových iontů do fosforylát adenosindifosfát do adenosintrifosfát nebo ATP.[99][152] Protože chloroplastová ATP syntáza vyčnívá do stromatu, je tam syntetizována ATP, aby mohla být použita v temných reakcích.[153]
NADP+ snížení
Elektrony jsou často odstraněny z elektronové transportní řetězce účtovat NADP+ s elektrony, snižování to NADPH. Jako ATP syntáza, ferredoxin-NADP+ reduktáza, enzym, který snižuje NADP+, uvolňuje NADPH, který vytváří, do stromatu, přesně tam, kde je to nutné pro temné reakce.[153]
Protože NADP+ redukce odstraní elektrony z elektronových transportních řetězců, je nutné je vyměnit - úkol fotosystém II, který se rozdělí voda molekuly (H.2O) získat elektrony z jeho atomy vodíku.[99][150]
Cyklická fotofosforylace
Zatímco fotosystém II fotolýzy voda k získání a energii nových elektronů, fotosystém I jednoduše reenergizuje vyčerpané elektrony na konci řetězce transportu elektronů. Za normálních okolností jsou reenergizované elektrony odebrány NADP+, i když někdy mohou proudit zpět dolů více H+-pumpování elektronových transportních řetězců k transportu více vodíkových iontů do thylakoidního prostoru za účelem generování více ATP. Toto se nazývá cyklická fotofosforylace protože elektrony jsou recyklovány. Cyklická fotofosforylace je běžná v C4 rostliny, které potřebují více ATP než NADPH.[137]
Temné reakce
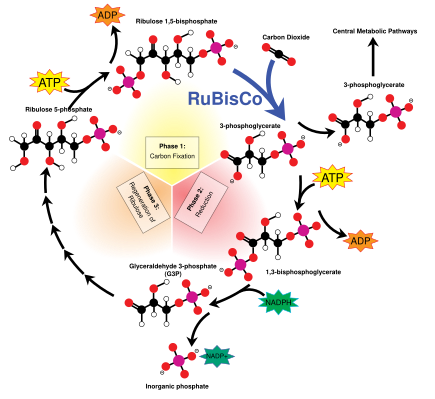
The Calvinův cyklus, také známý jako temné reakce, je řada biochemických reakcí, které opravují CO2 do G3P molekuly cukru a využívá energii a elektrony z ATP a NADPH vyrobené ve světelných reakcích. Kalvinův cyklus probíhá ve stromatu chloroplastu.[137]
Zatímco pojmenovaný "temné reakce"ve většině rostlin probíhají ve světle, protože temné reakce jsou závislé na produktech světelných reakcí.[15]
Uhlíková fixace a syntéza G3P
Calvinův cyklus začíná použitím enzymu RuBisCO opravit CO2 na pět uhlíkových Ribulosa bisfosfát (RuBP) molekuly. Výsledkem jsou nestabilní šest uhlíkové molekuly, které se okamžitě rozpadají na tzv. Tři uhlíkové molekuly Kyselina 3-fosfoglycerová nebo 3-PGA ATP a NADPH vyrobený ve světelných reakcích se používá k převodu 3-PGA na glyceraldehyd-3-fosfát nebo molekuly cukru G3P. Většina molekul G3P se recykluje zpět do RuBP pomocí energie z více ATP, ale jedna z každých šesti vyprodukovaných opouští cyklus - konečný produkt temných reakcí.[137]
Cukry a škroby
Glyceraldehyd-3-fosfát se může zdvojnásobit a vytvořit větší molekuly cukru glukóza a fruktóza. Tyto molekuly jsou zpracovány az nich ještě větší sacharóza, a disacharid běžně známý jako stolní cukr, se vyrábí, ačkoli tento proces probíhá mimo chloroplast, v cytoplazma.[154]
Alternativně glukóza monomery v chloroplastu lze spojit dohromady a vytvořit škrob, který se hromadí do škrobová zrna nachází se v chloroplastu.[154]Za podmínek, jako je vysoký atmosférický CO2 koncentrace těchto škrobových zrn mohou velmi růst a narušit grana a thylakoidy. Škrobové granule vytlačují tylakoidy, ale ponechávají je neporušené.[155]Podmáčené kořeny může také způsobit škrob nahromadění v chloroplastech, pravděpodobně kvůli méně sacharóza jsou vyváženy z chloroplastů (nebo přesněji: rostlinná buňka ). To vyčerpává rostlinu volný fosfát zásobování, které nepřímo stimuluje syntézu škrobu chloroplastů.[155]I když jsou spojeny s nízkou rychlostí fotosyntézy, samotná škrobová zrna nemusí nutně významně narušovat účinnost fotosyntézy,[156] a může to být prostě vedlejší účinek jiného faktoru snižujícího fotosyntézu.[155]
Fotorespirace
Fotorespirace může dojít, když je koncentrace kyslíku příliš vysoká. RuBisCO nedokáže velmi dobře rozlišovat mezi kyslíkem a oxidem uhličitým, takže může omylem přidat O2 místo CO2 na RuBP. Tento proces snižuje účinnost fotosyntézy - spotřebovává ATP a kyslík, uvolňuje CO2a neprodukuje žádný cukr. Může ztrácet až polovinu uhlíku fixovaného Calvinovým cyklem.[150] V různých liniích se vyvinulo několik mechanismů, které zvyšují koncentraci oxidu uhličitého ve srovnání s kyslíkem v chloroplastu, což zvyšuje účinnost fotosyntézy. Tyto mechanismy se nazývají mechanismy koncentrace oxidu uhličitého nebo CCM. Tyto zahrnují Metabolismus kyseliny Crassulacean, C4 uhlíková fixace,[150] a pyrenoidy. Chloroplasty v C.4 rostliny jsou pozoruhodné, protože vykazují odlišné chloroflastový dimorfismus.
pH
Kvůli H+ gradient přes tylakoidní membránu, vnitřek tylakoidu je kyselé, s pH kolem 4,[157] zatímco stroma je mírně zásaditá, s pH kolem 8.[158]Optimální pH stromatu pro Calvinův cyklus je 8,1, přičemž reakce se téměř zastaví, když pH klesne pod 7,3.[159]
CO2 ve vodě se může tvořit kyselina uhličitá, které mohou narušit pH izolovaných chloroplastů a interferovat s fotosyntézou, přestože CO2 je použitý ve fotosyntéze. Chloroplasty však žijí rostlinné buňky tím nejsou tolik ovlivněny.[158]
Chloroplasty mohou pumpovat K.+ a H+ ionty do sebe a ze sebe pomocí špatně pochopeného světelného dopravního systému.[158]
Za přítomnosti světla může pH lumen thylakoidu klesnout až na 1,5 jednotky pH, zatímco pH stromatu může vzrůst téměř o jednu jednotku pH.[159]
Syntéza aminokyselin
Samotné chloroplasty tvoří téměř všechny rostlinné buňky aminokyseliny v jejich stroma[160] kromě obsahující síru ty jako cystein a methionin.[161][162] Cystein se vyrábí v chloroplastech ( proplastid také), ale je také syntetizován v cytosol a mitochondrie, pravděpodobně proto, že má potíže s překračováním membrán, aby se dostalo tam, kde je potřeba.[162] Je známo, že chloroplast vyrábí prekurzory methioninu, ale není jasné, zda organela provádí poslední úsek cesty, nebo zda k ní dochází v cytosol.[163]
Jiné sloučeniny dusíku
Chloroplasty tvoří celou buňku puriny a pyrimidiny —The dusíkaté báze nalezen v DNA a RNA.[160] Také konvertují dusitany (NE2−) do amoniak (NH3), který závod dodává dusík udělat jeho aminokyseliny a nukleotidy.[160]
Ostatní chemické výrobky
Tato sekce potřebuje expanzi with: needs more about lipids, also paramylon. Můžete pomoci přidávat k tomu. (Březen 2013) |
Plastid je místem rozmanitých a složitých lipid syntéza v rostlinách.[164][165] Uhlík použitý k vytvoření většiny lipidů je z acetyl-CoA, což je produkt dekarboxylace z pyruvát.[164] Pyruvát může vstoupit do plastidu z cytosolu pasivní difúzí přes membránu po výrobě v glykolýza.[166] Pyruvát se také vyrábí v plastidu z fosfoenolpyruvátu, metabolitu vyrobeného v cytosolu z pyruvátu nebo PGA.[164] Acetát v cytosolu není k dispozici pro biosyntézu lipidů v plastidu.[167] Typická délka mastných kyselin produkovaných v plastidu je 16 nebo 18 uhlíků s 0-3 cis dvojné vazby.[168]
Biosyntéza mastných kyselin z acetyl-CoA vyžaduje primárně dva enzymy. Acetyl-CoA karboxyláza vytváří malonyl-CoA, který se používá jak v prvním kroku, tak v prodloužení syntézy. Syntáza mastných kyselin (FAS) je velký komplex enzymů a kofaktorů včetně acylového nosného proteinu (ACP), který při syntéze drží acylový řetězec. Zahájení syntézy začíná kondenzací malonyl-ACP s acetyl-CoA za vzniku ketobutyryl-ACP. 2 snížení zahrnující použití NADPH a jedna dehydratace vytvoří butyryl-ACP. Rozšíření mastné kyseliny pochází z opakovaných cyklů kondenzace, redukce a dehydratace malonyl-ACP.[164]
Další lipidy jsou odvozeny od dráha methyl-erythritol fosfátu (MEP) a skládá se z gibereliny, steroly, kyselina abscisová, fytol a nespočet sekundární metabolity.[164]
Diferenciace, replikace a dědičnost

Chloroplasty jsou speciální typ organely rostlinných buněk zvané a plastid, ačkoli tyto dva výrazy jsou někdy používány zaměnitelně. Existuje mnoho dalších typů plastidů, které plní různé funkce. Všechny chloroplasty v rostlině pocházejí z nediferencovaných proplastidů nalezených v zygota,[160] nebo oplodněné vejce. Proplastidy se běžně vyskytují u dospělých rostlin apikální meristémy. Chloroplasty se obvykle nevyvíjejí z proplastidů v kořenové špičky meristémů[169]—Místo toho tvorba škrobu amyloplasty je častější.[160]
v střílí, proplastidy z střílet apikální meristémy se v roce mohou postupně vyvinout v chloroplasty fotosyntetický listové tkáně s dozráváním listu, pokud jsou vystaveny požadovanému světlu.[12] Tento proces zahrnuje invaginace vnitřní plastidové membrány, tvořící vrstvy membrány, které vyčnívají do vnitřní stroma. Tyto membránové listy se poté skládají a tvoří tylakoidy a grana.[170]
Li krytosemenná rostlina výhonky nejsou vystaveny potřebnému světlu pro tvorbu chloroplastů, z proplastidů se může vyvinout etioplast fázi, než se stanou chloroplasty. Etioplast je plastid, který postrádá chlorofyl, a má vnitřní membránové invaginace, které tvoří mřížku trubic v jejich stromatu, nazývanou a prolamelární tělo. Zatímco etioplastům chybí chlorofyl, mají žlutý chlorofyl předchůdce na skladě.[12] Během několika minut po vystavení světlu se prolamelární tělo začne reorganizovat na hromady tylakoidů a začne se produkovat chlorofyl. Tento proces, při kterém se z etioplastu stává chloroplast, trvá několik hodin.[170] Gymnospermy nevyžadují světlo k tvorbě chloroplastů.[170]
Světlo však nezaručuje, že se z proplastidu vyvine chloroplast. To, zda se z proplastidu vyvine chloroplast, je nějaký jiný druh plastidu většinou řízen jádro[12] a je do značné míry ovlivněn druhem buňky, ve které sídlí.[160]

Plastidová interkonverze
Plastidová diferenciace není trvalá, ve skutečnosti je možná řada vzájemných přeměn. Chloroplasty lze převést na chromoplasty, což jsou pigment -plněné plastidy zodpovědné za jasné barvy viděné v květiny a zralé ovoce. Skladování škrobu amyloplasty lze také převést na chromoplasty a je možné, aby se proplastidy vyvinuly přímo do chromoplastů. Chromoplasty a amyloplasty se mohou také stát chloroplasty, jako to, co se stane, když a mrkev nebo a brambor svítí. Pokud je rostlina zraněna, nebo něco jiného způsobí návrat rostlinné buňky k meristematic stavu, chloroplasty a jiné plastidy se mohou proměnit zpět v proplastidy. Chloroplast, amyloplast, chromoplast, proplast atd. Nejsou absolutní stavy - přechodné formy jsou běžné.[160]
Divize
Tato sekce potřebuje expanzi s: funkcemi, dynamickým sestavením Z-kroužku, regulátory jako Giant Chloroplast 1. Můžete pomoci přidávat k tomu. (únor 2013) |
Většina chloroplastů ve fotosyntetické buňce se nevyvíjí přímo z proplastidů nebo etioplastů. Ve skutečnosti typické střílet meristematic rostlinná buňka obsahuje pouze 7–20 proplastidy. Tyto proplastidy se diferencují na chloroplasty, které se rozdělí a vytvoří 30–70 chloroplastů nalezených ve zralé fotosyntetické rostlinné buňce. Pokud buňka rozděluje, dělení chloroplasty poskytuje další chloroplasty k rozdělení mezi dvě dceřiné buňky.[171]
V jednobuněčných řasy, dělení chloroplastů je jediný způsob, jak se tvoří nové chloroplasty. Neexistuje žádná diferenciace proplastidů - když se buňka řas rozdělí, její chloroplast se rozdělí spolu s ní a každá dceřiná buňka přijímá zralý chloroplast.[170]
Téměř všechny chloroplasty v buňce se rozdělí spíše než malá skupina rychle se dělících chloroplastů.[172] Chloroplasty nemají žádnou definici S-fáze —Jeho replikace DNA není synchronizována nebo omezena na replikaci jejich hostitelských buněk.[173]Hodně z toho, co víme o dělení chloroplastů, pochází ze studia podobných organismů Arabidopsis a červená řasa Cyanidioschyzon merolae.[143]
Proces dělení začíná, když bílkoviny FtsZ1 a FtsZ2 sestavit do vláken a pomocí proteinu ARC6, tvoří strukturu zvanou Z-kruh ve stromatu chloroplastu.[143][174] The Minimální systém řídí umístění Z-kroužku a zajišťuje, že chloroplast je štěpen víceméně rovnoměrně. Protein Mysl brání FtsZ ve spojení a vytváření vláken. Další protein ARC3 může být také zapojen, ale není to příliš dobře pochopeno. Tyto proteiny jsou aktivní na pólech chloroplastu a brání tam tvorbě Z-kruhu, ale blízko středu chloroplastu, Těžit inhibuje je a umožňuje vytvoření Z-kroužku.[143]
Dále dva plastidové dělící kroužky, nebo se tvoří kroužky PD. Vnitřní kroužek dělící plastid je umístěn na vnitřní straně vnitřní membrány chloroplastu a je vytvořen jako první.[143] Vnější kroužek dělící plastid se nachází obalený kolem vnější membrány chloroplastů. Skládá se z vláken o průměru asi 5 nanometrů,[143] uspořádány v řadách vzdálených 6,4 nanometrů a zmenšují se, aby vytlačily chloroplast. Tehdy začíná zúžení chloroplastů.[174]
U několika druhů jako Cyanidioschyzon merolae, chloroplasty mají třetí plastid-dělící kruh umístěný v mezimembránovém prostoru chloroplastů.[143][174]
Pozdě do fáze zúžení, dynamin bílkoviny se shromažďují kolem vnějšího kruhu dělícího plastid,[174] pomáhá poskytovat sílu k vytlačování chloroplastů.[143] Mezitím se Z-kroužek a vnitřní kroužek dělící plastid rozpadají.[174] Během této fáze je mnoho chloroplastových DNA plazmidů plovoucích ve stromatu rozděleno a distribuováno do dvou tvořících dceřiných chloroplastů.[175]
Později dynaminy migrují pod vnějším dělícím prstencem plastidu do přímého kontaktu s vnější membránou chloroplastu,[174] štěpit chloroplast ve dvou dceřiných chloroplastech.[143]
Zbytek vnějšího plastidového dělícího prstence zůstává plovoucí mezi dvěma dceřinými chloroplasty a zbytek dynaminového kruhu zůstává připojen k jednomu z dceřiných chloroplastů.[174]
Z pěti nebo šesti prstenců podílejících se na dělení chloroplastů je přítomen pouze vnější kroužek dělící plastid pro celou fázi zúžení a dělení - zatímco Z-kroužek se vytvoří jako první, zúžení nezačne, dokud se nevytvoří vnější kroužek dělící plastid.[174]
Nařízení
U druhů řasy které obsahují jediný chloroplast, je regulace dělení chloroplastů nesmírně důležitá, aby bylo zajištěno, že každá dceřiná buňka obdrží chloroplast - chloroplasty nelze vyrábět od nuly.[77][143] V organismech, jako jsou rostliny, jejichž buňky obsahují více chloroplastů, je koordinace volnější a méně důležitá. Je pravděpodobné, že chloroplast a buněčné dělení jsou do jisté míry synchronizovány, i když mechanismy pro ně nejsou většinou známy.[143]
Ukázalo se, že světlo je požadavkem na dělení chloroplastů. Chloroplasty mohou růst a postupovat v některých fázích zúžení pod nekvalitní zelené světlo, ale k dokončení dělení jsou pomalé - k úplnému dělení vyžadují vystavení jasnému bílému světlu. Bylo pozorováno, že špenátové listy pěstované pod zeleným světlem obsahují mnoho velkých chloroplastů ve tvaru činky. Vystavení bílému světlu může stimulovat tyto chloroplasty k rozdělení a snížení populace chloroplastů ve tvaru činky.[172][175]
Dědičnost chloroplastů
Jako mitochondrie, chloroplasty jsou obvykle zděděny od jednoho rodiče. Dědičnost biparentálních chloroplastů - kde se plastidové geny dědí z obou mateřských rostlin - se u některých kvetoucích rostlin vyskytuje ve velmi nízkých úrovních.[176]
Mnoho mechanismů brání dědičnosti DNA biparentálních chloroplastů, včetně selektivní destrukce chloroplastů nebo jejich genů v gameta nebo zygota a chloroplasty od jednoho rodiče jsou vyloučeny z embrya. Rodičovské chloroplasty lze třídit tak, že u každého potomka je přítomen pouze jeden typ.[177]
Gymnospermy, jako borovice, většinou předávají chloroplasty otcovsky,[178] zatímco kvetoucí rostliny často dědí chloroplasty mateřsky.[179][180] O kvetoucích rostlinách se kdysi myslelo, že zdědí chloroplasty pouze mateřsky. Nyní však existuje mnoho zdokumentovaných případů krytosemenné rostliny dědičně chloroplasty otcovsky.[176]
Krytosemenné rostliny, které mateřsky přenášejí chloroplasty, mají mnoho způsobů, jak zabránit otcovskému dědictví. Většina z nich vyrábí spermie které neobsahují žádné plastidy. Existuje mnoho dalších zdokumentovaných mechanismů, které zabraňují otcovské dědičnosti v těchto kvetoucích rostlinách, jako například různé rychlosti replikace chloroplastů v embryu.[176]
U krytosemenných rostlin je otcovská dědičnost chloroplastů pozorována častěji v hybridy než u potomků rodičů stejného druhu. To naznačuje, že nekompatibilní hybridní geny mohou interferovat s mechanismy, které zabraňují otcovské dědičnosti.[176]
Transplastomické rostliny
Chloroplasty v poslední době upoutaly pozornost vývojářů geneticky modifikované plodiny. Protože u většiny kvetoucích rostlin chloroplasty nejsou zděděny od mužského rodiče, transgeny v těchto plastidech nelze šířit pomocí pyl. To dělá plastidová transformace cenný nástroj pro tvorbu a pěstování geneticky modifikovaných rostlin, které jsou biologicky obsaženy, čímž představují podstatně nižší environmentální rizika. Tento biologický obal Strategie je proto vhodná pro založení koexistence konvenčního a organického zemědělství. Zatímco spolehlivost tohoto mechanismu dosud nebyla studována pro všechny relevantní druhy plodin, nedávné výsledky u rostlin tabáku jsou slibné a ukazují neúspěšnou míru zadržování transplastomických rostlin na 3 z 1 000 000.[180]
Reference
- ^ Jones D. (2003) [1917]. Roach P, Hartmann J, Setter J (eds.). Slovník výslovnosti v angličtině. Cambridge: Cambridge University Press. ISBN 3-12-539683-2.
- ^ „Chloroplast“. Slovník Merriam-Webster.
- ^ Základní biologie (18. března 2016). "Bakterie".
- ^ "chloroplast". Online slovník etymologie.
- ^ von Mohl, H. (1835/1837). Ueber die Vermehrung der Pflanzen-Zellen durch Teilung. Dissert. Tubingen 1835. Flóra 1837, .
- ^ A b Schimper, AF (1883). „Über die Entwicklung der Chlorophyllkörner und Farbkörper“ [O vývoji chlorofylových zrn a skvrn]. Bot. Zeitung (v němčině). 41: 105–14, 121–31, 137–46, 153–62. Archivovány od originál dne 19. října 2013.
- ^ Strasburger E (1884). Das botanische Praktikum (1. vyd.). Jena: Gustav Fischer.
- ^ Gunning B, Koenig F, Govindjee P (2006). „Věnování průkopníkům výzkumu struktury chloroplastů“. V Wise RR, Hoober JK (eds.). Struktura a funkce plastidů. Nizozemsko: Springer. str. xxiii – xxxi. ISBN 9781402065705.
- ^ Hoober JK (1984). Chloroplasty. New York: Plenum. ISBN 9781461327677.
- ^ A b C d E F G h i j Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biologie (8. vydání). Benjamin Cummings (Pearson). p. 516. ISBN 978-0-8053-6844-4.
- ^ Mereschkowsky C (1905). „Über Natur und Ursprung der Chromatophoren im Pflanzenreiche“ [O povaze a původu chromatoforů v rostlinné říši]. Biol Centralbl (v němčině). 25: 593–604.
- ^ A b C d Alberts B (2002). Molekulární biologie buňky (4. vyd.). New York [USA]: Garland. ISBN 0-8153-4072-9.
- ^ A b Moore KR, Magnabosco C, Momper L, Gold DA, Bosak T, Fournier GP (2019). „Rozšířená ribozomální fylogeneze sinic podporuje hluboké ukládání plastidů“. Hranice v mikrobiologii. 10: 1612. doi:10.3389 / fmicb.2019.01612. PMC 6640209. PMID 31354692.
- ^ A b Kumar K, Mella-Herrera RA, Golden JW (duben 2010). „Heterocysty sinic“. Perspektivy Cold Spring Harbor v biologii. 2 (4): a000315. doi:10.1101 / cshperspect.a000315. PMC 2845205. PMID 20452939.
- ^ A b C d E Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biologie (8. vydání). Benjamin Cummings (Pearson). 186–187. ISBN 978-0-8053-6844-4.
- ^ A b C d E F G h i j k l m n Ó p q r s t u proti w X y z aa ab ac inzerát ae af ag ah ai aj ak al dopoledne an ao ap vod ar tak jako na au av aw Kim E, Archibald JM (2009). „Rozmanitost a vývoj plastidů a jejich genomů“. Ve věci Sandelius AS, Aronsson H (eds.). Chloroplast. Monografie rostlinných buněk. 13. s. 1–39. doi:10.1007/978-3-540-68696-5_1. ISBN 978-3-540-68692-7.
- ^ Bryant DA, Guglielmi G, de Marsac NT, Castets AM, Cohen-Bazire G (1979). "Struktura cyanobakteriálních phycobilisomes: model". Archiv mikrobiologie. 123 (2): 311–34. doi:10.1007 / BF00446810. S2CID 1589428.
- ^ A b C d E F G h i j k l m n Ó p q r s t u proti w X y z aa ab ac inzerát ae af Keeling PJ (říjen 2004). „Rozmanitost a evoluční historie plastidů a jejich hostitelů“. American Journal of Botany. 91 (10): 1481–93. doi:10.3732 / ajb.91.10.1481. PMID 21652304. S2CID 17522125.
- ^ A b C d McFadden GI, van Dooren GG (červenec 2004). „Evoluce: genom červených řas potvrzuje společný původ všech plastidů“. Aktuální biologie. 14 (13): R514-6. doi:10.1016 / j.cub.2004.06.041. PMID 15242632. S2CID 18131616.
- ^ A b C d E Milo R, Phillips R. „Buněčná biologie podle čísel: Jak velké jsou chloroplasty?“. book.bionumbers.org. Citováno 7. února 2017.
- ^ A b C d Sánchez-Baracaldo P, Raven JA, Pisani D, Knoll AH (září 2017). „Rané fotosyntetické eukaryoty obývané stanoviště s nízkou slaností“. Sborník Národní akademie věd Spojených států amerických. 114 (37): E7737 – E7745. doi:10.1073 / pnas.1620089114. PMC 5603991. PMID 28808007.
- ^ Fuks B, Homblé F (říjen 1996). „Mechanismus prostupu protonů lipidovými membránami chloroplastů“. Fyziologie rostlin. 112 (2): 759–66. doi:10.1104 / pp.112.2.759. PMC 158000. PMID 8883387.
- ^ Joyard J, Block MA, Douce R (srpen 1991). "Molekulární aspekty biochemie plastidového obalu". European Journal of Biochemistry. 199 (3): 489–509. doi:10.1111 / j.1432-1033.1991.tb16148.x. PMID 1868841.
- ^ „Chloroplast“. Encyclopedia of Science. Citováno 27. prosince 2012.
- ^ A b C d E F Nakayama T, Archibald JM (duben 2012). „Vyvinutí fotosyntetické organely“. Biologie BMC. 10 (1): 35. doi:10.1186/1741-7007-10-35. PMC 3337241. PMID 22531210.
- ^ A b C d E McFadden GI (leden 2001). "Původ a integrace chloroplastů". Fyziologie rostlin. 125 (1): 50–3. doi:10.1104 / pp.125.1.50. PMC 1539323. PMID 11154294.
- ^ Archibald JM (leden 2009). "Puzzle vývoje plastidů". Aktuální biologie. 19 (2): R81-8. doi:10.1016 / j.cub.2008.11.067. PMID 19174147. S2CID 51989.
- ^ Ponce-Toledo RI, Deschamps P, López-García P, Zivanovic Y, Benzerara K, Moreira D (únor 2017). „Raně se rozvětvující sladkovodní sinice na počátku plastidů“. Aktuální biologie. 27 (3): 386–391. doi:10.1016 / j.cub.2016.11.056. PMC 5650054. PMID 28132810.
- ^ de Vries J, Archibald JM (únor 2017). „Endosymbióza: Vyvinuli se plastidy ze sladkovodních sinic?“. Aktuální biologie. 27 (3): R103 – R105. doi:10.1016 / j.cub.2016.12.006. PMID 28171752.
- ^ A b López-García P, Eme L, Moreira D (prosinec 2017). „Symbióza v eukaryotické evoluci“. Journal of Theoretical Biology. 434: 20–33. doi:10.1016 / j.jtbi.2017.02.031. PMC 5638015. PMID 28254477.
- ^ Delaye L, Valadez-Cano C, Pérez-Zamorano B (březen 2016). „Jak skutečně stará je Paulinella Chromatophora?“. PLOS proudy. 8. doi:10,1371 / proudy.tol.e68a099364bb1a1e129a17b4e06b0c6b. PMC 4866557. PMID 28515968.
- ^ A b C d E F G h i j k l m n Ó p q r s t u proti w Wise RR, Hoober JK (2006). Struktura a funkce plastidů. Dordrecht: Springer. s. 3–21. ISBN 978-1-4020-4061-0.
- ^ Ball S, Colleoni C, Cenci U, Raj JN, Tirtiaux C (březen 2011). „Vývoj glykogenu a metabolismu škrobu u eukaryot dává molekulární stopy k pochopení vzniku plastidové endosymbiózy“. Journal of Experimental Botany. 62 (6): 1775–801. doi:10.1093 / jxb / erq411. PMID 21220783.
- ^ A b C d E F G h i j k l m n Ó p q r s t u proti w X y z aa ab ac inzerát ae af Keeling PJ (březen 2010). „Endosymbiotický původ, diverzifikace a osud plastidů“. Filozofické transakce Královské společnosti v Londýně. Série B, Biologické vědy. 365 (1541): 729–48. doi:10.1098 / rstb.2009.0103. PMC 2817223. PMID 20124341.
- ^ A b C d E F G Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biologie (8. vydání). Benjamin Cummings (Pearson). str. 582–92. ISBN 978-0-8053-6844-4.
- ^ "rhodo-". Svobodný slovník. Farlex. Citováno 7. června 2013.
- ^ A b Lewis LA, McCourt RM (říjen 2004). "Zelené řasy a původ suchozemských rostlin". American Journal of Botany. 91 (10): 1535–56. doi:10,3732 / ajb.91.10.1535. PMID 21652308.
- ^ Machida M, Takechi K, Sato H, Chung SJ, Kuroiwa H, Takio S a kol. (Duben 2006). „Geny pro syntézu peptidoglykanů jsou nezbytné pro dělení chloroplastů v mechu“. Sborník Národní akademie věd Spojených států amerických. 103 (17): 6753–8. Bibcode:2006PNAS..103,6753M. doi:10.1073 / pnas.0510693103. PMC 1458953. PMID 16618924.
- ^ Moroney JV, Somanchi A (leden 1999). „Jak řasy koncentrují CO2, aby zvýšily účinnost fotosyntetické fixace uhlíku?“. Fyziologie rostlin. 119 (1): 9–16. doi:10.1104 / pp.119.1.9. PMC 1539202. PMID 9880340.
- ^ Tartar A, Boucias DG (duben 2004). „Nefotosyntetická, patogenní zelená řasa Helicosporidium sp. Si uchovala modifikovaný funkční plastidový genom.“. Mikrobiologické dopisy FEMS. 233 (1): 153–7. doi:10.1016 / j.femsle.2004.02.006. PMID 15043882.
- ^ A b C d Nowack EC, Vogel H, Groth M, Grossman AR, Melkonian M, Glöckner G (leden 2011). "Endosymbiotický genový přenos a transkripční regulace přenesených genů v Paulinella chromatophora". Molekulární biologie a evoluce. 28 (1): 407–22. doi:10.1093 / molbev / msq209. PMID 20702568.
- ^ A b C d E Dann L (2002). Bioscience - vysvětleno (PDF). Zelená DNA: VYSVĚTLENÍ BIOSCIENCE.
- ^ A b C d E Clegg MT, Gaut BS, Learn GH, Morton BR (červenec 1994). „Sazby a vzorce vývoje chloroplastové DNA“. Sborník Národní akademie věd Spojených států amerických. 91 (15): 6795–801. Bibcode:1994PNAS ... 91.6795C. doi:10.1073 / pnas.91.15.6795. PMC 44285. PMID 8041699.
- ^ A b C d E F Shaw J, Lickey EB, Schilling EE, Small RL (březen 2007). „Srovnání sekvencí celého chloroplastového genomu s výběrem nekódujících oblastí pro fylogenetické studie v krytosemenných rostlinách: želva a zajíc III“. American Journal of Botany. 94 (3): 275–88. doi:10,3732 / ajb.94.3.275. PMID 21636401. S2CID 30501148.
- ^ A b Chaal BK, Green BR (únor 2005). "Proteinové cesty importu v 'komplexních' chloroplastech odvozených od sekundární endosymbiózy zahrnující předka červené řasy". Molekulární biologie rostlin. 57 (3): 333–42. doi:10.1007 / s11103-004-7848-r. PMID 15830125. S2CID 22619029.
- ^ A b Moustafa A, Beszteri B, Maier UG, Bowler C, Valentin K, Bhattacharya D (červen 2009). "Genomické stopy kryptické plastidové endosymbiózy v rozsivkách" (PDF). Věda. 324 (5935): 1724–6. Bibcode:2009Sci ... 324,1724M. doi:10.1126 / science.1172983. PMID 19556510. S2CID 11408339.
- ^ Rogers MB, Gilson PR, Su V, McFadden GI, Keeling PJ (leden 2007). „Kompletní chloroplastový genom chlorarachniofytů Bigelowiella natans: důkazy o nezávislém původu chlorarachniofytů a sekundárních endosymbiontů euglenidů“. Molekulární biologie a evoluce. 24 (1): 54–62. doi:10.1093 / molbev / msl129. PMID 16990439.
- ^ A b C d E F G h i j k l m n Hackett JD, Anderson DM, Erdner DL, Bhattacharya D (říjen 2004). „Dinoflageláty: pozoruhodný evoluční experiment“. American Journal of Botany. 91 (10): 1523–34. doi:10.3732 / ajb.91.10.1523. PMID 21652307.
- ^ Toledo RI (5. března 2018). Počátky a časný vývoj fotosyntetických eukaryot (Teze). Université Paris-Saclay.
- ^ Bodył A (únor 2018). „Vyvinuli se některé plastidy odvozené od červených řas kleptoplastidií? Hypotéza“. Biologické recenze Cambridge Philosophical Society. 93 (1): 201–222. doi:10.1111 / brv.12340. PMID 28544184. S2CID 24613863.
- ^ A b Janouškovec J, Gavelis GS, Burki F, Dinh D, Bachvaroff TR, Gornik SG a kol. (Leden 2017). „Hlavní přechody ve vývoji dinoflagelátu odhalené fylotranskripptomiky“. Sborník Národní akademie věd Spojených států amerických. 114 (2): E171 – E180. doi:10.1073 / pnas.1614842114. PMC 5240707. PMID 28028238.
- ^ A b C d Nair SC, Striepen B (srpen 2011). „Co vlastně dělají lidské parazity s chloroplasty?“. PLOS Biology. 9 (8): e1001137. doi:10.1371 / journal.pbio.1001137. PMC 3166169. PMID 21912515.
- ^ Quigg A, Kotabová E, Jarešová J, Kaňa R, Setlík J, Sedivá B a kol. (10. října 2012). „Fotosyntéza v Chromera velia představuje jednoduchý systém s vysokou účinností“. PLOS ONE. 7 (10): e47036. Bibcode:2012PLoSO ... 747036Q. doi:10.1371 / journal.pone.0047036. PMC 3468483. PMID 23071705.
- ^ Dorrell RG, Smith AG (červenec 2011). „Zčervená a zelená zhnědne?: Pohledy na akvizice plastidů v chromalveolátech“. Eukaryotická buňka. 10 (7): 856–68. doi:10.1128 / EC.00326-10. PMC 3147421. PMID 21622904.
- ^ Meeson BW, Chang SS, Sweeney BM (1982). "Charakterizace peridinin-chlorofylu a-proteinů z mořské dinoflagelátové ceratium furca". Botanica Marina. 25 (8): 347–50. doi:10,1515 / botm.1982.25.8.347. S2CID 83867103.
- ^ A b C Tengs T, Dahlberg OJ, Shalchian-Tabrizi K, Klaveness D, Rudi K, Delwiche CF, Jakobsen KS (květen 2000). „Fylogenetické analýzy naznačují, že dinoflageláty obsahující 19'Hexanoyloxy-fukoxanthin obsahují terciární plastidy haptophytového původu.“. Molekulární biologie a evoluce. 17 (5): 718–29. doi:10.1093 / oxfordjournals.molbev.a026350. PMID 10779532.
- ^ A b C Schnepf E, Elbrächter M (1999). "Chloroplasty a fylogeneze dinofytů - recenze". Grana. 38 (2–3): 81–97. doi:10.1080/00173139908559217.
- ^ Skovgaard A (1998). „Role retence chloroplastů v mořském dinoflagelátu“. Vodní mikrobiální ekologie. 15: 293–301. doi:10,3 354 / ame015293.
- ^ Dorrell RG, Howe CJ (srpen 2015). „Integrace plastidů s jejich hostiteli: Poučení z dinoflagelátů“. Sborník Národní akademie věd Spojených států amerických. 112 (33): 10247–54. Bibcode:2015PNAS..11210247D. doi:10.1073 / pnas.1421380112. PMC 4547248. PMID 25995366.
- ^ Hogan CM (2010). "Deoxyribonukleová kyselina". V Draggan S, Cleveland C (eds.). Encyklopedie Země. Washington DC: Národní rada pro vědu a životní prostředí.
- ^ "ctDNA - chloroplastová DNA". AllAcronyms.com. Archivovány od originál dne 3. června 2013. Citováno 2. ledna 2013.
- ^ Oxfordský slovník zkratek. ctDNA - definice slovníku. 1998.
- ^ „Chloroplasty a jiné plastidy“. Univerzita v Hamburku. Archivovány od originál dne 25. září 2012. Citováno 27. prosince 2012.
- ^ A b C d E F G Sandelius AS (2009). Chloroplast: Interakce s prostředím. Springer. p. 18. ISBN 978-3-540-68696-5.
- ^ A b Burgess J (1989). Úvod do vývoje rostlinných buněk. Cambridge: Cambridge univerzitní tisk. p. 62. ISBN 0-521-31611-1.
- ^ A b C d E F G Bendich AJ (červenec 2004). „Kruhové chloroplastové chromozomy: velká iluze“. Rostlinná buňka. 16 (7): 1661–6. doi:10.1105 / tpc.160771. PMC 514151. PMID 15235123.
- ^ A b C Kolodner R, Tewari KK (leden 1979). „Obrácené repetice v chloroplastové DNA z vyšších rostlin“. Sborník Národní akademie věd Spojených států amerických. 76 (1): 41–5. Bibcode:1979PNAS ... 76 ... 41K. doi:10.1073 / pnas.76.1.41. PMC 382872. PMID 16592612.
- ^ A b Palmer JD, Thompson WF (červen 1982). „Přeuspořádání DNA chloroplastů je častější, když dojde ke ztrátě velké invertované sekvence opakování“. Buňka. 29 (2): 537–50. doi:10.1016/0092-8674(82)90170-2. PMID 6288261. S2CID 11571695.
- ^ Biochemie rostlin (3. vyd.). Akademický tisk. 2005. s.517. ISBN 978-0-12-088391-2.
počet kopií ctDNA na chloroplast.
- ^ A b Kobayashi T, Takahara M, Miyagishima SY, Kuroiwa H, Sasaki N, Ohta N a kol. (Červenec 2002). „Detekce a lokalizace chloroplastem kódovaného proteinu podobného HU, který organizuje chloroplastové nukleoidy“. Rostlinná buňka. 14 (7): 1579–89. doi:10,1105 / tpc.002717. PMC 150708. PMID 12119376.
- ^ Odahara M, Kishita Y, Sekine Y (srpen 2017). "MSH1 maintains organelle genome stability and genetically interacts with RECA and RECG in the moss Physcomitrella patens". The Plant Journal. 91 (3): 455–465. doi:10.1111/tpj.13573. PMID 28407383.
- ^ Rowan BA, Oldenburg DJ, Bendich AJ (June 2010). "RecA maintains the integrity of chloroplast DNA molecules in Arabidopsis". Journal of Experimental Botany. 61 (10): 2575–88. doi:10.1093/jxb/erq088. PMC 2882256. PMID 20406785.
- ^ A b C d E F Krishnan NM, Rao BJ (May 2009). "A comparative approach to elucidate chloroplast genome replication". BMC Genomics. 10 (237): 237. doi:10.1186/1471-2164-10-237. PMC 2695485. PMID 19457260.
- ^ Heinhorst S, Cannon GC (1993). "DNA replication in chloroplasts". Journal of Cell Science. 104: 1–9.
- ^ "Effect of chemical mutagens on nucleotide sequence". Biocyclopedia. Citováno 24. října 2015.
- ^ Bernstein H, Bernstein C (July 1973). "Circular and branched circular concatenates as possible intermediates in bacteriophage T4 DNA replication". Journal of Molecular Biology. 77 (3): 355–61. doi:10.1016/0022-2836(73)90443-9. PMID 4580243.
- ^ A b Alberts B (2002). Molekulární biologie buňky (4. vyd.). New York [u.a.]: Garland. ISBN 0-8153-4072-9.
- ^ Huang CY, Ayliffe MA, Timmis JN (March 2003). "Direct measurement of the transfer rate of chloroplast DNA into the nucleus". Příroda. 422 (6927): 72–6. Bibcode:2003Natur.422...72H. doi:10.1038/nature01435. PMID 12594458. S2CID 4319507.
- ^ A b C Martin W, Rujan T, Richly E, Hansen A, Cornelsen S, Lins T, et al. (Září 2002). "Evolutionary analysis of Arabidopsis, cyanobacterial, and chloroplast genomes reveals plastid phylogeny and thousands of cyanobacterial genes in the nucleus". Sborník Národní akademie věd Spojených států amerických. 99 (19): 12246–51. Bibcode:2002PNAS...9912246M. doi:10.1073/pnas.182432999. PMC 129430. PMID 12218172.
- ^ Smith DR, Lee RW (April 2014). "A plastid without a genome: evidence from the nonphotosynthetic green algal genus Polytomella". Fyziologie rostlin. 164 (4): 1812–9. doi:10.1104/pp.113.233718. PMC 3982744. PMID 24563281.
- ^ Archibald JM (December 2006). "Algal genomics: exploring the imprint of endosymbiosis". Aktuální biologie. 16 (24): R1033-5. doi:10.1016/j.cub.2006.11.008. PMID 17174910.
- ^ Koussevitzky S, Nott A, Mockler TC, Hong F, Sachetto-Martins G, Surpin M, et al. (Květen 2007). "Signals from chloroplasts converge to regulate nuclear gene expression". Věda. 316 (5825): 715–9. Bibcode:2007Sci...316..715K. doi:10.1126/science.1140516 (inactive 6 November 2020). PMID 17395793. Shrnutí ležel – Vědec (31 March 2007).CS1 maint: DOI neaktivní od listopadu 2020 (odkaz)
- ^ Hedtke B, Börner T, Weihe A (August 1997). "Mitochondrial and chloroplast phage-type RNA polymerases in Arabidopsis". Věda. 277 (5327): 809–11. doi:10.1126/science.277.5327.809. PMID 9242608.
- ^ Harris EH, Boynton JE, Gillham NW (December 1994). "Chloroplast ribosomes and protein synthesis". Mikrobiologické recenze. 58 (4): 700–54. doi:10.1128/MMBR.58.4.700-754.1994. PMC 372988. PMID 7854253.
- ^ A b C d E F G h i j Soll J, Schleiff E (March 2004). "Protein import into chloroplasts". Nature Reviews Molecular Cell Biology. 5 (3): 198–208. doi:10.1038/nrm1333. PMID 14991000. S2CID 32453554.
- ^ Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biologie (8. vydání). Benjamin Cummings (Pearson). p. 340. ISBN 978-0-8053-6844-4.
- ^ Lung SC, Chuong SD (April 2012). "A transit peptide-like sorting signal at the C terminus directs the Bienertia sinuspersici preprotein receptor Toc159 to the chloroplast outer membrane". Rostlinná buňka. 24 (4): 1560–78. doi:10.1105/tpc.112.096248. PMC 3398564. PMID 22517318.
- ^ Waegemann K, Soll J (March 1996). "Phosphorylation of the transit sequence of chloroplast precursor proteins". The Journal of Biological Chemistry. 271 (11): 6545–54. doi:10.1074/jbc.271.11.6545. PMID 8626459.
- ^ A b May T, Soll J (January 2000). "14-3-3 proteins form a guidance complex with chloroplast precursor proteins in plants". Rostlinná buňka. 12 (1): 53–64. doi:10.1105/tpc.12.1.53. PMC 140214. PMID 10634907.
- ^ Jarvis P, Soll J (December 2001). "Toc, Tic, and chloroplast protein import". Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1541 (1–2): 64–79. doi:10.1016/S0167-4889(01)00147-1. PMID 11750663.
- ^ Wise RR, Hoober JK (2007). The Structure and Function of Plastids. Springer. s. 32–33. ISBN 978-1-4020-6570-5.
- ^ "Oedogonium Link ex Hirn, 1900: 17". algaeBASE. Citováno 19. května 2013.
- ^ "Chlamydomonas Ehrenberg, 1833: 288". algaeBASE. Citováno 19. května 2013.
- ^ "Spirogyra Link, 1820: 5". algaeBASE. Citováno 19. května 2013.
- ^ "Sirogonium Kützing, 1843: 278". algaeBASE. Citováno 19. května 2013.
- ^ "Zygnema C.Agardh, 1817: xxxii, 98". algaeBASE. Citováno 19. května 2013.
- ^ "Micrasterias C.Agardh ex Ralfs, 1848: 68". algaeBASE. Citováno 19. května 2013.
- ^ John DM, Brook AJ, Whitton BA (2002). The freshwater algal flora of the British Isles : an identification guide to freshwater and terrestrial algae. Cambridge: Cambridge University Press. p. 335. ISBN 978-0-521-77051-4.
- ^ A b C d E F G Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biologie (8. vydání). Benjamin Cummings (Pearson). pp. 196–197. ISBN 978-0-8053-6844-4.
- ^ Koike H, Yoshio M, Kashino Y, Satoh K (May 1998). "Polypeptide composition of envelopes of spinach chloroplasts: two major proteins occupy 90% of outer envelope membranes". Fyziologie rostlin a buněk. 39 (5): 526–32. doi:10.1093/oxfordjournals.pcp.a029400. PMID 9664716.
- ^ Köhler RH, Hanson MR (January 2000). "Plastid tubules of higher plants are tissue-specific and developmentally regulated". Journal of Cell Science. 113 (Pt 1): 81–9. PMID 10591627. Archivováno from the original on 20 September 2016.
- ^ Gray JC, Sullivan JA, Hibberd JM, Hansen MR (2001). "Stromules: mobile protrusions and interconnections between plastids". Biologie rostlin. 3 (3): 223–33. doi:10.1055/s-2001-15204.
- ^ Schattat M, Barton K, Baudisch B, Klösgen RB, Mathur J (April 2011). "Plastid stromule branching coincides with contiguous endoplasmic reticulum dynamics". Fyziologie rostlin. 155 (4): 1667–77. doi:10.1104/pp.110.170480. PMC 3091094. PMID 21273446.
- ^ Schattat MH, Griffiths S, Mathur N, Barton K, Wozny MR, Dunn N, et al. (April 2012). "Differential coloring reveals that plastids do not form networks for exchanging macromolecules". Rostlinná buňka. 24 (4): 1465–77. doi:10.1105/tpc.111.095398. PMC 3398557. PMID 22474180.
- ^ Brunkard JO, Runkel AM, Zambryski PC (August 2015). "Chloroplasts extend stromules independently and in response to internal redox signals". Sborník Národní akademie věd Spojených států amerických. 112 (32): 10044–9. Bibcode:2015PNAS..11210044B. doi:10.1073/pnas.1511570112. PMC 4538653. PMID 26150490.
- ^ A b C d E F G h i j Burgess J (1989). An introduction to plant cell development (Pbk. Ed.). Cambridge: Cambridge university press. p. 46. ISBN 0-521-31611-1.
- ^ A b Whatley JM (5 July 1994). "The occurrence of a peripheral reticulum in plastids of the gymnosperm Welwitschia mirabilis". Nový fytolog. 74 (2): 215–220. doi:10.1111/j.1469-8137.1975.tb02608.x.
- ^ A b C Wise RR (2007). The Structure and Function of Plastids. Springer. str. 17–18. ISBN 978-1-4020-6570-5.
- ^ Manuell AL, Quispe J, Mayfield SP (August 2007). "Structure of the chloroplast ribosome: novel domains for translation regulation". PLOS Biology. 5 (8): e209. doi:10.1371/journal.pbio.0050209. PMC 1939882. PMID 17683199.
- ^ A b Lim K, Kobayashi I, Nakai K (July 2014). "Alterations in rRNA-mRNA interaction during plastid evolution". Molekulární biologie a evoluce. 31 (7): 1728–40. doi:10.1093/molbev/msu120. PMID 24710516.
- ^ Hirose T, Sugiura M (January 2004). "Functional Shine-Dalgarno-like sequences for translational initiation of chloroplast mRNAs". Fyziologie rostlin a buněk. 45 (1): 114–7. doi:10.1093/pcp/pch002. PMID 14749493. S2CID 10774032.
- ^ Ma J, Campbell A, Karlin S (October 2002). "Correlations between Shine-Dalgarno sequences and gene features such as predicted expression levels and operon structures". Journal of Bacteriology. 184 (20): 5733–45. doi:10.1128/JB.184.20.5733-5745.2002. PMC 139613. PMID 12270832.
- ^ Lim K, Furuta Y, Kobayashi I (October 2012). "Large variations in bacterial ribosomal RNA genes". Molekulární biologie a evoluce. 29 (10): 2937–48. doi:10.1093/molbev/mss101. PMC 3457768. PMID 22446745.
- ^ A b C d E F G h i j Austin JR, Frost E, Vidi PA, Kessler F, Staehelin LA (July 2006). "Plastoglobules are lipoprotein subcompartments of the chloroplast that are permanently coupled to thylakoid membranes and contain biosynthetic enzymes". Rostlinná buňka. 18 (7): 1693–703. doi:10.1105/tpc.105.039859. PMC 1488921. PMID 16731586.
- ^ A b Crumpton-Taylor M, Grandison S, Png KM, Bushby AJ, Smith AM (February 2012). "Control of starch granule numbers in Arabidopsis chloroplasts". Fyziologie rostlin. 158 (2): 905–16. doi:10.1104/pp.111.186957. PMC 3271777. PMID 22135430.
- ^ Zeeman SC, Delatte T, Messerli G, Umhang M, Stettler M, Mettler T, Streb S, Reinhold H, Kötting O (2007). "Starch breakdown: Recent discoveries suggest distinct pathways and novel mechanisms". Funkční biologie rostlin. 34 (6): 465–73. doi:10.1071/FP06313. PMID 32689375. S2CID 15995416.
- ^ Rochaix JD (1998). The molecular biology of chloroplasts and mitochondria in Chlamydomonas. Dordrecht [u.a.]: Kluwer Acad. Publ. pp. 550–565. ISBN 978-0-7923-5174-0.
- ^ A b C d E F Gunning BE, Steer MW (1996). Plant cell biology : structure and function. Boston, Mass.: Jones and Bartlett Publishers. p.24. ISBN 0-86720-504-0.
- ^ Hanson D, Andrews TJ, Badger MR (2002). "Variability of the pyrenoid-based CO2 concentrating mechanism in hornworts (Anthocerotophyta)". Funkční biologie rostlin. 29 (3): 407–16. doi:10.1071/PP01210. PMID 32689485.
- ^ A b Ma Y, Pollock SV, Xiao Y, Cunnusamy K, Moroney JV (June 2011). "Identification of a novel gene, CIA6, required for normal pyrenoid formation in Chlamydomonas reinhardtii". Fyziologie rostlin. 156 (2): 884–96. doi:10.1104/pp.111.173922. PMC 3177283. PMID 21527423.
- ^ A b Retallack B, Butler RD (January 1970). "The development and structure of pyrenoids in Bulbochaete hiloensis". Journal of Cell Science. 6 (1): 229–41. PMID 5417694.
- ^ Brown MR, Arnott HJ (1970). "Structure and Function of the Algal Pyrenoid" (PDF). Journal of Phycology. 6: 14–22. doi:10.1111/j.1529-8817.1970.tb02350.x. S2CID 85604422. Archivovány od originál (PDF) dne 31. května 2013. Citováno 31. prosince 2012.
- ^ A b C d E F G Bussi Y; Shimoni E; Weiner A; Kapon R; Charuvi D; Nevo R; Efrati E; Reich Z (2019). "Fundamental helical geometry consolidates the plant photosynthetic membrane". Proc Natl Acad Sci USA. 116 (44): 22366–22375. doi:10.1073/pnas.1905994116. PMC 6825288. PMID 31611387.
- ^ Infanger S, Bischof S, Hiltbrunner A, Agne B, Baginsky S, Kessler F (March 2011). "The chloroplast import receptor Toc90 partially restores the accumulation of Toc159 client proteins in the Arabidopsis thaliana ppi2 mutant" (PDF). Molecular Plant. 4 (2): 252–63. doi:10.1093/mp/ssq071. PMID 21220583.
- ^ "thylakoid". Slovník Merriam-Webster. Merriam-Webster. Citováno 19. května 2013.
- ^ A b C d E F G h Mustárdy L, Buttle K, Steinbach G, Garab G (October 2008). "The three-dimensional network of the thylakoid membranes in plants: quasihelical model of the granum-stroma assembly". Rostlinná buňka. 20 (10): 2552–7. doi:10.1105/tpc.108.059147. PMC 2590735. PMID 18952780.
- ^ Paolillo Jr, DJ (1970). "The three-dimensional arrangement of intergranal lamellae in chloroplasts". J Cell Sci. 6 (1): 243–55. PMID 5417695.
- ^ Shimoni E; Rav-Hon O; Ohad I; Brumfeld V; Reich Z (2005). "Three-dimensional organization of higher-plant chloroplast thylakoid membranes revealed by electron tomography". Plant Cell. 17 (9): 2580–6. doi:10.1105/tpc.105.035030. PMC 1197436. PMID 16055630.
- ^ A b Austin JR, Staehelin LA (April 2011). "Three-dimensional architecture of grana and stroma thylakoids of higher plants as determined by electron tomography". Fyziologie rostlin. 155 (4): 1601–11. doi:10.1104/pp.110.170647. PMC 3091084. PMID 21224341.
- ^ "Chloroplast in a plant cell". TUMEGGY / SCIENCE PHOTO LIBRARY. Citováno 19. srpna 2020.
- ^ A b C Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biologie (8. vydání). Benjamin Cummings (Pearson). pp. 190–193. ISBN 978-0-8053-6844-4.
- ^ "Australian scientists discover first new chlorophyll in 60 years". University of Sydney. 20 August 2010.
- ^ A b C Takaichi S (15 June 2011). "Carotenoids in algae: distributions, biosyntheses and functions". Marine Drugs. 9 (6): 1101–18. doi:10.3390/md9061101. PMC 3131562. PMID 21747749.
- ^ Shapley D (15 October 2012). "Why Do Leaves Change Color in Fall?". News Articles. Citováno 21. května 2013.
- ^ A b Howe CJ, Barbrook AC, Nisbet RE, Lockhart PJ, Larkum AW (August 2008). "The origin of plastids". Filozofické transakce Královské společnosti v Londýně. Série B, Biologické vědy. 363 (1504): 2675–85. doi:10.1098/rstb.2008.0050. PMC 2606771. PMID 18468982.
- ^ "Introduction to the Rhodophyta". Muzeum paleontologie University of California. Citováno 20. května 2013.
- ^ A b C d E F G Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biologie (8. vydání). Benjamin Cummings (Pearson). 200–201. ISBN 978-0-8053-6844-4.
- ^ Lawton JR (March 1988). "Ultrastructure of Chloroplast Membranes in Leaves of Maize and Ryegrass as Revealed by Selective Staining Methods". Nový fytolog. 108 (3): 277–283. doi:10.1111/j.1469-8137.1988.tb04163.x. JSTOR 2433294.
- ^ Roberts K (2007). Handbook of plant science. Chichester, West Sussex, England: Wiley. p. 16. ISBN 978-0-470-05723-0.
- ^ Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biologie (8. vydání). Benjamin Cummings (Pearson). p. 742. ISBN 978-0-8053-6844-4.
- ^ A b Lawson T. and J. I. L. Morison. Essay 10.1 Guard Cell Photosynthesis. Plant Physiology and Development, Sixth Edition [1]
- ^ A b Wells, C .; Balish, E. (1979). "The mitogenic activity of lipopolysaccharide for spleen cells from germfree, conventional, and gnotobiotic rats". Canadian Journal of Microbiology. 25 (9): 1087–93. doi:10.1139/m79-166. PMID 540263.
- ^ A b C d E F G h i j k l Glynn JM, Miyagishima SY, Yoder DW, Osteryoung KW, Vitha S (May 2007). "Chloroplast division". Provoz. 8 (5): 451–61. doi:10.1111/j.1600-0854.2007.00545.x. PMID 17451550. S2CID 2808844.
- ^ A b Dong XJ, Nagai R, Takagi S (1998). "Microfilaments Anchor Chloroplasts along the Outer Periclinal Wall in Vallisneria Epidermal Cells through Cooperation of PFR and Photosynthesis". Plant and Cell Physiology. 39 (12): 1299–306. doi:10.1093/oxfordjournals.pcp.a029334.
- ^ A b C Takagi S (June 2003). "Actin-based photo-orientation movement of chloroplasts in plant cells". The Journal of Experimental Biology. 206 (Pt 12): 1963–9. doi:10.1242/jeb.00215. PMID 12756277.
- ^ Zeiger E, Talbott LD, Frechilla S, Srivastava A, Zhu J (2002). "The guard cell chloroplast: A perspective for the twenty-first century". Nový fytolog. 153 (3): 415–424. doi:10.1046/j.0028-646X.2001.NPH328.doc.x.
- ^ A b C d E F G Padmanabhan MS, Dinesh-Kumar SP (November 2010). "All hands on deck—the role of chloroplasts, endoplasmic reticulum, and the nucleus in driving plant innate immunity". Molekulární interakce rostlin a mikrobů. 23 (11): 1368–80. doi:10.1094/MPMI-05-10-0113. PMID 20923348.
- ^ Katsir L, Chung HS, Koo AJ, Howe GA (August 2008). "Jasmonate signaling: a conserved mechanism of hormone sensing". Current Opinion in Plant Biology. 11 (4): 428–35. doi:10.1016/j.pbi.2008.05.004. PMC 2560989. PMID 18583180.
- ^ Schnurr JA, Shockey JM, de Boer GJ, Browse JA (August 2002). "Fatty acid export from the chloroplast. Molecular characterization of a major plastidial acyl-coenzyme A synthetase from Arabidopsis". Fyziologie rostlin. 129 (4): 1700–9. doi:10.1104/pp.003251. PMC 166758. PMID 12177483.
- ^ A b C d Biology—Concepts and Connections. Pearson. 2009. pp. 108–118.
- ^ Campbell NA, Williamson B, Heyden RJ (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 978-0-13-250882-7.[stránka potřebná ]
- ^ Jagendorf AT, Uribe E (January 1966). "ATP formation caused by acid-base transition of spinach chloroplasts". Sborník Národní akademie věd Spojených států amerických. 55 (1): 170–7. Bibcode:1966PNAS...55..170J. doi:10.1073/pnas.55.1.170. PMC 285771. PMID 5220864.
- ^ A b Berg JM, Tymoczko JL, Stryer L (2002). Biochemie (5. ed., 4. print. ed.). New York, NY [u.a.]: W. H. Freeman. pp. Section 19.4. ISBN 0-7167-3051-0.
- ^ A b Berg JM, Tymoczko JL, Stryer L (2002). Biochemie (5. ed., 4. print. ed.). New York, NY [u.a.]: W. H. Freeman. pp. Section 20.1. ISBN 0-7167-3051-0.
- ^ A b C Wample RL, Davis RW (September 1983). "Effect of Flooding on Starch Accumulation in Chloroplasts of Sunflower (Helianthus annuus L.)". Fyziologie rostlin. 73 (1): 195–8. doi:10.1104/pp.73.1.195. PMC 1066435. PMID 16663176.
- ^ Carmi A, Shomer I (1979). "Starch Accumulation and Photosynthetic Activity in Primary Leaves of Bean (Phaseolus vulgaris L.)". Annals of Botany. 44 (4): 479–484. doi:10.1093/oxfordjournals.aob.a085756.
- ^ Berg JM, Tymoczko JL, Stryer L (2002). Biochemie (5. vydání). W H Freeman. pp. Section 19.4. Citováno 30. října 2012.
- ^ A b C Hauser M, Eichelmann H, Oja V, Heber U, Laisk A (July 1995). "Stimulation by Light of Rapid pH Regulation in the Chloroplast Stroma in Vivo as Indicated by CO2 Solubilization in Leaves". Fyziologie rostlin. 108 (3): 1059–1066. doi:10.1104/pp.108.3.1059. PMC 157457. PMID 12228527.
- ^ A b Werdan K, Heldt HW, Milovancev M (August 1975). "The role of pH in the regulation of carbon fixation in the chloroplast stroma. Studies on CO2 fixation in the light and dark". Biochimica et Biophysica Acta (BBA) - bioenergetika. 396 (2): 276–92. doi:10.1016/0005-2728(75)90041-9. PMID 239746.
- ^ A b C d E F G Burgess J (1989). An introduction to plant cell development. Cambridge: Cambridge university press. p. 56. ISBN 0-521-31611-1.
- ^ Ferro M, Salvi D, Riviere-Rolland H, Vermat T, Seigneurin-Berny D, Grunwald D, et al. (Srpen 2002). "Integral membrane proteins of the chloroplast envelope: identification and subcellular localization of new transporters". Sborník Národní akademie věd Spojených států amerických. 99 (17): 11487–92. Bibcode:2002PNAS...9911487F. doi:10.1073/pnas.172390399. PMC 123283. PMID 12177442.
- ^ A b Rolland N, Droux M, Douce R (March 1992). "Subcellular Distribution of O-Acetylserine(thiol)lyase in Cauliflower (Brassica oleracea L.) Inflorescence". Fyziologie rostlin. 98 (3): 927–35. doi:10.1104/pp.98.3.927. PMC 1080289. PMID 16668766.
- ^ Ravanel S, Gakière B, Job D, Douce R (June 1998). "The specific features of methionine biosynthesis and metabolism in plants". Sborník Národní akademie věd Spojených států amerických. 95 (13): 7805–12. Bibcode:1998PNAS...95.7805R. doi:10.1073/pnas.95.13.7805. PMC 22764. PMID 9636232.
- ^ A b C d E Buchanan BB, Gruissem W, Jones RL (Eds.). 2015. Biochemistry & Molecular Biology of Plants. Wiley Blackwell.
- ^ Joyard J, Ferro M, Masselon C, Seigneurin-Berny D, Salvi D, Garin J, Rolland N (April 2010). "Chloroplast proteomics highlights the subcellular compartmentation of lipid metabolism". Pokrok ve výzkumu lipidů. 49 (2): 128–58. doi:10.1016/j.plipres.2009.10.003. PMID 19879895.
- ^ Proudlove MO, Thurman DA (1981). "The uptake of 2‐oxoglutarate and pyruvate by isolated pea chloroplasts". Nový fytolog. 88 (2): 255–264. doi:10.1111/j.1469-8137.1981.tb01722.x.
- ^ Bao X, Focke M, Pollard M, Ohlrogge J. 2000. Understanding in vivo carbon precursor supply for fatty acid synthesis in leaf tissue. Plant Journal 22, 39–50.
- ^ Ohlrogge J, Browse J (1995). "Lipid Biosynthesis". Rostlinná buňka. 7 (7): 957–970. doi:10.1105/tpc.7.7.957. PMC 160893. PMID 7640528.
- ^ Gunning BE, Steer MW (1996). Plant cell biology : structure and function. Boston, Mass.: Jones and Bartlett Publishers. p.20. ISBN 0-86720-504-0.
- ^ A b C d E Burgess J (1989). An introduction to plant cell development (Pbk. Ed.). Cambridge: Cambridge university press. str. 54–55. ISBN 0-521-31611-1.
- ^ Burgess J (1989). An introduction to plant cell development (Pbk. Ed.). Cambridge: Cambridge university press. p. 57. ISBN 0-521-31611-1.
- ^ A b Possingham JV, Rose RJ (1976). "Chloroplast Replication and Chloroplast DNA Synthesis in Spinach Leaves". Sborník Královské společnosti B: Biologické vědy. 193 (1112): 295–305. Bibcode:1976RSPSB.193..295P. doi:10.1098/rspb.1976.0047. S2CID 2691108.
- ^ Cannon GC, Heinhorst S (1 January 1993). "DNA replication in chloroplasts". Journal of Cell Science. 104 (1): 1–9. CiteSeerX 10.1.1.1026.3732.
- ^ A b C d E F G h i Miyagishima SY, Nishida K, Mori T, Matsuzaki M, Higashiyama T, Kuroiwa H, Kuroiwa T (March 2003). "A plant-specific dynamin-related protein forms a ring at the chloroplast division site". Rostlinná buňka. 15 (3): 655–65. doi:10.1105/tpc.009373. PMC 150020. PMID 12615939.
- ^ A b Hashimoto H, Possingham JV (April 1989). "Effect of light on the chloroplast division cycle and DNA synthesis in cultured leaf discs of spinach". Fyziologie rostlin. 89 (4): 1178–83. doi:10.1104/pp.89.4.1178. PMC 1055993. PMID 16666681.
- ^ A b C d Hansen AK, Escobar LK, Gilbert LE, Jansen RK (January 2007). "Paternal, maternal, and biparental inheritance of the chloroplast genome in Passiflora (Passifloraceae): implications for phylogenetic studies" (PDF). American Journal of Botany. 94 (1): 42–6. doi:10.3732/ajb.94.1.42. PMID 21642206.
- ^ Birky CW (December 1995). "Uniparental inheritance of mitochondrial and chloroplast genes: mechanisms and evolution". Sborník Národní akademie věd Spojených států amerických. 92 (25): 11331–8. Bibcode:1995PNAS...9211331B. doi:10.1073/pnas.92.25.11331. PMC 40394. PMID 8524780.
- ^ Powell W, Morgante M, McDevitt R, Vendramin GG, Rafalski JA (August 1995). "Polymorphic simple sequence repeat regions in chloroplast genomes: applications to the population genetics of pines". Sborník Národní akademie věd Spojených států amerických. 92 (17): 7759–63. Bibcode:1995PNAS...92.7759P. doi:10.1073/pnas.92.17.7759. PMC 41225. PMID 7644491.
In the pines, the chloroplast genome is transmitted through pollen
- ^ Stegemann S, Hartmann S, Ruf S, Bock R (July 2003). "High-frequency gene transfer from the chloroplast genome to the nucleus". Sborník Národní akademie věd Spojených států amerických. 100 (15): 8828–33. Bibcode:2003PNAS..100.8828S. doi:10.1073/pnas.1430924100. PMC 166398. PMID 12817081.
- ^ A b Ruf S, Karcher D, Bock R (April 2007). "Determining the transgene containment level provided by chloroplast transformation". Sborník Národní akademie věd Spojených států amerických. 104 (17): 6998–7002. Bibcode:2007PNAS..104.6998R. doi:10.1073/pnas.0700008104. PMC 1849964. PMID 17420459.
externí odkazy
- Chloroplast – Cell Centered Database
- Clegg MT, Gaut BS, Learn GH, Morton BR (July 1994). "Rates and patterns of chloroplast DNA evolution". Sborník Národní akademie věd Spojených států amerických. 91 (15): 6795–801. Bibcode:1994PNAS...91.6795C. doi:10.1073/pnas.91.15.6795. PMC 44285. PMID 8041699.
- Co-Extra research on chloroplast transformation
- NCBI full chloroplast genome





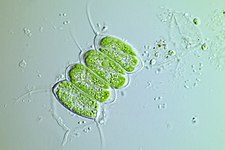
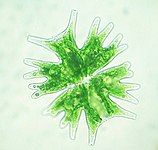






![Většina chloroplastů v rostlinných buňkách a všechny chloroplasty v řasách vznikají dělením chloroplastů. [170] Obrázkové odkazy, [143] [174]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Chloroplast_division.svg/800px-Chloroplast_division.svg.png)

