Model lipidové dvojvrstvy - Model lipid bilayer
A modelová lipidová dvojvrstva je jakýkoli dvouvrstvá sestaven in vitro, na rozdíl od dvojvrstvy přírodního buněčné membrány nebo pokrývající různé subcelulární struktury, jako je jádro. Používají se ke studiu základních vlastností biologických membrán ve zjednodušeném a dobře kontrolovaném prostředí a stále častěji zdola nahoru syntetická biologie pro stavbu umělé buňky.[1] Model dvojvrstvy může být vyroben ze syntetického nebo přírodního materiálu lipidy. Nejjednodušší modelové systémy obsahují pouze jeden čistý syntetický lipid. Fyziologicky relevantnější modelové dvojvrstvy lze připravit ze směsí několika syntetických nebo přírodních lipidů.
Existuje mnoho různých typů modelových dvojvrstev, z nichž každá má experimentální výhody a nevýhody. Prvním vyvinutým systémem byla černá lipidová membrána nebo „lakovaná“ dvojvrstva, která umožňuje jednoduchou elektrickou charakterizaci dvojvrstev, ale je krátkodobá a je obtížné s ní pracovat. Podporované dvojvrstvy jsou ukotveny k pevnému podkladu, což zvyšuje stabilitu a umožňuje použití charakterizační nástroje není možné v hromadném řešení. Tyto výhody přicházejí za cenu nežádoucích interakcí substrátu, které mohou denaturovat membránové proteiny.
Černé lipidové membrány (BLM)
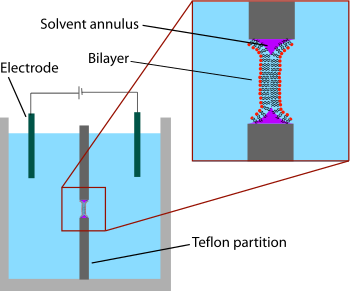
Nejstarším vyvinutým dvojvrstvým systémem byla „malovaná“ dvojvrstva, známá také jako „černá lipidová membrána“. Termín „malovaný“ označuje proces, při kterém jsou tyto dvojvrstvy vyráběny. Nejprve je vytvořen malý otvor v tenké vrstvě hydrofobního materiálu, jako je Teflon. Průměr tohoto otvoru je obvykle několik desítek mikrometrů až stovek mikrometrů. Pro vytvoření BLM je oblast kolem otvoru nejprve „předem natřena“ roztokem lipidů rozpuštěných v hydrofobní rozpouštědlo aplikací tohoto roztoku přes otvor štětcem, stříkačkou nebo skleněným aplikátorem.[2] Použité rozpouštědlo musí mít velmi vysokou hodnotu rozdělovací koeficient a musí být relativně viskózní, aby se zabránilo okamžitému prasknutí. Nejběžnějším používaným rozpouštědlem je směs dekan a skvalen.
Po ponechání otvoru uschnout se přidá solný roztok (vodná fáze) na obě strany komory. Clona je poté „natřena“ lipidovým roztokem (obecně stejným roztokem, jaký byl použit pro předbarvení). Lipidová monovrstva se spontánně tvoří na rozhraní mezi organickou a vodnou fází na obou stranách kapky lipid / rozpouštědlo. Protože stěny otvoru jsou hydrofobní, roztok lipidů / rozpouštědel smáčí toto rozhraní a ředí kapku ve středu. Jakmile se obě strany kapičky dostanou dostatečně blízko k sobě, lipidové monovrstvy se spojí, čímž se rychle vyloučí malý zbývající objem roztoku. V tomto bodě se ve středu otvoru vytvoří dvojvrstva, ale na obvodu zůstane významné mezikruží rozpouštědla. Tento prstenec je nutný k udržení stability tím, že působí jako můstek mezi ~ 5 nm dvojvrstvou a deskami mikrometrů tlustých desek, ve kterých je vytvořen otvor.[3]
Termín „černá“ dvojvrstva označuje skutečnost, že jsou tmavé v odraženém světle, protože tloušťka membrány je jen několik nanometrů, takže světlo odrážející se od zadní strany destruktivně zasahuje se světlem odrážejícím se od přední strany. Ve skutečnosti to byla jedna z prvních stop, že tato technika vytvořila membránu o tloušťce v molekulárním měřítku.[4] Černé lipidové membrány jsou také dobře vhodné pro elektrickou charakterizaci, protože obě komory oddělené dvojvrstvou jsou obě přístupné, což umožňuje jednoduché umístění velkých elektrod. Z tohoto důvodu je elektrická charakterizace jednou z nejdůležitějších metod používaných ve spojení s malovanými lipidovými dvojvrstvy. Jednoduchá měření ukazují, kdy se vytvoří dvojvrstva a kdy se rozbije, protože neporušená dvojvrstva má velký odpor (> GΩ) a velkou kapacitu (~ 2 µF / cm2). Pokročilejší elektrická charakterizace byla zvláště důležitá při studiu napěťově řízené iontové kanály. Membránové proteiny jako např iontové kanály obvykle nelze začlenit přímo do natřené dvojvrstvy během tvorby, protože ponoření do organického rozpouštědla by denaturovalo protein. Místo toho je protein solubilizován a čisticí prostředek a přidá se do vodného roztoku po vytvoření dvojvrstvy. Povlak detergentu umožňuje, aby se tyto proteiny samy samy vložily do dvojvrstvy po dobu několika minut. Dále byly provedeny počáteční experimenty, které kombinují elektrofyziologické a strukturní vyšetření membrán černých lipidů.[5] V další variantě BLM techniky, nazývané dvouvrstvý razník, se jako elektroda na jedné straně dvojvrstvy používá skleněná pipeta (vnitřní průměr ~ 10 - 40 um), aby se izolovala malá skvrna membrány.[6][7] Tato úprava svorka Tato technika umožňuje záznam nízkého šumu, a to i při vysokém potenciálu (až 600 mV), na úkor dodatečné doby přípravy.
Hlavní problémy spojené s malovanými dvojvrstvy jsou zbytkové rozpouštědlo a omezená životnost. Někteří vědci se domnívají, že kapsy rozpouštědla zachycené mezi dvěma dvojvrstvými letáky mohou narušit normální funkci bílkovin. K překonání tohoto omezení vyvinuli Montal a Mueller modifikovanou depoziční techniku, která vylučuje použití těžkého netěkavého rozpouštědla. U této metody začíná otvor nad vodní hladinou a zcela odděluje dvě tekutinové komory. Na povrchu každé komory se vytvoří jednovrstvá vrstva nanesením lipidů v těkavém rozpouštědle, jako je např chloroform a čeká na odpaření rozpouštědla. Otvor se poté spustí přes rozhraní vzduch-voda a dvě monovrstvy ze samostatných komor se sklopí dolů proti sobě a vytvoří dvojvrstvu přes otvor.[8] Ukázalo se, že je obtížnější vyřešit problém stability. Černá lipidová membrána obvykle přežije méně než hodinu, což vylučuje dlouhodobé experimenty. Tuto životnost lze prodloužit přesnou strukturou podpůrné clony,[9] chemickým zesítěním lipidů nebo gelovatěním okolního roztoku za účelem mechanické podpory dvojvrstvy.[10] V této oblasti stále probíhají práce a bude možné dosáhnout životnosti několika hodin.
Podporované lipidové dvojvrstvy (SLB)
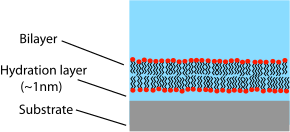
Na rozdíl od vezikuly nebo buněčné membrány, ve které je lipidová dvojvrstva svinuta do uzavřené skořápky, je podporovaná dvojvrstva rovinnou strukturou sedící na pevné podložce. Z tohoto důvodu je volnému roztoku vystavena pouze horní strana dvojvrstvy. Toto uspořádání má výhody a nevýhody spojené se studiem lipidových dvojvrstev. Jednou z největších výhod podporované dvojvrstvy je její stabilita. SLB zůstanou do značné míry neporušené, i když jsou vystaveny vysokým průtokům nebo vibracím, a na rozdíl od černých lipidových membrán přítomnost otvorů nezničí celou dvojvrstvu. Kvůli této stabilitě jsou možné experimenty trvající týdny a dokonce měsíce s podporovanými dvojvrstvy, zatímco experimenty BLM jsou obvykle omezeny na hodiny.[11] Další výhodou podporované dvojvrstvy je, že protože je na plochém tvrdém povrchu, je přístupná řadě charakterizačních nástrojů, které by byly nemožné nebo by nabídly nižší rozlišení, pokud by byly provedeny na volně plovoucím vzorku.
Jedním z nejjasnějších příkladů této výhody je použití mechanických sondovacích technik, které vyžadují přímou fyzickou interakci se vzorkem. Mikroskopie atomové síly (AFM) byl použit k zobrazení lipidů fázová separace,[12] tvorba transmembránových nanoporů následovaná adsorpcí jedné molekuly proteinu,[13] a sestavení bílkovin[14] s přesností pod nm bez potřeby značkovacího barviva. Více nedávno, AFM byl také použit k přímému sondování mechanické vlastnosti jednotlivých dvojvrstev[15] a provést silovou spektroskopii na jednotlivých membránových proteinech.[16] Tyto studie by byly obtížné nebo nemožné bez použití podporovaných dvojvrstev, protože povrch buňky nebo váčku je relativně měkký a časem by se unášel a kolísal. Dalším příkladem fyzické sondy je použití mikrováhy z křemenného krystalu (QCM) ke studiu kinetiky vazby na povrchu dvojvrstvy.[17] Duální polarizační interferometrie je optický nástroj s vysokým rozlišením pro charakterizaci řádu a narušení lipidových dvojvrstev během interakcí nebo fázových přechodů poskytujících doplňková data k měření QCM.[18]
Mnoho moderních technik fluorescenční mikroskopie také vyžaduje pevně podložený rovinný povrch. Evanescentní pole metody jako fluorescenční mikroskopie s vnitřním odrazem (TIRF) a povrchová plazmonová rezonance (SPR) může nabídnout extrémně citlivé měření vazby analytu a dvojvrstvých optických vlastností, ale může fungovat pouze tehdy, když je vzorek podporován na specializovaných opticky funkčních materiálech. Další třídou metod použitelných pouze na podporované dvojvrstvy jsou metody založené na optické interferenci, jako je fluorescenční interferenční kontrastní mikroskopie (FLIC) a reflexní interferenční kontrastní mikroskopie (RICM) nebo interferometrická rozptylová mikroskopie (iSCAT). Když je dvojvrstva podepřena na odrazné ploše, lze k výpočtu polohy fluoroforů uvnitř dvojvrstvy použít odchylky intenzity způsobené destruktivním rušením z tohoto rozhraní.[19] Evanescentní i interferenční techniky nabízejí rozlišení vlnové délky pouze v jedné dimenzi (z nebo vertikální). V mnoha případech je toto rozlišení vše, co je potřeba. Koneckonců, dvojvrstvy jsou velmi malé pouze v jedné dimenzi. Boční vrstva může být prodloužena o mnoho mikrometrů nebo dokonce milimetrů. Ale určité jevy, jako je přeskupení dynamické fáze, se vyskytují v dvojvrstevách na laterálním měřítku délky pod mikrometry. Slibný přístup ke studiu těchto struktur je optická mikroskopie skenující blízké pole (NSOM).[20] Stejně jako AFM i NSOM spoléhá na skenování mikroobráběcího hrotu, aby poskytl vysoce lokalizovaný signál. Ale na rozdíl od AFM, NSOM používá spíše optickou než fyzickou interakci se vzorkem, což potenciálně narušuje jemné struktury v menší míře.
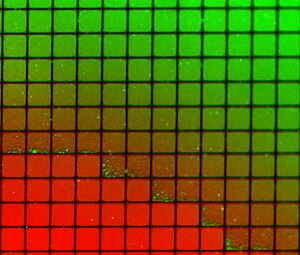
Další důležitou schopností podporovaných dvojvrstev je schopnost vzorovat povrch tak, aby produkoval více izolovaných oblastí na stejném substrátu. Tento jev byl poprvé demonstrován pomocí škrábanců nebo kovových „ohrad“, aby se zabránilo smíchání mezi sousedními oblastmi a přitom se umožnila volná difúze v kterékoli oblasti.[21][22] Pozdější práce rozšířila tento koncept o integraci mikrofluidika prokázat, že ve dvojvrstevách lze vytvořit stabilní gradienty složení,[23] potenciálně umožňující masivně paralelní studie fázové segregace, molekulární vazby a buněčné odpovědi na umělé lipidové membrány. Kreativní využití konceptu ohrady také umožnilo studium dynamické reorganizace membránových proteinů na synaptický rozhraní.[24]
Jedním z primárních omezení podporovaných dvojvrstev je možnost nežádoucích interakcí se substrátem. Přestože se podporované dvojvrstvy obecně přímo nedotýkají povrchu substrátu, jsou odděleny pouze velmi tenkou vodní mezerou. Velikost a povaha této mezery závisí na materiálu podkladu[25] a lipidové druhy, ale obecně je přibližně 1 nm zwitterionický lipidy podporovány na oxid křemičitý, nejběžnější experimentální systém.[26][27] Protože je tato vrstva tak tenká, dochází k rozsáhlé hydrodynamické vazbě mezi dvojvrstvou a substrátem, což má za následek nižší difúzní koeficient v podporovaných dvojvrstvách než u volných dvojvrstev stejného složení.[28] Určité procento podporované dvojvrstvy bude také zcela nepohyblivé, i když přesná povaha a důvod těchto „připevněných“ stránek je stále nejistá. U vysoce kvalitních dvojvrstev s podporou kapalné fáze je imobilní frakce obvykle kolem 1–5%. Pro kvantifikaci difúzního koeficientu a mobilní frakce budou výzkumníci studující podporované dvojvrstvy často uvádět zprávy FRAP data.
Nežádoucí interakce se substrátem jsou mnohem větším problémem při začlenění integrálních membránových proteinů, zejména těch s velkými doménami, které trčí za jádro dvojvrstvy. Protože mezera mezi dvojvrstvou a substrátem je tak tenká, tyto proteiny se často stanou denaturovaný na povrchu podkladu, a proto ztratí veškerou funkčnost.[29] Jedním z přístupů k obcházení tohoto problému je použití dvojvrstev vázaných na polymer. V těchto systémech je dvojvrstva nesena na volné síti hydratovaných polymerů nebo hydrogel který funguje jako mezerník a teoreticky brání denaturačním interakcím substrátu.[30] V praxi určité procento proteinů stále ztratí mobilitu a funkčnost, pravděpodobně kvůli interakcím s polymerními / lipidovými kotvami.[28] Výzkum v této oblasti pokračuje.
Uvázané dvouvrstvé lipidové membrány (t-BLM)
Použití vázané dvojvrstvé lipidové membrány (t-BLM) dále zvyšuje stabilitu podporovaných membrán chemickým kotvením lipidů k pevnému substrátu.[31]

Zlato lze použít jako substrát díky své inertní chemii a thiolipidům pro kovalentní vazbu na zlato. Thiolipidy se skládají z lipidových derivátů, rozšířených na svých polárních hlavových skupinách hydrofilními rozpěrkami, které končí v thiol nebo disulfid skupina, která tvoří kovalentní vazbu se zlatem a tvoří se samostatně sestavené monovrstvy (SAM).
Omezení intra-membránové mobility podporovaných lipidových dvojvrstev lze překonat zavedením polovičních membránových tetherových lipidů[32] s benzyldisulfidem (DPL) a syntetickými analogy archea, plné membrány překlenující lipidy s fytanolovými řetězci ke stabilizaci struktury a polyethylenglykolové jednotky jako hydrofilní spacer. Tvorby dvojvrstvy se dosáhne vystavením lipidem potaženého zlatého substrátu lipidům vnější vrstvy buď v ethanolovém roztoku nebo v liposomech.[33]
Výhodou tohoto přístupu je, že kvůli hydrofilnímu prostoru kolem 4 nm je interakce se substrátem minimální a další prostor umožňuje zavedení proteinových iontových kanálů do dvojvrstvy. Distanční vrstva navíc vytváří iontový rezervoár[34] který snadno umožňuje stříd elektrická impedance měření přes dvojvrstvu.
Vezikuly
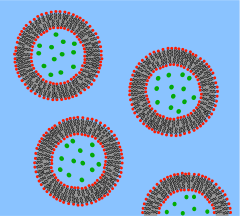
Vezikul je lipidová dvojvrstva srolovaná do sférické skořápky, která obklopuje malé množství vody a odděluje ji od vody mimo vezikul. Kvůli této základní podobnosti s buněčnou membránou se vezikuly značně používají ke studiu vlastností lipidových dvojvrstev. Dalším důvodem, proč se vezikuly používají tak často, je to, že se dají relativně snadno vyrobit. Pokud je vzorek dehydratovaného lipidu vystaven vodě, spontánně vytvoří vezikuly.[35] Tyto počáteční vezikuly jsou obvykle multilamelární (mnohostěnné) a mají širokou škálu velikostí od desítek nanometrů až po několik mikrometrů.[36] K rozbití těchto počátečních vezikul na menší jednostěnné vezikuly stejného průměru, známé jako malé unilamelární vezikuly (SUV), jsou zapotřebí metody, jako je použití ultrazvuku nebo vytlačování přes membránu. SUV obvykle mají průměry mezi 50 a 200 nm.[37] Alternativně je možné syntetické vezikuly jednoduše izolovat z buněčných kultur nebo vzorků tkání.[38] Vezikuly se používají k transportu lipidů, proteinů a mnoha dalších molekul v buňce i do nebo z buňky. Tyto přirozeně izolované vezikuly jsou složeny ze složité směsi různých lipidů a proteinů, takže i když nabízejí větší realismus pro studium konkrétních biologických jevů, jsou pro studium základních lipidových vlastností preferovány jednoduché umělé vezikuly.
Vzhledem k tomu, že umělá SUV lze vyrábět ve velkém množství, jsou vhodná pro studium sypkých materiálů, jako je rentgenová difrakce určit rozteč mřížek[39] a diferenciální skenovací kalorimetrie k určení fázových přechodů.[40] Duální polarizační interferometrie může měřit unilamelar a multilamelar struktury a inzerce do a narušení vezikul ve formátu bez štítku testu.[41] Vezikuly lze také označit fluorescenčními barvivy, aby byly citlivé FRET -na základě fúze testy.[42] I přes toto fluorescenční značení je často obtížné provádět podrobné zobrazování na SUV jednoduše proto, že jsou tak malé. V boji proti tomuto problému vědci vyvinuli obří unilamelární vezikul (GUV). GUV jsou dostatečně velké (několik desítek mikrometrů) pro studium s tradiční fluorescenční mikroskopií. Mnoho studií lipidové rafty v umělých lipidových systémech byly z tohoto důvodu provedeny s GUV.[43] Ve srovnání s podporovanými dvojvrstvy představují GUV „přirozenější“ prostředí, protože v blízkosti není žádný pevný povrch, který by indukoval defekty nebo denaturoval proteiny. GUV jsou však relativně křehké, časově náročné a ve srovnání s SUV je lze vyrábět pouze s omezeným výnosem. Aby se tyto problémy obešly, byl hlášen přístup mikrofluidní montážní linky k GUV.[44] Alternativně lze SUV a jejich přechod do dvojvrstvy na pevné podložce vizualizovat pomocí interferometrická rozptylová mikroskopie (iSCAT).[45] Tato technika také umožňuje detekovat mikro- a nanodomény bez štítků.[46]
Dvojvrstvy rozhraní s kapičkami
Droplet Interface Bilayers (DIB) jsou kapičky obalené fosfolipidy, které tvoří dvojvrstvy, když jsou uvedeny do kontaktu.[47][48] Kapičky jsou obklopeny olejem a fosfolipidy jsou rozptýleny buď ve vodě nebo v oleji.[47] Výsledkem je, že fosfolipidy spontánně tvoří monovrstvu na každém z rozhraní olej-voda.[47] DIB mohou být vytvořeny tak, aby vytvářely materiál podobný tkáni se schopností tvořit asymetrické dvojvrstvy, rekonstituovat proteiny a proteinové kanály nebo být vytvořeny pro použití při studiu elektrofyziologie.[49][50][51][52][53] Rozšířené sítě DIB lze vytvářet buď využitím kapičkových mikrofluidních zařízení nebo pomocí kapičkových tiskáren.[54][55]
Micely, bicely a nanodisky
Čisticí prostředek micely [56] jsou další třídou modelových membrán, které se běžně používají k čištění a studiu membránové proteiny, ačkoli jim chybí lipidová dvojvrstva. Ve vodných roztocích jsou micely sestavy amfipatický molekuly s hydrofilními hlavami vystavenými rozpouštědlu a jejich hydrofobními ocasy ve středu. Micely mohou solubilizovat membránové proteiny tak, že je částečně zapouzdřují a chrání své hydrofobní povrchy před rozpouštědlem.
Bicely jsou příbuzná třída modelové membrány,[57] je obvykle vyroben ze dvou lipidů, z nichž jeden tvoří lipidovou dvojvrstvu, zatímco druhý tvoří amfipatickou, micelární sestavu, která chrání střed dvouvrstvy před okolními molekulami rozpouštědla. Bicely lze považovat za segment dvojvrstvy zapouzdřený a solubilizovaný micelou. Bicely jsou mnohem menší než liposomy, a lze je tedy použít v experimentech, jako jsou NMR spektroskopie, kde větší vezikuly nejsou volbou.
Nanodisky [58] se skládají spíše ze segmentu dvouvrstvy zapouzdřeného amfipatickým proteinovým potahem než z lipidové nebo detergentní vrstvy. Nanodisky jsou stabilnější než bicely a micely při nízkých koncentracích a jsou velmi dobře definované co do velikosti (v závislosti na typu proteinového obalu mezi 10 a 20 nm ). Membránové proteiny zabudované do a solubilizované Nanodiskem mohou být studovány širokou škálou biofyzikálních technik.[59][60]
Reference
- ^ Salehi-Reyhani, Ali; Ces, Oscar; Elani, Yuval (2017). „Umělé napodobeniny buněk jako zjednodušené modely pro studium buněčné biologie“. Experimentální biologie a medicína. 242 (13): 1309–1317. doi:10.1177/1535370217711441. PMC 5528198. PMID 28580796.
- ^ Mueller, P; Rudin, DO; Tien, H I; Wescott, W C (1962). "Rekonstituce buněčné membránové struktury in vitro a její transformace do dráždivého systému". Příroda. 194 (4832): 979–980. Bibcode:1962Natur.194..979M. doi:10.1038 / 194979a0. PMID 14476933.
- ^ White, SH (1972). „Analýza torusu obklopujícího rovinné lipidové dvojvrstevné membrány“. Biofyzikální deník. 12 (4): 432–445. Bibcode:1972 BpJ .... 12..432 W.. doi:10.1016 / s0006-3495 (72) 86095-8. PMC 1484121. PMID 5019479.
- ^ Tien, H T; Carbone, S; Dawidowicz, EA (1966). „Tvorba„ černých “lipidových membrán oxidačními produkty cholesterolu“. Příroda. 212 (5063): 718–719. Bibcode:1966Natur.212..718T. doi:10.1038 / 212718a0.
- ^ Beerlink, A; Mell, M; Tolkiehn, M; Salditt, T (2009). „Tvrdé rentgenové fázové kontrastní zobrazování černých lipidových membrán“. Aplikovaná fyzikální písmena. 95 (20): 203703. Bibcode:2009ApPhL..95t3703B. doi:10.1063/1.3263946.
- ^ Andersen, OS (1983). „Pohyb iontů kanály Gramicidin A: Měření v jednom kanálu při velmi vysokých potenciálech“. Biofyzikální deník. 41 (2): 119–133. Bibcode:1983BpJ .... 41..119A. doi:10.1016 / S0006-3495 (83) 84414-2. PMC 1329161. PMID 6188500.
- ^ Ingolfson, H; Kapoor, R; Collingwood, SA; Andersen, S O (2008). „Metody jedné molekuly pro monitorování změn v vlastnostech dvojvrstevných elastických materiálů“. Žurnál vizualizovaných experimentů. 21 (21): e1032. doi:10.3791/1032. PMC 2954507. PMID 19066527.
- ^ M Montal a P Mueller. "Tvorba bimolekulárních membrán z lipidových monovrstev a studie jejich elektrických vlastností." Sborník Národní akademie věd Spojených států amerických 1972; 69 3561-3566.
- ^ A Beerlink, PJ Wilbrandt, E Ziegler, D Carbone, TH Metzger a T. Salditt. „Rentgenová strukturní analýza volně stojících lipidových membrán usnadněných mikromechanickými aperturami.“ „Langmuire 2008; 24 4952-4958.
- ^ N Malmstadt, T J. Jeon a J. J. Schmidt. „Dlouhověké planární lipidové dvouvrstvé membrány kotvené k polymernímu hydrogelu in situ.“ Pokročilé materiály 2007; 20 84-89.
- ^ Purrucker, O; Hillebrandt, H; Adlkofer, K; Tanaka, M (2001). "Depozice vysoce rezistentní lipidové dvojvrstvy na elektrodě křemíku a oxidu křemičitého a začlenění gramicidinu studováno pomocí AC impedanční spektroskopie". Electrochimica Acta. 47 (5): 791–798. doi:10.1016 / s0013-4686 (01) 00759-9.
- ^ Lin, W C; Blanchette, C D; Ratto, T V; Longo, M L (2006). „Lipidová asymetrie v DLPC / DSPC podporovaných lipidových dvojvrstvách: Kombinovaná studie AFM a fluorescenční mikroskopie“. Biofyzikální deník. 90 (1): 228–237. Bibcode:2006BpJ .... 90..228L. doi:10.1529 / biophysj.105.067066. PMC 1367021. PMID 16214871.
- ^ Roiter, Y .; Ornatska, M .; Rammohan, A. R .; Balakrishnan, J .; Heine, D. R .; Minko, S. (2008). "Interakce nanočástic s lipidovou membránou". Nano dopisy. 8 (3): 941–944. Bibcode:2008 NanoL ... 8..941R. doi:10.1021 / nl080080l. PMID 18254602.
- ^ Engel a D J Muller. "Pozorování jednotlivých biomolekul při práci s mikroskopem atomové síly." Přírodní strukturní biologie 7. (2000)
- ^ Steltenkamp, S; Muller, M M; Deserno, M; Hennesthal, C; Steinem, C; Janshoff, A (2006). „Mechanické vlastnosti porézních lipidových dvojvrstev sondovaných mikroskopem atomové síly“. Biofyzikální deník. 91 (1): 217–226. Bibcode:2006BpJ .... 91..217S. doi:10.1529 / biophysj.106.081398. PMC 1479081. PMID 16617084.
- ^ Oesterhelt, F; Oesterhelt, D; Pfeiffer, M; Engel, A; Gaub, HE; Mueller, D J (2000). "Rozvíjející se cesty jednotlivých bakteriorhodopsinů". Věda. 288 (5463): 143–146. Bibcode:2000Sci ... 288..143O. doi:10.1126 / science.288.5463.143. PMID 10753119.
- ^ Y Ebara a Y Okahata. „Kinetická studie konkanavalinu vázajícího se na glykolipidové monovrstvy pomocí mikrováhy s křemenným krystalem.“ Journal of the American Chemical Society 1994; 116 11209-11212.
- ^ Mashaghi; et al. (2008). "Optická anizotropie podporovaných lipidových struktur sondovaných vlnovodovou spektroskopií a její aplikace ke studiu kinetiky tvorby podporované lipidové dvojvrstvy". Anální. Chem. 80 (10): 3666–3676. doi:10.1021 / ac800027s. PMID 18422336.
- ^ J M Crane, V Kiessling a L K Tamm. "Měření lipidové asymetrie v rovinných dvojvrstvách pomocí fluorescenční interferenční kontrastní mikroskopie." Langmuir. 21. (2005) 1377–1388.
- ^ Hollars, C W; Dunn, R C (1998). „Submikronová struktura v l - dipalmitoylfosfatidylcholinové monovrstvy a dvojvrstvy sondované pomocí konfokální, atomové síly a mikroskopie blízkého pole“. Biofyzikální deník. 75 (1): 342–353. Bibcode:1998 BpJ .... 75..342H. doi:10.1016 / s0006-3495 (98) 77518-6. PMC 1299703. PMID 9649391.
- ^ J. T. Groves, N. Ulman a S. G. Boxer. "Mikropropínací tekuté lipidové dvojvrstvy na pevných podpěrách." Věda 1997; 275 651-3.
- ^ Groves, J. T.; Ulman, NU; Cremer, PS; Bilayer Membrane, Fluid (1998). "Interakce substrát - membrána: Mechanismy pro ukládání vzorů na membránu s dvojitou vrstvou tekutiny". Langmuir. 14 (12): 3347–50. doi:10.1021 / la9711701.
- ^ Kam, L; Boxer, SG (2003). „Prostorově selektivní manipulace s podporovanými lipidovými dvojvrstvy pomocí laminárního toku: kroky k biomembránové mikrofluidice“. Langmuir. 19 (5): 1624–1631. doi:10.1021 / la0263413.
- ^ Parthasarathy, R; Jackson, B L; Lowery, T J; Wong, AP; Groves, J. T. (2004). "Nerovnovážné vzory adheze na spojích lipidové dvojvrstvy". Journal of Physical Chemistry B. 108 (2): 649–57. doi:10.1021 / jp035543k.
- ^ Mager, MD; Almquist, BA; Melosh, NA (2008). "Tvorba a charakterizace tekutých lipidových dvojvrstev na oxidu hlinitém". Langmuir. 24 (22): 12734–12737. doi:10.1021 / la802726u. PMID 18942863.
- ^ Koenig, BW; Kruger, S; Orts, WJ; Majkrzak, CF; Berk, N.F .; et al. (1996). „Neutronová odrazivost a mikroskopické studie atomové síly lipidové dvojvrstvy ve vodě adsorbované na povrch monokrystalu křemíku“. Langmuir. 12 (5): 1343–1350. doi:10.1021 / la950580r.
- ^ SJ Johnson, T. M. Bayerl, D. C. McDermott, G. W. Adam a kol. "Struktura adsorbované dimyristoylfosfatidylcholinové dvojvrstvy měřená zrcadlovým odrazem neutronů." Biofyzikální deník. 59. (1991) 289-94.
- ^ A b Kuhner, M; Tampe, R; Sackmann, E (1994). „Lipidová mono- a dvojvrstva na polymerních filmech: Kompozitní polymer-lipidové filmy na pevných podkladech“. Biofyzikální deník. 67 (1): 217–226. Bibcode:1994BpJ .... 67..217K. doi:10.1016 / s0006-3495 (94) 80472-2. PMC 1225352. PMID 7918990.
- ^ Castellana, ET; Cremer, PS (2006). „Tuhé podporované lipidové dvojvrstvy: Od biofyzikálních studií k designu senzorů“. Zprávy o povrchových vědách. 61 (10): 429–444. Bibcode:2006SurSR..61..429C. doi:10.1016 / j.surfrep.2006.06.001. PMC 7114318. PMID 32287559.
- ^ Wong, JY; Park, CK; Seitz, M; Israelachvili, J (1999). „Polymerem odpružené dvojvrstvy. II. Vyšetřování interakčních sil a fúze pomocí aparátu povrchových sil“. Biofyzikální deník. 77 (3): 1458–68. Bibcode:1999 BpJ .... 77,1458 W.. doi:10.1016 / s0006-3495 (99) 76993-6. PMC 1300433. PMID 10465756.
- ^ Naumann R, Jonczyk A, Kopp R, v.Esch J, Ringsdorf H, Knoll W, Gräber P; Jonczyk; Kopp; Van Esch; Ringsdorf; Pahorek; Gräber (1995). „Inkorporace membránových proteinů do lipidových vrstev s pevnou podporou“. Angew. Chem. 34 (18): 2056–2058. doi:10.1002 / anie.199520561.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Cornell B, Braach-Maksvytis V, král L, Osman P, Raguse B, Wieczorek L, Pace R; Braach-Maksvytis; Král; Osman; Raguse; Wieczorek; Pace (1997). "Biosenzor, který používá přepínače iontových kanálů". Příroda. 387 (6633): 580–3. Bibcode:1997 Natur.387..580C. doi:10.1038/42432. PMID 9177344.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Lang H, Duschl C, Vogel H; Duschl; Vogel (1994). "Nová třída thiolipidů pro připojení lipidových dvojvrstev na zlaté povrchy". Langmuir. 10: 197–210. doi:10.1021 / la00013a029.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Cornell B, Krishna G, Osman P a kol. (2001). „Vázané dvouvrstvé lipidové membrány jako podpora membránově aktivních peptidů“. Transakce s biochemickou společností. 29 (Pt 4): 613–617. doi:10.1042 / BST0290613. PMID 11498038.
- ^ A D Bangham a R W Horne. "Negativní barvení fosfolipidů a jejich strukturní modifikace povrchově aktivními látkami, jak bylo pozorováno v elektronovém mikroskopu." Journal of Molecular Biology. 8. (1964) 660-668.
- ^ D D Lasic. "Mechanismus tvorby vezikul." Biochemical Journal. 256. (1988) 1-11.
- ^ F Szoka a D Papahadjopoulos. "Srovnávací vlastnosti a metody přípravy lipidových vezikul (liposomů)." Roční přehled biofyziky a bioinženýrství. 9. (1980) 467-508.
- ^ W S Trimble, D M Cowan a R H Scheller. "VAMP-1: synaptický vezikulární asociovaný integrální membránový protein." Sborník Národní akademie věd Spojených států amerických. 85. (1988) 4538-4542.
- ^ D Papahadjapoulos a N Miller. "Fosfolipidové membrány modelu I. Strukturální charakteristiky hydratovaných kapalných krystalů." Biochimica et Biophysica Acta. 135. (1967) 624-638.
- ^ H. Trauble a D. H. Haynes. "Změna objemu lipidových dvouvrstvých lamel při přechodu krystalické kapalné krystalické fáze." Chem. Phys. Lipidy. 7. (1971) 324-335.
- ^ J. Popplewell, M. Swann, N. Freeman, C. McDonnell a R. Ford, „Kvantifikace účinků melitinu na liposomy“. Biochimica et Biophysica Acta (2007) 1768 13-20
- ^ L. Guohua a R. C. Macdonald. "Fúze vezikul lipidové dvouvrstvy: Meziprodukty zachycené vysokorychlostní mikrofluorescenční spektroskopií." Biofyzikální deník. 85. (2003) 1585–1599.
- ^ C Dietrich, LA Bagatolli, Z N Volovyk, N L Thompson a kol. "Lipidové rafty rekonstituované v modelových membránách." Biofyzikální deník. 80. (2001) 1417–1428.
- ^ Matosevic, S .; Paegel, B. http://pubs.acs.org/doi/abs/10.1021/ja109137s
- ^ Andrecka, J., Spillane, K. M., Ortega-Arroyo, J. & Kukura, P. Přímé pozorování a kontrola tvorby podporované lipidové dvojvrstvy s interferometrickou rozptylovou mikroskopií. ACS nano (2013)
- ^ de Wit, G., Danial, J. S., Kukura, P. & Wallace, M. I. Dynamické zobrazování lipidových nanodomén bez štítků. PNAS (2015)
- ^ A b C Bayley, Hagan; Cronin, Brid; Heron, Andrew; Holden, Matthew A .; Hwang, William L .; Syeda, Ruhma; Thompson, James; Wallace, Mark (2008-11-14). "Dvojvrstvy rozhraní s droplety". Molekulární biosystémy. 4 (12): 1191–208. doi:10.1039 / b808893d. ISSN 1742-2051. PMC 2763081. PMID 19396383.
- ^ Funakoshi, Kei; Suzuki, Hiroaki; Takeuchi, Shoji (01.12.2006). "Tvorba lipidové dvojvrstvy kontaktováním monovrstev v mikrofluidním zařízení pro analýzu membránových proteinů". Analytická chemie. 78 (24): 8169–8174. doi:10.1021 / ac0613479. ISSN 0003-2700. PMID 17165804.
- ^ Hwang, William L .; Chen, Min; Cronin, Bríd; Holden, Matthew A .; Bayley, Hagan (01.05.2008). Msgstr "Asymetrické dvojvrstvy rozhraní s kapičkami". Journal of the American Chemical Society. 130 (18): 5878–5879. doi:10.1021 / ja802089s. ISSN 0002-7863. PMID 18407631.
- ^ Leptihn, Sebastian; Thompson, James R .; Ellory, J. Clive; Tucker, Stephen J .; Wallace, Mark I. (2011-06-22). "Rekonstituce eukaryotických iontových kanálů in vitro pomocí dvojvrstev rozhraní kapiček". Journal of the American Chemical Society. 133 (24): 9370–9375. doi:10.1021 / ja200128n. ISSN 0002-7863. PMID 21591742.
- ^ Najem, Joseph S .; Dunlap, Myles D .; Rowe, Ian D .; Freeman, Eric C .; Grant, John W .; Sukharev, Sergej; Leo, Donald J. (08.09.2015). "Aktivace bakteriálního kanálu MscL v mechanicky stimulovaných dvojvrstvách s kapičkovým rozhraním". Vědecké zprávy. 5: 13726. Bibcode:2015NatSR ... 513726N. doi:10.1038 / srep13726. ISSN 2045-2322. PMC 4562232. PMID 26348441.
- ^ Gross, Linda C. M .; Heron, Andrew J .; Baca, Sylvan C .; Wallace, Mark I. (06.12.2011). "Stanovení kapacity membrány dynamickým řízením oblasti dvojvrstvy rozhraní kapiček". Langmuir. 27 (23): 14335–14342. doi:10.1021 / la203081v. ISSN 0743-7463. PMID 21978255.
- ^ Villar, Gabriel; Graham, Alexander D .; Bayley, Hagan (04.04.2013). „Tkáňový materiál“. Věda. 340 (6128): 48–52. Bibcode:2013Sci ... 340 ... 48V. doi:10.1126 / science.1229495. ISSN 0036-8075. PMC 3750497. PMID 23559243.
- ^ Villar, Gabriel; Graham, Alexander D .; Bayley, Hagan (04.04.2013). „Tkáňový materiál“. Věda. 340 (6128): 48–52. Bibcode:2013Sci ... 340 ... 48V. doi:10.1126 / science.1229495. ISSN 0036-8075. PMC 3750497. PMID 23559243.
- ^ Restrepo Schild, Vanessa; Booth, Michael J .; Box, Stuart J .; Olof, Sam N .; Mahendran, Kozhinjampara R .; Bayley, Hagan (2017-04-18). "Generování proudu podle světelného vzoru v poli kapiček s dvojitou vrstvou". Vědecké zprávy. 7: 46585. Bibcode:2017NatSR ... 746585R. doi:10.1038 / srep46585. ISSN 2045-2322. PMC 5394532. PMID 28417964.
- ^ A M Seddon, P Curnow, P J Booth. „Membránové proteiny, lipidy a detergenty: nejen mýdlová opera.“ Biochim Biophys Acta. 2004 3. listopadu; 1666 (1-2): 105-17
- ^ Cavagnero, Silvia; Dyson, H. Jane; Wright, Peter E. (duben 1999). "Vylepšený bicellový systém s nízkým pH pro orientaci makromolekul v širokém teplotním rozmezí". J Biomol NMR. 13 (4): 387–91. doi:10.1023 / a: 1008360022444. PMID 10353198.
- ^ Ritchie, TK; et al. (2009). Rekonstituce membránových proteinů ve fosfolipidových dvouvrstvých nanodiscích. Metody Enzymol. Metody v enzymologii. 464. 211–31. doi:10.1016 / s0076-6879 (09) 64011-8. ISBN 9780123749697. PMC 4196316. PMID 19903557.
- ^ Roos, C; Kai, L; Haberstock, S; Proverbio, D; Ghoshdastider, U; Smět; Filipek, S; Wang, X; Dötsch, V; Bernhard, F (2014). „Vysoká úroveň bezbuněčné produkce membránových proteinů s nanodisky“. Bezbuněčná syntéza proteinů. Metody v molekulární biologii. 1118. 109–30. doi:10.1007/978-1-62703-782-2_7. ISBN 978-1-62703-781-5. PMID 24395412.
- ^ Roos, C; Kai, L; Proverbio, D; Ghoshdastider, U; Filipek, S; Dötsch, V; Bernhard, F (2013). "Ko-translační asociace bezbuněčných exprimovaných membránových proteinů s dodanými lipidovými dvojvrstvy". Molekulární membránová biologie. 30 (1): 75–89. doi:10.3109/09687688.2012.693212. PMID 22716775.
