Evoluční historie rostlin - Evolutionary history of plants


The vývoj z rostliny má za následek širokou škálu složitosti, od nejranějšího řasové rohože, prostřednictvím mnohobuněčných mořských a sladkovodních zelené řasy, pozemské mechorosty, lykožruti a kapradiny, do komplexu gymnospermy a krytosemenné rostliny dneška. Zatímco mnoha z prvních skupin se nadále daří, jak dokládá Červené a zelené řasy v mořském prostředí, nověji odvozené skupiny vytlačily dříve ekologicky dominantní skupiny, např. vzestup kvetoucích rostlin nad gymnospermy v suchozemském prostředí.[6]:498
Existují důkazy, že sinice a mnohobuněčné fotosyntetické eukaryoty žily ve sladkovodních komunitách na pevnině již před 1 miliardou let,[7] a že společenství složitých mnohobuněčných fotosyntetizujících organismů existovala na pevnině později Precambrian, kolem 850 před miliony let.[8]
Důkazy o vzniku embryofyt suchozemské rostliny se poprvé vyskytují v polovině ordoviku (~470 před miliony let), a uprostřed devonu (~390 před miliony let), bylo přítomno mnoho funkcí rozpoznaných v dnešních suchozemských rostlinách, včetně kořenů a listů. Pozdní devon (~370 před miliony let) některé volně se vyskytující rostliny jako např Archaeopteris měl sekundární vaskulární tkáň který produkoval dřevo a vytvořil lesy vysokých stromů. Také pozdním devonem, Elkinsia, brzy semenná kapradina, se vyvinuly semena.[9] Po zbytek roku pokračovaly evoluční inovace Phanerozoic eon a stále pokračuje dodnes. Většina skupin rostlin byla relativně nezraněná Událost vyhynutí permotriasu, ačkoli se struktury komunit změnily. To mohlo připravit půdu pro vzhled kvetoucích rostlin v Trias (~200 před miliony let) a jejich pozdější diverzifikace v křídě a Paleogen. Poslední významnou skupinou rostlin, které se vyvinuly, byly trávy, který se stal důležitým v polovině paleogenu, z okolí 40 před miliony let. Trávy, stejně jako mnoho dalších skupin, vyvinuly nové mechanismy metabolismu, aby přežily minimum CO
2 a teplé a suché podmínky tropů za poslední 10 miliony let.
Kolonizace půdy
Pozemní rostliny se vyvinuly ze skupiny zelené řasy, možná již 850 let,[8] ale rostliny podobné řasám se mohly vyvinout již před 1 miliardou let.[7] Nejbližší žijící příbuzní suchozemských rostlin jsou charofyty konkrétně Charales; za předpokladu, že se zvyk Charalesů od rozchodu linií málo změnil, znamená to, že se suchozemské rostliny vyvinuly z rozvětvené vláknité řasy obydlené v mělké sladké vodě,[10] možná na okraji sezónně vysychajících bazénů.[11] Některé nedávné důkazy však naznačují, že suchozemské rostliny mohly pocházet z jednobuněčné suchozemské půdy charofyty podobně jako existující Klebsormidiophyceae.[12] Řasa by měla haplontický životní cyklus. Bylo by to jen velmi krátce spárováno chromozomy (dále jen diploidní podmínka), když vejce a spermie nejprve fúzovaný za vzniku a zygota to by se okamžitě dělilo redukční dělení buněk k produkci buněk s polovičním počtem nepárových chromozomů ( haploidní stav). Kooperativní interakce s houby možná pomohly raným rostlinám přizpůsobit se stresům pozemské říše.[13]


Rostliny nebyly prvními fotosyntetizátory na zemi. Míra zvětrávání naznačuje, že na zemi již žily organismy schopné fotosyntézy 1,200 před miliony let,[11] a mikrobiální fosilie byly nalezeny ve sladkovodních jezerních ložiscích z 1,000 před miliony let,[14] ale záznam izotopu uhlíku naznačuje, že byly příliš vzácné na to, aby ovlivnily složení atmosféry až do doby 850 před miliony let.[8] Tyto organismy, i když jsou fylogeneticky rozmanité,[15] byly pravděpodobně malé a jednoduché a tvořily něco víc než řasovou spodinu.[11]
Důkazy nejdříve suchozemské rostliny se vyskytuje mnohem později, asi 470 Ma, v nižších středních ordovických skalách ze Saúdské Arábie[16] a Gondwana[17] ve formě spor se stěnami odolnými proti rozpadu. Tyto spory, známé jako kryptospory, byly vyráběny buď jednotlivě (monády), ve dvojicích (dyády) nebo ve skupinách po čtyřech (tetrády) a jejich mikrostruktura se podobá moderní jaterník spory, což naznačuje, že sdílejí ekvivalentní stupeň organizace.[18] Jejich stěny obsahují sporopollenin - další důkaz embryofytní afinity.[19] Je možné, že atmosférická „otrava“ zabránila eukaryotům v kolonizaci země před tím,[20] nebo to mohlo jednoduše trvat dlouho, než se vyvinula nezbytná složitost.[21]
Trilete spory podobné těm z cévnatých rostlin brzy poté se objeví v horních ordovických skalách asi před 455 miliony let.[22][23] Podle toho, kdy přesně se tetrada rozdělí, může každá ze čtyř spór nést „značku trilety“, tvar Y, odrážející body, ve kterých každá buňka svírala proti sousedům.[24] To však vyžaduje, aby stěny spór byly v rané fázi pevné a odolné. Tato odolnost je úzce spojena s vnější stěnou odolnou proti vysychání - vlastnost, která se používá pouze tehdy, když musí spóry přežít z vody. Vlastně i ty embryofyty kteří se vrátili do vody, postrádají odolnou zeď, takže nenesou stopy po triletech.[24] Pečlivé prozkoumání spór řas ukazuje, že žádné spóry trilete nemají, buď proto, že jejich stěny nejsou dostatečně odolné, nebo v těch vzácných případech, kdy ano, se spory rozptýlí dříve, než jsou dostatečně rozmačkané, aby se vytvořila značka, nebo se do nich nevejdou čtyřboký tetrad.[24]
Nejstarší megafosílie suchozemských rostlin byly thalloid organismy, které sídlí ve fluviálních mokřadech a je zjištěno, že pokrývaly většinu z nich brzy silurian niva. Mohli přežít jen tehdy, když byla země podmáčená.[25] Byly tam také mikrobiální rohože.[26]
Jakmile rostliny dosáhly země, existovaly dva přístupy k řešení vysychání. Moderní mechorosty se mu buď vyhýbají, nebo mu ustupují, omezují svůj rozsah na vlhké prostředí nebo vysychají a „zadržují“ svůj metabolismus, dokud nedorazí více vody, jako u rodu játrovek Targionia. Tracheofyty odolávat vysychání kontrolou rychlosti ztráty vody. Všechny nesou vodotěsný vnější povrch pokožka vrstvu kdekoli jsou vystaveny vzduchu (stejně jako některé mechorosty), aby se snížily ztráty vody, ale protože by je celková vrstva odřízla od CO
2 v atmosféře používají tracheofyty proměnlivé otvory, průduchy, k regulaci rychlosti výměny plynu. Tracheofyty také vyvinuly vaskulární tkáň, aby napomáhaly pohybu vody v organismech (viz níže ) a vzdálil se od životního cyklu ovládaného gametofytem (viz níže ). Cévní tkáň nakonec také usnadnila vzpřímený růst bez podpory vody a připravila půdu pro vývoj větších rostlin na zemi.
A sněhová koule Země Předpokládá se, že od asi 850 do 630 let byly způsobeny časnými fotosyntetickými organismy, které snižovaly koncentraci oxidu uhličitého a zvyšovaly množství kyslíku v atmosféře.[27] Zřízení pozemské flóry zvýšilo rychlost akumulace kyslíku v atmosféře, protože suchozemské rostliny produkovaly kyslík jako odpadní produkt. Když tato koncentrace vzrostla nad 13%,[když? ] požáry byly možné, což je patrné z uhlí ve fosilním záznamu.[28] Kromě kontroverzní mezery v pozdním devonu je od té doby přítomno dřevěné uhlí.
Charcoalification je důležitý taphonomický režimu. Požár nebo pohřeb v horkém sopečném popelu odhání těkavé sloučeniny a zůstane jen zbytek čistého uhlíku. Nejedná se o životaschopný zdroj potravy pro houby, býložravce nebo detritovory, takže je náchylný ke konzervaci. Je také robustní, takže vydrží tlak a zobrazí vynikající, někdy subcelulární podrobnosti.
Vývoj životních cyklů

Všechny mnohobuněčné rostliny mají životní cyklus zahrnující dvě generace nebo fáze. The gametofyt fáze má jednu sadu chromozomů (označeno1n) a produkuje gamety (spermie a vajíčka). The sporofyt fáze má spárované chromozomy (označené2n) a produkuje spory. Fáze gametofytů a sporofytů mohou být homomorfní a v některých řasách, jako např Ulva lactuca, ale jsou velmi odlišné ve všech moderních suchozemských rostlinách, což je stav známý jako heteromorfie.
Vzorem v evoluci rostlin byl posun od homomorfie k heteromorfii. Předci řas suchozemských rostlin byli téměř jistí haplobiontický, kteří jsou haploidní po všechny své životní cykly, jednobuněčnou zygotu zajišťující 2N fázi. Všechny suchozemské rostliny (tj. embryofyty ) jsou diplobiontic - to znamená, že haploidní i diploidní fáze jsou mnohobuněčné.[6] Jsou patrné dva trendy: mechorosty (játrovky, mechy a hornworts ) vyvinuli gametofyt jako dominantní fázi životního cyklu, přičemž sporofyt je od něj téměř zcela závislý; cévnatých rostlin vyvinuli sporofyt jako dominantní fázi, přičemž gametofyty jsou zvláště sníženy v semenné rostliny.
Bylo navrženo, že základem pro vznik diploidní fáze životního cyklu jako dominantní fáze je to, že diploidie umožňuje maskování exprese škodlivých mutací prostřednictvím genetická komplementace.[29][30] Pokud tedy jeden z rodičovských genomů v diploidních buňkách obsahuje mutace vedoucí k vadám u jednoho nebo více genové produkty, tyto nedostatky by mohly být kompenzovány jiným rodičovským genomem (který však může mít své vlastní defekty v jiných genech). Vzhledem k tomu, že diploidní fáze začala převládat, efekt maskování pravděpodobně umožňoval velikost genomu, a tedy i informačního obsahu, ke zvýšení, aniž by bylo nutné zvyšovat přesnost replikace. Možnost zvýšit informační obsah za nízkou cenu je výhodná, protože umožňuje kódování nových úprav. Tento pohled byl zpochybněn a důkazy ukazují, že výběr není u haploidů účinnější než v diploidních fázích životního cyklu mechů a krytosemenných rostlin.[31]
Existují dvě konkurenční teorie, které vysvětlují vzhled diplobiontického životního cyklu.
The teorie interpolace (také známá jako antitetická nebo interkalární teorie)[32] tvrdí, že interpolace mnohobuněčné fáze sporofytů mezi dvěma po sobě jdoucími generacemi gametofytů byla inovací způsobenou předchozí meiózou u čerstvě vyklíčené zygoty s jedním nebo více cykly mitotického dělení, čímž se vytvořila nějaká diploidní mnohobuněčná tkáň, než konečně meioza produkovala spory. Tato teorie naznačuje, že první sporofyty měly velmi odlišnou a jednodušší morfologii než gametofyty, na kterých závisely.[32] Zdá se, že to dobře zapadá do toho, co je známo o mechorostech, ve kterých vegetativní thalloidní gametofyt vyživuje jednoduchý sporofyt, který se skládá z něčeho více než nerozvětveného sporangia na stonku. Zvyšující se složitost rodově jednoduchého sporofytu, včetně případného získávání fotosyntetických buněk, by jej zbavilo závislosti na gametofytu, jak je vidět u některých hornworts (Anthoceros ), a nakonec vyústit ve vývoj sporofytů orgánů a cévní tkáně a stát se dominantní fází, jako v tracheofytech (cévnatých rostlinách).[6] Tuto teorii lze podpořit pozorováním, které je menší Cooksonia jednotlivci musí být podporováni generací gametofytů. Pozorovaný výskyt větších axiálních velikostí, s prostorem pro fotosyntetickou tkáň, a tedy se soběstačností, poskytuje možnou cestu pro vývoj soběstačné fáze sporofytů.[32]
Alternativní hypotéza, zvaná teorie transformace (nebo homologní teorie) předpokládá, že sporofyt se mohl objevit náhle oddálením výskytu meiózy, dokud se nevytvořil plně vyvinutý mnohobuněčný sporofyt. Protože stejný genetický materiál by byl použit jak v haploidní, tak v diploidní fázi, vypadaly by stejně. To vysvětluje chování některých řas, jako např Ulva lactuca, které produkují střídavé fáze identických sporofytů a gametofytů. Následná adaptace na vysoušecí půdní prostředí, která znesnadňuje pohlavní rozmnožování, mohla vést k zjednodušení sexuálně aktivního gametofytu a vypracování fáze sporofytů, aby se vodotěsné spory lépe rozptýlily.[6] Tkáň sporofytů a gametofytů cévnatých rostlin, jako jsou Rhynia uchovaný v Rhynieho rohovci má podobnou složitost, která je přijata na podporu této hypotézy.[32][33][34] Naproti tomu s výjimkou Psilotum moderní vaskulární rostliny mají heteromorfní sporofyty a gametofyty, ve kterých gametofyty zřídka mají jakoukoli vaskulární tkáň.[35]
Vývoj anatomie rostlin
Arbuskulární mykorhizní symbióza
Neexistují žádné důkazy o tom, že by rané suchozemské rostliny siluru a raného devonu měly kořeny, ačkoli fosilní důkazy o rhizoidech se vyskytují u několika druhů, například Horneophyton. Nejstarší suchozemské rostliny neměly ani cévní systémy pro transport vody a živin. Aglaophyton, kořenová cévnatá rostlina známá z devonských fosilií v Rhynie chert[36] byla první suchozemská rostlina, u které bylo zjištěno symbiotický vztah s houbami [37] který se vytvořil arbuskulární mykorhizy, doslovně „kořenové houby podobné stromům“, v dobře definovaném válci buněk (prsten v průřezu) v kůře stonků. Houby se živily rostlinnými cukry výměnou za živiny generované nebo extrahované z půdy (zejména fosfáty), ke kterým by rostlina jinak neměla přístup. Stejně jako jiné kořenové suchozemské rostliny siluru a raného devonu Aglaophyton se při získávání vody a živin z půdy mohli spoléhat na arbuskulární mykorhizní houby.
Houby byly z kmene Glomeromycota,[38] skupina, která se pravděpodobně poprvé objevila před 1 miliardou let a dodnes tvoří arbuskulární mykorhizní asociace se všemi hlavními skupinami suchozemských rostlin od mechorostů po pteridofyty, gymnospermy a krytosemenné rostliny a s více než 80% cévnatých rostlin.[39]
Důkazy z analýzy sekvence DNA naznačují, že arbuskulární mykorhizní mutualizmus vznikl u společného předka těchto skupin suchozemských rostlin během jejich přechodu k zemi[40] a možná to byl dokonce kritický krok, který jim umožnil kolonizovat zemi.[41] Mykorhizní houby, které se objevily tak, jak se objevily dříve, než se u těchto rostlin vyvinuly kořeny, pomohly rostlinám při získávání vody a minerálních živin, jako jsou fosfor výměnou za organické sloučeniny, které samy nedokázaly syntetizovat.[39] Tyto houby zvyšují produktivitu i jednoduchých rostlin, jako jsou játrovky.[42][43]
Kutikula, průduchy a mezibuněčné prostory
K fotosyntéze musí rostliny absorbovat CO
2 z atmosféry. Zpřístupnění tkání pro CO
2 vstup umožňuje odpařování vody, takže to má svou cenu.[44] Voda se ztrácí mnohem rychleji než CO
2 je absorbován, takže rostliny jej musí vyměnit. Rané suchozemské rostliny přepravovaly vodu apoplasticky uvnitř porézních stěn jejich buněk. Později se vyvinuly tři anatomické rysy, které poskytly schopnost kontrolovat nevyhnutelné ztráty vody, které doprovázely CO
2 získávání. Nejprve vodotěsný vnější obal nebo pokožka se vyvinul, což snížilo ztráty vody. Zadruhé, proměnné clony, průduchy které by se mohly otevírat a zavírat, aby regulovaly množství vody ztracené odpařováním během CO
2 absorpce a za třetí mezibuněčný prostor mezi fotosyntetickými parenchymovými buňkami, který umožnil lepší vnitřní distribuci CO
2 k chloroplastům. Tento třídílný systém poskytoval vylepšenou homoiohydrii, regulaci obsahu vody ve tkáních, což poskytuje zvláštní výhodu, když přívod vody není konstantní. [45] Výška CO
2 koncentrace siluru a raného devonu, kdy rostliny nejprve kolonizovaly půdu, znamenaly, že vodu využívaly relativně efektivně. Tak jako CO
2 byl stažen z atmosféry rostlinami, více vody se ztratilo při jeho zachycení a vyvinuly se elegantnější mechanismy získávání a dopravy vody.[44] Rostliny rostoucí do vzduchu potřebovaly systém pro dopravu vody z půdy do všech různých částí nadzemní rostliny, zejména do fotosyntetických částí. Na konci karbonu, když CO
2 koncentrace byly sníženy na něco, co se blíží dnešnímu stavu, asi 17krát více vody bylo ztraceno na jednotku CO
2 absorpce.[44] Avšak i v „lehkých“ počátcích byla voda vždycky prémiová a musela být transportována do částí rostliny z mokré půdy, aby se zabránilo vysychání.[45]
Voda může být zlá kapilární akce podél látky s malými mezerami. V úzkých sloupcích vody, jako jsou ty uvnitř buněčných stěn rostlin nebo v tracheidech, když se molekuly odpařují z jednoho konce, táhnou molekuly za sebou podél kanálů. Samotné odpařování proto poskytuje hnací sílu pro transport vody v rostlinách.[44] Bez speciálních dopravních plavidel to však je kohezní napětí Mechanismus může způsobit negativní tlaky dostatečné ke zhroucení vodivých buněk, což omezuje transportní vodu na ne více než několik cm, a proto omezuje velikost prvních rostlin.[44]

Xylem
Osvobodit se omezeními malé velikosti a stálé vlhkosti, které parenchymatický způsobený dopravní systém, rostliny potřebovaly efektivnější vodní dopravní systém. Jak rostly rostliny, specializovaná vodní doprava cévní tkáně se vyvinuly, nejprve ve formě jednoduchých hydroidy typu nalezeného v štětinách sporofytů mechu. Tyto jednoduché podlouhlé buňky byly v dospělosti mrtvé a naplněné vodou, což poskytovalo kanál pro vodní dopravu, ale jejich tenké nevyztužené stěny by se pod mírným vodním napětím zhroutily, což by omezovalo výšku rostliny. Xylem tracheidy, širší buňky s lignin -zesílené buněčné stěny, které byly odolnější vůči kolapsu pod napětím způsobeným vodním stresem, vyskytují se ve více než jedné skupině rostlin v polovině siluru a mohou mít jediný evoluční původ, pravděpodobně v hornworts,[46] spojující všechny tracheofyty. Alternativně se mohly vyvinout více než jednou.[44] Mnohem později, v křídě, následovaly tracheidy plavidla v kvetoucí rostliny.[44] Jak se vyvíjely vodní transportní mechanismy a vodotěsné kůžičky, rostliny mohly přežít, aniž by byly neustále pokryty vodním filmem. Tento přechod z poikilohydry na homoiohydry otevřela nový potenciál pro kolonizaci.[44][45]
Rané devonské pretracheofyty Aglaophyton a Horneophyton mají nevyztužené vodní dopravní trubky se strukturami stěn velmi podobnými mechovým hydroidům, ale rostly vedle několika druhů tracheofyty, jako Rhynia gwynne-vaughanii který měl xylemové tracheidy, které byly dobře vyztuženy ligninovými pásy. Nejdříve makrofosílie, o nichž je známo, že mají xylemové tracheidy, jsou malé, středně silurské rostliny rodu Cooksonia.[47] Od počátku siluru jsou však patrné zesílené pásy na stěnách izolovaných fragmentů trubek.[48]
Rostliny pokračovaly v inovaci způsobů snižování odporu proti proudění v jejich buňkách, postupného zvyšování účinnosti jejich vodního transportu a zvyšování odolnosti tracheidů před kolapsem pod napětím.[49][50] Během raného devonu se maximální průměr tracheid s časem zvětšoval, ale mohl se v plošině udržet zosterofyly do poloviny devonu.[49] Celková rychlost transportu také závisí na celkové průřezové ploše samotného xylemového svazku a některé středně devonské rostliny, jako například Trimerophytes, měly mnohem větší stély než jejich raní předkové.[49] Zatímco širší tracheidy zajišťovaly vyšší rychlost transportu vody, zvyšovaly riziko kavitace, tvorby vzduchových bublin v důsledku rozbití vodního sloupce pod napětím.[44] Malé jámy ve stěnách tracheidu umožňují vodě obejít vadný tracheid a zabránit průchodu vzduchových bublin[44] ale za cenu omezeného průtoku. Uhlíkem se vyvinul Gymnosperms ohraničené jámy,[51][52] ventilové struktury, které umožňují utěsnění důlků s vysokou vodivostí, když je jedna strana tracheidu odtlakovaná.
Tracheidy mají perforované koncové stěny, které kladou velký odpor proudění vody,[49] ale mohlo mít tu výhodu, že izolovalo vzduchové embolie způsobené kavitací nebo zamrznutím. Plavidla se nejprve vyvinula během sucha, nízko CO
2 období pozdního permu, v přesličkách, kapradinách a Selaginellales nezávisle na sobě a později se objevil ve střední křídě v gnetofytech a krytosemenných rostlinách.[44] Členy plavidla jsou otevřené trubky bez koncových stěn a jsou uspořádány jeden od druhého, aby fungovaly, jako by to byla jedna spojitá nádoba.[49] Plavidla umožňovala stejnou průřezovou plochu dřeva přepravovat mnohem více vody než tracheidy. [44] To umožnilo rostlinám naplnit více jejich stonků strukturálními vlákna a také otevřel nový výklenek pro vinnou révu, která mohla přepravovat vodu, aniž by byla tak silná jako strom, na kterém rostly.[44] Navzdory těmto výhodám je dřevo na bázi tracheidu mnohem lehčí, a proto je levnější, protože nádoby je třeba mnohem více vyztužovat, aby se zabránilo kavitaci.[44] Jakmile rostliny vyvinuly tuto úroveň kontroly nad odpařováním a transportem vody, byly skutečně homoiohydric, kteří jsou schopni extrahovat vodu ze svého prostředí kořenovými orgány, spíše než se spoléhat na film povrchové vlhkosti, což jim umožňuje růst do mnohem větší velikosti[45][44] ale v důsledku jejich zvýšené nezávislosti na svém okolí ztratila většina cévnatých rostlin schopnost přežít vysušení - což je nákladná vlastnost, kterou je třeba ztratit.[44] U raných suchozemských rostlin byla podpora poskytována hlavně tlakem turgoru, zejména vnější vrstvy buněk známých jako sterome tracheidy, a nikoli xylem, který byl příliš malý, příliš slabý a v příliš centrální poloze, aby poskytoval velkou strukturální podporu .[44] Rostliny s sekundární xylem které se objevily v polovině devonu, jako například Trimerofyty a Progymnospermy měl mnohem větší vaskulární průřezy produkující silnou dřevitou tkáň.
Endodermis
An endodermis se mohly vyvinout v prvních kořenech rostlin během devonu, ale první fosilní důkaz pro takovou strukturu je karbon.[44] Endodermis v kořenech obklopuje vodní transportní tkáň a reguluje iontovou výměnu mezi podzemní vodou a tkáněmi a brání vstupu nežádoucích patogenů atd. Do vodního transportního systému. Endodermis může také poskytovat tlak směrem vzhůru a vytlačovat vodu z kořenů, když transpirace nestačí řidiči.
Vývoj morfologie rostlin
Listy


Listy jsou primární fotosyntetický orgány moderní rostliny. Původ listy byla téměř jistě vyvolána klesající koncentrací atmosféry CO
2 během devonského období zvyšování účinnosti, s jakou by bylo možné zachytávat oxid uhličitý fotosyntéza.[53][54]
Listy se určitě vyvinuly více než jednou. Na základě jejich struktury jsou rozděleny do dvou typů: mikrofyly, které postrádají složité žilkování a mohly vzniknout jako ostnaté výrůstky známé jako enace, a megafyly, které jsou velké a složité žilkování které mohly vzniknout úpravou skupin větví. Bylo navrženo, aby tyto struktury vznikly nezávisle.[55] Megafyly, podle teorie telomu Waltera Zimmermana,[56] se vyvinuly z rostlin, které vykazovaly trojrozměrnou rozvětvenou architekturu, třemi transformacemi -přelití, což vedlo k boční poloze typické pro listy, plánování, který zahrnoval vytvoření rovinné architektury, popruh nebo fúze, který spojil rovinné větve, což vedlo k vytvoření řádného list plátek. Všechny tři kroky se ve vývoji dnešních listů odehrály několikrát.[57]
Obecně se věří, že teorie telomu je dobře podložena fosilními důkazy. Wolfgang Hagemann to však z morfologických a ekologických důvodů zpochybnil a navrhl alternativní teorii.[58][59] Zatímco podle teorie telomu mají nejprimitivnější suchozemské rostliny trojrozměrný rozvětvovací systém radiálně symetrických os (telomů), podle Hagemannovy alternativy se navrhuje opak: nejprimitivnější suchozemské rostliny, které vedly ke vzniku cévnatých rostlin, byly ploché, thalloidní , listové, bez seker, něco jako játrovka nebo kapradina prothallus. Sekery, jako jsou stonky a kořeny, se vyvinuly později jako nové orgány. Rolf Sattler navrhl zastřešující procesně orientovaný pohled, který ponechává určitý omezený prostor jak pro telomovou teorii, tak pro Hagemannovu alternativu a navíc bere v úvahu celé kontinuum mezi dorsiventrální (plochou) a radiální (válcovitou) strukturou, které lze nalézt ve fosilních a živých suchozemské rostliny.[60][61] Tento názor podporuje výzkum v molekulární genetice. Tak, James (2009)[62] dospěl k závěru, že „nyní je všeobecně přijímáno, že ... radiálnost [charakteristika os, jako jsou stonky] a dorziventralita [charakteristika listů] jsou pouze extrémy spojitého spektra. Ve skutečnosti jde pouze o načasování genové exprese KNOX! "
Před vývojem listy, rostliny měly fotosyntetický zařízení na stoncích. Dnešní listy megafylu se pravděpodobně staly běžnými asi 360 mil. Let, asi 40 mil. Po kolonizaci jednoduchých bezlistých rostlin zemí v Brzy devon. Toto šíření bylo spojeno s poklesem atmosféry oxid uhličitý koncentrace v Pozdní Paleozoikum éra spojená s nárůstem hustoty průduchy na povrchu listů.[53] To by vedlo k většímu transpirace sazby a výměna plynu, ale zejména při vysokých CO
2 koncentrace, velké listy s menším počtem průduchů by se při plném slunečním světle zahřály na smrtelné teploty. Zvýšení hustoty průduchů umožnilo lépe ochlazený list, což umožnilo jeho rozšíření, ale zvýšilo se CO2 absorpce na úkor snížené účinnosti využívání vody.[54][63]
Rhyniofyty Rhynieho rohovce se nesnažily o nic jiného než štíhlé, neozdobené sekery. Časný až střední devon trimerofyty lze považovat za listovou. Tato skupina cévnatých rostlin je rozeznatelná podle jejich masy terminálních sporangií, které zdobí konce os, které se mohou rozdvojovat nebo trifurkovat.[6] Některé organismy, jako např Psilophyton, nudit enace. Jedná se o malé, ostnaté výrůstky stonku, kterým chybí vlastní cévní zásobení.
The zosterofyly již na konci siluru byly důležité, mnohem dříve než jakékoli rhyniofyty srovnatelné složitosti.[64] Tato skupina, rozeznatelná podle sporangií ve tvaru ledviny, které rostly na krátkých postranních větvích blízko hlavních os, někdy rozvětvených ve výrazném tvaru H.[6] Mnoho zosterofylů neslo na svých osách výrazné trny[Citace je zapotřebí ] ale žádný z nich neměl cévní stopu. První důkaz vaskularizovaných enací se vyskytuje ve fosilních klubech známých jako Baragwanathia který se již objevil ve fosilním záznamu v pozdním siluru.[65] V tomto organismu tyto stopy listů pokračují do listu a vytvářejí svou střední žílu.[66] Jedna z teorií, „teorie enace“, tvrdí, že mikrofyllózní listy klubmózy vyvinuté výrůstky protostele spojující se s existujícími enations[6] Listy rodu Rhynie Asteroxylon, který byl zachován v Rhynie chert téměř 20 milionů let později než Baragwanathia měl primitivní cévní zásobu - v podobě listové stopy odchýlení se od centrální protostele směrem ke každému jednotlivému „listu“.[67] Asteroxylon a Baragwanathia jsou široce považováni za primitivní lykopody,[6] skupina stále existující dnes, zastoupená ostnatec, spikemosses a klubové mechy. Lycopods nesou výrazné mikrofyly, definované jako listy s jedinou vaskulární stopou. Mikrofyly by mohly dorůst do určité velikosti, ty z Lepidodendrales dosahující délky přes metr, ale téměř všichni jen nesou jeden cévní svazek. Výjimkou je u některých vzácné větvení Selaginella druh.
Čím známější listy, megafyly, se předpokládá, že vznikly čtyřikrát nezávisle, v kapradinách, přesličkách, progymnospermech a semenných rostlinách.[68] Zdá se, že vznikly úpravou dichotomizace větve, které se nejprve navzájem překrývaly (nebo „překrývaly“), se zplošťovaly nebo hoblovaly a nakonec vyvinuly „popruh“ a postupně se vyvinuly do listnatějších struktur.[66] Megafyly, podle Zimmerman teorie telomu, se skládají ze skupiny větví s webem[66] a proto „listová mezera“ vlevo, kde listový vaskulární svazek opouští listovou větev, se podobá rozdělení dvou os.[66] V každé ze čtyř skupin, které vyvinuly megafyly, se jejich listy nejprve vyvinuly během pozdního devonu do raného karbonu a rychle se diverzifikovaly, dokud se vzory neusadily ve středním karbonu.[68]
Zastavení další diverzifikace lze připsat vývojovým omezením,[68] ale proč trvalo tak dlouho, než se listy vyvinuly? Rostliny byly na zemi nejméně 50 milionů let, než se megafyly staly významnými. Z raného devonského rodu jsou však známy malé, vzácné mezofyly Eophyllophyton - takže vývoj nemohl být překážkou jejich vzhledu.[69] Nejlepší vysvětlení zatím zahrnuje pozorování atmosférická CO
2 během této doby rychle klesal - během devonu klesl přibližně o 90%.[70] To vyžadovalo 100násobné zvýšení stomatální hustoty, aby se udržela rychlost fotosyntézy. Když se průduchy otevřou, aby se voda mohla odpařit z listů, má to chladicí účinek, který vyplývá ze ztráty latentní teplo odpařování. Ukazuje se, že nízká stomatální hustota v raném devonu znamenala, že odpařování a odpařovací chlazení bylo omezeno a že listy by se přehřály, kdyby narostly na jakoukoli velikost. Hustota průduchů se nemohla zvýšit, protože primitivní stély a omezené kořenové systémy by nebyly schopny dodávat vodu dostatečně rychle, aby odpovídaly rychlosti transpirace.[54] Je zřejmé, že listy nejsou vždy prospěšné, jak dokládá častý výskyt sekundární ztráty listů, což skvěle ilustruje kaktusy a "metla kapradí" Psilotum.
Sekundární evoluce může také zamaskovat skutečný evoluční původ některých listů. Některé rody kapradin vykazují složité listy, které jsou připojeny k pseudostele vyrůstem cévního svazku a nezanechávají mezeru v listu.[66] Dále přeslička (Equisetum ) listy nesou pouze jednu žílu a vypadají jako mikrofilózní; fosilní záznamy i molekulární důkazy však naznačují, že jejich předci nesli listy se složitým žilkováním a současný stav je výsledkem sekundárního zjednodušení.[71]
Opadavý stromy mají jinou nevýhodu než mít listy. Populární víra, že rostliny vrhají listy, když jsou dny příliš krátké, je zavádějící; evergreeny prosperovaly v Polární kruh Během nejnovější skleníková země.[72] Obecně přijímaným důvodem pro odhazování listí během zimy je vypořádání se s počasím - síla větru a váha sněhu jsou mnohem pohodlněji zvětralé bez listí, aby se zvětšila plocha. Ztráta sezónního listu se několikrát vyvinula samostatně a projevuje se v ginkgoales, někteří pinophyta a některé krytosemenné rostliny.[73] Ztráta listů mohla také vzniknout jako reakce na tlak hmyzu; mohlo být méně nákladné úplně ztratit listí během zimy nebo období sucha, než pokračovat v investování prostředků do jejich oprav.[74]
Faktory ovlivňující listové architektury
Různé fyzikální a fyziologické faktory, jako je světlo intenzita, vlhkost vzduchu, teplota, rychlosti větru ovlivnily vývoj tvaru a velikosti listu. Vysoké stromy mají zřídka velké listy, protože jsou poškozeny silným větrem. Podobně stromy, které rostou mírný nebo tajga regiony mají špičaté listy,[Citace je zapotřebí ] pravděpodobně k zabránění nukleaci ledu na povrch listu a snížení ztrát vody v důsledku transpirace. Bylinožravý, savci a hmyz, byla hnací silou evoluce listů. Příkladem je, že rostliny rodu Nového Zélandu Aciphylla mají na laminách trny, které pravděpodobně fungovaly tak, aby odradily od vyhynulých Moas aby se jimi krmili. Ostatní členové Aciphylla, které s moasy neexistovaly, tyto trny nemají.[75]
Na genetické úrovni vývojové studie ukázaly, že k zahájení genomu KNOX je nutná represe list primordium. To je způsobeno ARP geny, které kódují transkripční faktory. Represe genů KNOX v listových primordiích se zdá být docela konzervativní, zatímco exprese genů KNOX v listech produkuje složité listy. The ARP Zdá se, že funkce vznikla na začátku roku cévnatá rostlina evolution, because members of the primitive group Lykofyty also have a functionally similar gene.[76] Other players that have a conserved role in defining leaf primordia are the phytohormones auxin, gibberelin a cytokinin.

The arrangement of leaves or fylotaxy on the plant body can maximally harvest light and might be expected to be genetically robustní. Nicméně v kukuřice, a mutation in only one gene called ABPHYL (ABnormal PHYLlotaxy) is enough to change the phyllotaxy of the leaves, implying that mutational adjustment of a single locus on the genom is enough to generate diversity.[77]
Once the leaf primordial cells are established from the SAM cells, the new sekery for leaf growth are defined, among them being the abaxial-adaxial (lower-upper surface) axes. The genes involved in defining this, and the other axes seem to be more or less conserved among higher plants. Bílkoviny HD-ZIPIII family have been implicated in defining the adaxial identity. These proteins deviate some cells in the leaf primordium from the default abaxial state, and make them adaxiální. In early plants with leaves, the leaves probably just had one type of surface — the abaxial one, the underside of today's leaves. The definition of the adaxial identity occurred some 200 million years after the abaxial identity was established.[78]
How the wide variety of observed plant leaf morphology is generated is a subject of intense research. Some common themes have emerged. One of the most significant is the involvement of KNOX genes in generating složené listy, jako v rajče (viz výše). But, this is not universal. Například hrášek uses a different mechanism for doing the same thing.[79][80] Mutations in genes affecting leaf zakřivení can also change leaf form, by changing the leaf from flat, to a crinkly shape,[81] like the shape of zelí listy. There also exist different morfogen gradients in a developing leaf which define the leaf's axis and may also affect the leaf form. Another class of regulators of leaf development are the mikroRNA.[82][83]
Kořeny
 |
 |
| The roots (bottom image) of Lepidodendrales (Stigmaria) are thought to be developmentally equivalent to the stems (top), as the similar appearance of "leaf scars" and "root scars" on these specimens from different species demonstrates. |
Roots are important to plants for two main reasons: Firstly, they provide anchorage to the substrate; more importantly, they provide a source of water and nutrients from the soil. Roots allowed plants to grow taller and faster.
The evolution of roots had consequences on a global scale. By disturbing the soil and promoting its acidification (by taking up nutrients such as nitrate and phosphate[84]), they enabled it to weather more deeply, injecting carbon compounds deeper into soils[85] with huge implications for climate.[86] These effects may have been so profound they led to a mass extinction.[87]
While there are traces of root-like impressions in fossil soils in the Late Silurian,[88] body fossils show the earliest plants to be devoid of roots. Many had prostrate branches that sprawled along the ground, with upright axes or thalli dotted here and there, and some even had non-photosynthetic subterranean branches which lacked stomata. The distinction between root and specialised branch is developmental.[je zapotřebí objasnění ] differing in their branching pattern and in possession of a kořenová čepice.[11] So while Siluro-Devonian plants such as Rhynia a Horneophyton possessed the physiological equivalent of roots,[89][90] roots – defined as organs differentiated from stems – did not arrive until later.[11] Unfortunately, roots are rarely preserved in the fossil record, and our understanding of their evolutionary origin is sparse.[11]
Rhizoids – small structures performing the same role as roots, usually a cell in diameter – probably evolved very early, perhaps even before plants colonised the land; they are recognised in the Characeae, an algal sister group to land plants.[11] That said, rhizoids probably evolved more than once; the rhiziny z lišejníky, for example, perform a similar role. Even some animals (Lamellibrachia ) have root-like structures.[11] Rhizoids are clearly visible in the Rhynie chert fossils, and were present in most of the earliest vascular plants, and on this basis seem to have presaged true plant roots.[91]
More advanced structures are common in the Rhynie chert, and many other fossils of comparable early Devonian age bear structures that look like, and acted like, roots.[11] The rhyniophytes bore fine rhizoids, and the trimerophytes and herbaceous lycopods of the chert bore root-like structure penetrating a few centimetres into the soil.[92] However, none of these fossils display all the features borne by modern roots,[11] s výjimkou Asteroxylon, which has recently been recognized as bearing roots that evolved independently from those of extant vascular plants.[93] Roots and root-like structures became increasingly common and deeper penetrating during the Devonský, with lycopod trees forming roots around 20 cm long during the Eifelian and Givetian. These were joined by progymnosperms, which rooted up to about a metre deep, during the ensuing Frasnian stage.[92] True gymnosperms and zygopterid ferns also formed shallow rooting systems during the Famennian.[92]
The rhizophores of the lycopods provide a slightly different approach to rooting. They were equivalent to stems, with organs equivalent to leaves performing the role of rootlets.[11] A similar construction is observed in the extant lycopod Isoetes, and this appears to be evidence that roots evolved independently at least twice, in the lycophytes and other plants,[11] a proposition supported by studies showing that roots are initiated and their growth promoted by different mechanisms in lycophytes and euphyllophytes.[94]
A vascular system is indispensable to rooted plants, as non-photosynthesising roots need a supply of sugars, and a vascular system is required to transport water and nutrients from the roots to the rest of the plant.[10] Rooted plants[který? ] are little more advanced than their Silurian forebears, without a dedicated root system; however, the flat-lying axes can be clearly seen to have growths similar to the rhizoids of bryophytes today.[95]
By the Middle to Late Devonian, most groups of plants had independently developed a rooting system of some nature.[95] As roots became larger, they could support larger trees, and the soil was weathered to a greater depth.[87] This deeper weathering had effects not only on the aforementioned drawdown of CO
2, but also opened up new habitats for colonisation by fungi and animals.[92]
Roots today have developed to the physical limits. They penetrate as much as 60 metres of soil to tap the water table.[96] The narrowest roots are a mere 40 μm in diameter, and could not physically transport water if they were any narrower.[11]The earliest fossil roots recovered, by contrast, narrowed from 3 mm to under 700 μm in diameter; of course, taphonomy is the ultimate control of what thickness can be seen.[11]
Tree form


The early Devonian landscape was devoid of vegetation taller than waist height. Greater height provided a competitive advantage in the harvesting of sunlight for photosynthesis, overshadowing of competitors and in spore distribution, as spores (and later, seeds) could be blown for greater distances if they started higher. An effective vascular system was required in order to achieve greater heights. Dosáhnout stromovost, plants had to develop dřevnatý tissue that provided both support and water transport, and thus needed to evolve the capacity for sekundární růst. The stele of plants undergoing secondary growth is surrounded by a vaskulární kambium, a ring of meristematic cells which produces more xylem on the inside and phloem on the outside. Since xylem cells comprise dead, lignified tissue, subsequent rings of xylem are added to those already present, forming wood. Fossils of plants from the early Devonian show that a simple form of wood first appeared at least 400 million years ago, at a time when all land plants were small and herbaceous.[97] Because wood evolved long before shrubs and trees, it is likely that its original purpose was for water transport, and that it was only used for mechanical support later.[98]
The first plants to develop secondary growth and a woody habit, were apparently the ferns, and as early as the Middle Devonian one species, Wattieza, had already reached heights of 8 m and a tree-like habit.[99]
Other clades did not take long to develop a tree-like stature. The Late Devonian Archaeopteris, a předchůdce na gymnospermy which evolved from the trimerophytes,[100] reached 30 m in height. The progymnosperms were the first plants to develop true wood, grown from a bifacial cambium. The first appearance of one of them, Rellimia, was in the Middle Devonian.[101] True wood is only thought to have evolved once, giving rise to the concept of a "lignophyte" clade.[Citace je zapotřebí ]
Archaeopteris forests were soon supplemented by arborescent lycopods, in the form of Lepidodendrales, which exceeded 50m in height and 2m across at the base. These arborescent lycopods rose to dominate Late Devonian and Carboniferous forests that gave rise to uhlí vklady.[102] Lepidodendrales differ from modern trees in exhibiting determinate growth: after building up a reserve of nutrients at a lower height, the plants would "bolt" as a single trunk to a genetically determined height, branch at that level, spread their spores and die.[103] They consisted of "cheap" wood to allow their rapid growth, with at least half of their stems comprising a pith-filled cavity.[6] Their wood was also generated by a unifacial vascular cambium – it did not produce new phloem, meaning that the trunks could not grow wider over time.[je nutné ověření ]
The přeslička Calamity se objevil v Karbon. Unlike the modern horsetail Equisetum, Calamity had a unifacial vascular cambium, allowing them to develop wood and grow to heights in excess of 10 m and to branch repeatedly.
While the form of early trees was similar to that of today's, the Spermatofyty or seed plants, the group that contain all modern trees, had yet to evolve. The dominant tree groups today are all seed plants, the gymnosperms, which include the coniferous trees, and the angiosperms, which contain all fruiting and flowering trees. No free-sporing trees like Archaeopteris exist in the extant flora. It was long thought that the angiosperms arose from within the gymnosperms, but recent molecular evidence suggests that their living representatives form two distinct groups.[104][105][106] The molecular data has yet to be fully reconciled with morphological data,[107][108][109] but it is becoming accepted that the morphological support for paraphyly is not especially strong.[110]This would lead to the conclusion that both groups arose from within the pteridosperms, probably as early as the Permu.[110]
The angiosperms and their ancestors played a very small role until they diversified during the Cretaceous. They started out as small, damp-loving organisms in the understorey, and have been diversifying ever since the mid[je nutné ověření ]-Cretaceous, to become the dominant member of non-boreální forests today.
Semena


Early land plants reproduced in the fashion of ferns: spores germinated into small gametophytes, which produced eggs and/or sperm. These sperm would swim across moist soils to find the female organs (archegonia) on the same or another gametophyte, where they would fuse with an egg to produce an embryo, which would germinate into a sporophyte.[92]
Heterosporic plants, as their name suggests, bear spores of two sizes – microspores and megaspores. These would germinate to form microgametophytes and megagametophytes, respectively. This system paved the way for ovules and seeds: taken to the extreme, the megasporangia could bear only a single megaspore tetrad, and to complete the transition to true ovules, three of the megaspores in the original tetrad could be aborted, leaving one megaspore per megasporangium.
The transition to ovules continued with this megaspore being "boxed in" to its sporangium while it germinated. Then, the megagametophyte was contained within a waterproof integument, which enclosed the seed. The pollen grain, which contained a microgametophyte germinated from a microspore , was employed for dispersal of the male gamete, only releasing its desiccation-prone flagellate sperm when it reached a receptive megagametophyte.[6]
Lycopods and sphenopsids got a fair way down the path to the seed habit without ever crossing the threshold. Fossil lycopod megaspores reaching 1 cm in diameter, and surrounded by vegetative tissue, are known (Lepidocarpon, Achlamydocarpon);– these even germinated into a megagametophyte in situ. However, they fell short of being ovules, since the nucellus, an inner spore-covering layer, does not completely enclose the spore. A very small slit (micropyle) remains, meaning that the megasporangium is still exposed to the atmosphere. This has two consequences – firstly, it means it is not fully resistant to desiccation, and secondly, sperm do not have to "burrow" to access the archegonia of the megaspore.[6]
A Middle Devonský předchůdce to seed plants from Belgium has been identified predating the earliest semenné rostliny by about 20 million years. Runcaria, small and radially symmetrical, is an integumented megasporangium surrounded by a cupule. The megasporangium bears an unopened distal extension protruding above the multilobed kůže. It is suspected that the extension was involved in anemophilous opylení. Runcaria sheds new light on the sequence of character acquisition leading to the seed. Runcaria has all of the qualities of seed plants except for a solid osemení and a system to guide the pollen to the ovule.[111]
The first spermatophytes (literally: "seed plants") – that is, the first plants to bear true seeds – are called pteridospermy: literally, "seed ferns", so called because their foliage consisted of fern-like fronds, although they were not closely related to ferns. The oldest fossil evidence of seed plants is of Late Devonian age, and they appear to have evolved out of an earlier group known as the progymnospermy. These early seed plants ranged from trees to small, rambling shrubs; like most early progymnosperms, they were woody plants with fern-like foliage. They all bore ovules, but no cones, fruit or similar. While it is difficult to track the early evolution of seeds, the lineage of the seed ferns may be traced from the simple trimerophytes through homosporous Aneurophytes.[6]
This seed model is shared by basically all gymnosperms (literally: "naked seeds"), most of which encase their seeds in a woody cone or fleshy aril (the tis, for example), but none of which fully enclose their seeds. The angiosperms ("vessel seeds") are the only group to fully enclose the seed, in a carpel.
Fully enclosed seeds opened up a new pathway for plants to follow: that of klidu semen. The embryo, completely isolated from the external atmosphere and hence protected from desiccation, could survive some years of drought before germinating.Gymnosperm seeds from the Late Carboniferous have been found to contain embryos, suggesting a lengthy gap between fertilisation and germination.[112] This period is associated with the entry into a greenhouse earth period, with an associated increase in aridity. This suggests that dormancy arose as a response to drier climatic conditions, where it became advantageous to wait for a moist period before germinating.[112] This evolutionary breakthrough appears to have opened a floodgate: previously inhospitable areas, such as dry mountain slopes, could now be tolerated, and were soon covered by trees.[112]
Seeds offered further advantages to their bearers: they increased the success rate of fertilised gametophytes, and because a nutrient store could be "packaged" in with the embryo, the seeds could germinate rapidly in inhospitable environments, reaching a size where it could fend for itself more quickly.[92] For example, without an endosperm, seedlings growing in arid environments would not have the reserves to grow roots deep enough to reach the water table before they expired from dehydration.[92] Likewise, seeds germinating in a gloomy understory require an additional reserve of energy to quickly grow high enough to capture sufficient light for self-sustenance.[92]A combination of these advantages gave seed plants the ecological edge over the previously dominant genus Archaeopteris, thus increasing the biodiversity of early forests.[92]
Despite these advantages, it is common for fertilized ovules to fail to mature as seeds.[113] Also during seed dormancy (often associated with unpredictable and stressful conditions) DNA damage accumulates.[114][115][116] Thus DNA damage appears to be a basic problem for survival of seed plants, just as DNA damage is a A major problem for life obecně.[117]
Květiny

Flowers are modified leaves possessed only by the krytosemenné rostliny, which are relatively late to appear in the fossil record. The group originated and diversified during the Early Cretaceous and became ecologically significant thereafter.[118] Flower-like structures first appear in the fosilní records some ~130 mya, in the Křídový.[119] However, in 2018, scientists reported the finding of a fossil květ from about 180 million years ago, 50 million years earlier than thought earlier.[120] The interpretation has been however highly disputed.[121]
Colorful and/or pungent structures surround the cones of plants such as cykasy a Gnetales, making a strict definition of the term "flower" elusive.[109]
The main function of a flower is reprodukce, which, before the evolution of the flower and krytosemenné rostliny, was the job of microsporophylls and megasporophylls. A flower can be considered a powerful evolutionary inovace, because its presence allowed the plant world to access new means and mechanisms for reproduction.
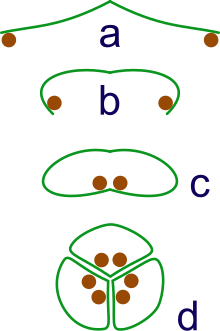
a: sporangia borne at tips of leaf
b: Leaf curls up to protect sporangia
c: leaf curls to form enclosed roll
d: grouping of three rolls into a syncarp
The flowering plants have long been assumed to have evolved from within the gymnospermy; according to the traditional morphological view, they are closely allied to the Gnetales. However, as noted above, recent molecular evidence is at odds with this hypothesis,[105][106] and further suggests that Gnetales are more closely related to some gymnosperm groups than angiosperms,[104] a to existující gymnosperms form a distinct clade to the angiosperms,[104][105][106] the two clades diverging some 300 před miliony let.[122]
Vztah stem groups do krytosemenné rostliny is important in determining the evolution of flowers. Stem groups provide an insight into the state of earlier "forks" on the path to the current state. Convergence increases the risk of misidentifying stem groups. Since the protection of the megagametofyt is evolutionarily desirable, probably many separate groups evolved protective encasements independently. In flowers, this protection takes the form of a carpel, evolved from a leaf and recruited into a protective role, shielding the ovules. These ovules are further protected by a double-walled kůže.
Penetration of these protective layers needs something more than a free-floating mikrogametofyt. Krytosemenné rostliny have pollen grains comprising just three cells. One cell is responsible for drilling down through the integuments, and creating a conduit for the two sperm cells to flow down. The megagametophyte has just seven cells; of these, one fuses with a sperm cell, forming the nucleus of the egg itself, and another joins with the other sperm, and dedicates itself to forming a nutrient-rich endosperm. The other cells take auxiliary roles.[je zapotřebí objasnění ] This process of "double fertilisation " is unique and common to all angiosperms.

In the fossil record, there are three intriguing groups which bore flower-like structures. První je Permu pteridosperm Glossopteris, which already bore recurved leaves resembling carpels. The Druhohor Caytonia is more flower-like still, with enclosed ovules – but only a single integument. Further, details of their pollen and stamens set them apart from true flowering plants.
The Bennettitales bore remarkably flower-like organs, protected by whorls of listeny which may have played a similar role to the petals and sepals of true flowers; however, these flower-like structures evolved independently, as the Bennettitales are more closely related to cykasy a ginkgo than to the angiosperms.[123]
However, no true flowers are found in any groups save those extant today. Most morphological and molecular analyses place Amborella, nymphaeales a Austrobaileyaceae in a basal clade called "ANA". This clade appear to have diverged in the early Cretaceous, around 130 před miliony let – around the same time as the earliest fossil angiosperm,[124][125] a hned po first angiosperm-like pollen, 136 million years ago.[110]The magnoliidy diverged soon after, and a rapid radiation had produced eudicots and monocots by 125 před miliony let.[110] By the end of the Cretaceous 66 před miliony let, over 50% of today's angiosperm orders had evolved, and the clade accounted for 70% of global species.[126]It was around this time that flowering trees became dominant over jehličnany.[6]:498
The features of the basal "ANA" groups suggest that angiosperms originated in dark, damp, frequently disturbed areas.[127] It appears that the angiosperms remained constrained to such habitats throughout the Cretaceous – occupying the niche of small herbs early in the successional series.[126] This may have restricted their initial significance, but given them the flexibility that accounted for the rapidity of their later diversifications in other habitats.[127]
| Tradiční pohled | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Moderní pohled | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Some propose that the Angiosperms arose from an unknown Seed Fern, Pteridophyte, and view Cycads as living Seed Ferns with both Seed-Bearing and sterile leaves (Cycas revoluta)[108]
In August 2017, scientists presented a detailed description and 3D image of a reconstruction of possibly the first květ that lived about 140 million years ago.[128][129]
Origins of the flower

Rodina Amborellaceae is regarded as being the sister clade to all other living flowering plants. A draft genome of Amborella trichopoda was published in December, 2013.[130] By comparing its genome with those of all other living flowering plants, it will be possible to work out the most likely characteristics of the ancestor of A. trichopoda and all other flowering plants, i.e. the ancestral flowering plant.[131]
It seems that on the level of the organ, the list may be the ancestor of the flower, or at least some floral organs. When some crucial genes involved in flower development are zmutovaný, clusters of leaf-like structures arise in place of flowers. Thus, sometime in history, the developmental program leading to formation of a leaf must have been altered to generate a flower. There probably also exists an overall robust framework within which the floral diversity has been generated. An example of that is a gene called LEAFY (LFY), which is involved in flower development in Arabidopsis thaliana. The homology of this gene are found in krytosemenné rostliny stejně různorodé jako rajče, hledík, hrášek, kukuřice a dokonce gymnospermy. Vyjádření Arabidopsis thaliana LFY in distant plants like topol a citrus also results in flower-production in these plants. The LFY gene regulates the expression of some genes belonging to the MADS-box rodina. These genes, in turn, act as direct controllers of flower development.[Citace je zapotřebí ]
Evolution of the MADS-box family
Členové MADS-box family of transcription factors play a very important and evolutionarily conserved role in flower development. Podle ABC Model of flower development, three zones — A, B and C — are generated within the developing flower primordium, by the action of some transkripční faktory, that are members of the MADS-box rodina. Among these, the functions of the B and C domain genes have been evolutionarily more conserved than the A domain gene. Many of these genes have arisen through genové duplikace of ancestral members of this family. Quite a few of them show redundant functions.
The evolution of the MADS-box family has been extensively studied. These genes are present even in pteridofyty, but the spread and diversity is many times higher in krytosemenné rostliny.[132] There appears to be quite a bit of pattern into how this family has evolved. Consider the evolution of the C-region gene AGAMOUS (AG). It is expressed in today's flowers in the tyčinky a carpel, which are reproductive organs. Its ancestor in gymnospermy also has the same expression pattern. Here, it is expressed in the strobili, an organ that produces pyl or ovules.[133] Similarly, the B-genes' (AP3 and PI) ancestors are expressed only in the male organs in gymnospermy. Their descendants in the modern angiosperms also are expressed only in the tyčinky, the male reproductive organ. Thus, the same, then-existing components were used by the plants in a novel manner to generate the first flower. This is a recurring pattern in vývoj.
Factors influencing floral diversity
There is enormous variation in floral structure in plants, typically due to changes in the MADS-box genes and their expression pattern. For example, grasses possess unique floral structures. The carpels and stamens are surrounded by scale-like lodicules and two bracts, the lemma and the palea, but genetic evidence and morphology suggest that lodicules are homologous to eudicot okvětní lístky.[134] The palea and lemma may be homologous to sepals in other groups, or may be unique grass structures.[Citace je zapotřebí ]
Dalším příkladem je Linaria vulgaris, which has two kinds of flower symmetries-radiální a bilaterální. These symmetries are due to epigenetický changes in just one gene called CYCLOIDEA.[119]

Arabidopsis thaliana has a gene called AGAMOUS that plays an important role in defining how many okvětní lístky a sepals and other organs are generated. Mutations in this gene give rise to the floral meristem obtaining an indeterminate fate, and proliferation of floral organs in dvoukvětý formy růže, karafiáty a ranní sláva. Tyto fenotypy have been selected by horticulturists for their increased number of okvětní lístky.[135] Several studies on diverse plants like petunie, rajče, Impatiens, kukuřice etc. have suggested that the enormous diversity of flowers is a result of small changes in geny controlling their development.[136]
The Projekt Květinový genom potvrdila, že ABC Model of flower development is not conserved across all krytosemenné rostliny. Sometimes expression domains change, as in the case of many jednoděložní rostliny, and also in some basal angiosperms like Amborella. Different models of flower development like the Fading boundaries model, nebo Overlapping-boundaries model which propose non-rigid domains of expression, may explain these architectures.[137] There is a possibility that from the basal to the modern angiosperms, the domains of floral architecture have become more and more fixed through evolution.
Flowering time
Another floral feature that has been a subject of přírodní výběr is flowering time. Some plants flower early in their life cycle, others require a period of vernalization before flowering. This outcome is based on factors like teplota, light intensity, přítomnost opylovače and other environmental signals: genes like CONSTANS (CO), Kvetoucí Locus C. (FLC) a FRIGIDA regulate integration of environmental signals into the pathway for flower development. Variations in these loci have been associated with flowering time variations between plants. Například, Arabidopsis thaliana ecotypes that grow in the cold, mírný regions require prolonged vernalization before they flower, while the tropický varieties, and the most common lab strains, don't. This variation is due to mutations in the FLC a FRIGIDA genes, rendering them non-functional.[138]
Many of the genes involved in this process are conserved across all the plants studied. Sometimes though, despite genetic conservation, the mechanism of action turns out to be different. Například, rýže is a short-day plant, while Arabidopsis thaliana is a long-day plant. Both plants have the proteins CO a FLOWERING LOCUS T (FT), ale v Arabidopsis thaliana, CO zvyšuje FT production, while in rice, the CO homolog represses FT production, resulting in completely opposite downstream effects.[139]
Theories of flower evolution
The Anthophyte theory was based on the observation that a gymnospermic group Gnetales has a flower-like ovule. It has partially developed plavidla jak je uvedeno v krytosemenné rostliny a megasporangium is covered by three envelopes, like the vaječník structure of angiosperm flowers. However, many other lines of evidence show that Gnetales is not related to angiosperms.[123]
The Mostly Male theory has a more genetic basis. Proponents of this theory point out that the gymnosperms have two very similar copies of the gene LFY, while angiosperms just have one. Molekulární hodiny analysis has shown that the other LFY paralog was lost in angiosperms around the same time as flower fossils become abundant, suggesting that this event might have led to floral evolution.[140] According to this theory, loss of one of the LFY paralog led to flowers that were more male, with the vajíčka being expressed ectopically. These ovules initially performed the function of attracting opylovače, but sometime later, may have been integrated into the core flower.
Mechanisms and players in evolution of plant morphology

While environmental factors are significantly responsible for evolutionary change, they act merely as agents for přírodní výběr. Change is inherently brought about via phenomena at the genetic level: mutace, chromosomal rearrangements, and epigenetický Změny. While the general types of mutace hold true across the living world, in plants, some other mechanisms have been implicated as highly significant.
Genome doubling is a relatively common occurrence in plant evolution and results in polyploidie, which is consequently a common feature in plants. It is estimated that at least half (and probably all) plants have seen genome doubling in their history. Genome doubling entails genová duplikace, thus generating functional redundancy in most genes. The duplicated genes may attain new function, either by changes in expression pattern or changes in activity. Polyploidy and gene duplication are believed to be among the most powerful forces in evolution of plant form; though it is not known why genom doubling is such a frequent process in plants. One probable reason is the production of large amounts of sekundární metabolity v rostlinných buňkách. Some of them might interfere in the normal process of chromosomal segregation, causing genome duplication.
In recent times, plants have been shown to possess significant mikroRNA families, which are conserved across many plant lineages. Ve srovnání s zvířata, while the number of plant miRNA families are lesser than animals, the size of each family is much larger. The miRNA genes are also much more spread out in the genome than those in animals, where they are more clustered. It has been proposed that these miRNA families have expanded by duplications of chromosomal regions.[141] Many miRNA genes involved in regulation of vývoj rostlin have been found to be quite conserved between plants studied.
Domestikace of plants like kukuřice, rýže, ječmen, pšenice etc. has also been a significant driving force in their evolution. Research concerning the origin of maize has found that it is a domesticated derivative of a wild plant from Mexiko volala teosinte. Teosinte belongs to the rod Zea, just as maize, but bears very small květenství, 5–10 hard cobs and a highly branched and spread out stem.

Crosses between a particular teosinte variety and maize yields fertile offspring that are intermediate in fenotyp between maize and teosinte. QTL analysis has also revealed some loci that, when mutated in maize, yield a teosinte-like stem or teosinte-like cobs. Molekulární hodiny analysis of these genes estimates their origins to some 9,000 years ago, well in accordance with other records of maize domestication. It is believed that a small group of farmers must have selected some maize-like natural mutant of teosinte some 9,000 years ago in Mexico, and subjected it to continuous selection to yield the familiar maize plant of today.[142]
The edible cauliflower is a domesticated version of the wild plant Brassica oleracea, which does not possess the dense undifferentiated květenství, called the curd, that cauliflower possesses.
Cauliflower possesses a single mutation in a gene called CAL, ovládání meristem diferenciace na květenství. This causes the cells at the floral meristem to gain an undifferentiated identity and, instead of growing into a květ, they grow into a dense mass of inflorescence meristem cells in arrested development.[143] This mutation has been selected through domestication since at least the time of the řecký říše.
Evolution of photosynthetic pathways

The C4 metabolická cesta is a valuable recent evolutionary innovation in plants, involving a complex set of adaptive changes to fyziologie a genová exprese vzory.[144]
Fotosyntéza is a complex chemical pathway facilitated by a range of enzymy and co-enzymes. The enzym RuBisCO is responsible for "fixing" CO
2 – that is, it attaches it to a carbon-based molecule to form a sugar, which can be used by the plant, releasing an oxygen molecule. However, the enzyme is notoriously inefficient, and, as ambient temperature rises, will increasingly fix oxygen instead of CO
2 v procesu zvaném fotorespirace. This is energetically costly as the plant has to use energy to turn the products of photorespiration back into a form that can react with CO
2.
Concentrating carbon
C4 plants evolved carbon concentrating mechanisms that work by increasing the concentration of CO
2 around RuBisCO, and excluding oxygen, thereby increasing the efficiency of photosynthesis by decreasing photorespiration. The process of concentrating CO
2 around RuBisCO requires more energy than allowing gases to šířit, but under certain conditions – i.e. warm temperatures (>25 °C), low CO
2 concentrations, or high oxygen concentrations – pays off in terms of the decreased loss of sugars through photorespiration.
One type of C4 metabolism employs a so-called Kranzova anatomie. This transports CO
2 through an outer mesophyll layer, via a range of organic molecules, to the central bundle sheath cells, where the CO
2 je vydáno. Takto, CO
2 is concentrated near the site of RuBisCO operation. Because RuBisCO is operating in an environment with much more CO
2 than it otherwise would be, it performs more efficiently.
A second mechanism, CAM fotosyntéza, temporally separates photosynthesis from the action of RuBisCO. RuBisCO only operates during the day, when stomata are sealed and CO
2 is provided by the breakdown of the chemical malát. Více CO
2 is then harvested from the atmosphere when stomata open, during the cool, moist nights, reducing water loss.
Evolutionary record
These two pathways, with the same effect on RuBisCO, evolved a number of times independently – indeed, C4 alone arose 62 times in 18 different plant rodiny. A number of 'pre-adaptations' seem to have paved the way for C4, leading to its clustering in certain clades: it has most frequently been innovated in plants that already had features such as extensive vascular bundle sheath tissue.[145] Many potential evolutionary pathways resulting in the C4 fenotyp are possible and have been characterised using Bayesovský závěr,[144] confirming that non-photosynthetic adaptations often provide evolutionary stepping stones for the further evolution of C4.
C.4 construction is used by a subset of grasses, while CAM is employed by many succulents and kaktusy. C.4 trait appears to have emerged during the Oligocen, kolem 25 až 32 před miliony let;[146] ekologicky významné se však staly až v roce 2006 Miocén, 6 až 7 před miliony let.[147] Je pozoruhodné, že některé zkamenělé uhlí uchovávají tkáň uspořádanou do anatomie Kranze s neporušenými buňkami pochvy svazku,[148] umožňující přítomnost C.4 metabolismus, který má být identifikován. Izotopové markery se používají k odvození jejich distribuce a významnosti3 rostliny přednostně používají zapalovač ze dvou izotopy uhlíku v atmosféře, 12C, který je snadněji zapojen do chemických drah zapojených do jeho fixace. Protože C4 metabolismus zahrnuje další chemický krok, tento účinek je zdůrazněn. Rostlinný materiál může být analyzovány odvodit poměr těžších 13C až 12C. Tento poměr je označen δ13C. C3 rostliny jsou v průměru asi o 14 ‰ (části na tisíc) lehčí než atmosférický poměr, zatímco C4 rostliny jsou asi o 28 ‰ lehčí. The δ13C CAM rostlin závisí na procentu uhlíku fixovaného v noci ve srovnání s tím, co je fixováno v den, přičemž je blíže k C3 rostliny, pokud fixují většinu uhlíku za den a blíže k C.4 rostliny, pokud v noci fixují veškerý svůj uhlík.[149]
Originální fosilní materiál v dostatečném množství pro analýzu samotné trávy je vzácný, ale koně jsou dobrým zástupcem. V období zájmu byly celosvětově rozšířené a listovaly téměř výlučně na travinách. V paleontologii izotopů je stará fráze: „Jsi to, co jíš (plus trochu)“ - to se týká skutečnosti, že organismy odrážejí izotopové složení všeho, co jedí, plus malý faktor úpravy. Koňské zuby jsou dobré po celém světě a jejich δ13C záznam ukazuje prudkou negativní inflaci kolem 6 až 7 před miliony let, během Messinian, který je interpretován jako výsledek vzestupu C4 rostliny v globálním měřítku.[147]
Kdy je C.4 výhoda?
Zatímco C.4 zvyšuje účinnost RuBisCO, koncentrace uhlíku je vysoce energeticky náročná. To znamená, že C.4 rostliny mají oproti C pouze výhodu3 organismy za určitých podmínek: zejména vysoké teploty a nízké srážky. C4 rostliny také potřebují vysokou úroveň slunečního světla, aby se jim dařilo.[150] Modely naznačují, že bez požárů, které by odstraňovaly stromy a keře vrhající stín, by pro C nebyl žádný prostor4 rostliny.[151] Ale požáry se vyskytovaly 400 milionů let - proč C4 Trvá tak dlouho, než se objeví, a pak se tolikrát objeví samostatně? Karbon (~300 před miliony let) měl notoricky vysoké hladiny kyslíku - téměř dost, aby to dovolil samovolné vznícení[152] - a velmi nízká CO
2, ale neexistuje C4 izotopový podpis k nalezení. A nezdá se, že by došlo k náhlému spuštění vzestupu miocénu.
Během miocénu byla atmosféra a klima relativně stabilní. Pokud něco, CO
2 postupně se zvyšoval od 14 až 9 před miliony let před usazením na koncentrace podobné holocénu.[153] To naznačuje, že při vyvolání C neměl klíčovou roli4 vývoj.[146] Samotné trávy (skupina, která by vedla k největšímu výskytu C.4) byl pravděpodobně asi 60 milionů let a více, takže měl dostatek času na vývoj C.4,[154][155] který je v každém případě přítomen v nejrůznějších skupinách a vyvíjel se tak nezávisle. Existuje silný signál o změně klimatu v jižní Asii;[146] zvyšující se suchost - tedy zvyšující se četnost a intenzita požárů - mohla vést ke zvýšení významu travních porostů.[156] To je však obtížné sladit se severoamerickým rekordem.[146] Je možné, že signál je zcela biologický, vynucený ohněm (a slonem?) -[157] řízené zrychlení vývoje trávy - které jednak zvýšením povětrnostních vlivů a začleněním více uhlíku do sedimentů snížilo atmosférickou hladinu CO
2 úrovně.[157] Nakonec existují důkazy, že nástup C4 z 9 až 7 před miliony let je zkreslený signál, který platí pouze pro Severní Ameriku, odkud pochází většina vzorků; objevující se důkazy naznačují, že se travní porosty vyvinuly v dominantní stát nejméně o 15 Ma dříve v Jižní Americe.
Vývoj transkripční regulace
Transkripční faktory a transkripční regulační sítě hrají klíčové role ve vývoji rostlin a stresových reakcích, stejně jako v jejich vývoji. Během přistání rostlin se objevilo mnoho nových rodin transkripčních faktorů, které jsou přednostně zapojeny do sítí mnohobuněčného vývoje, reprodukce a vývoje orgánů, což přispívá ke složitější morfogenezi suchozemských rostlin.[158]
Vývoj sekundárního metabolismu
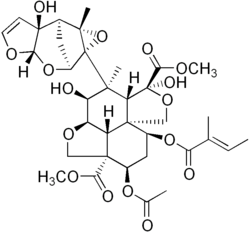
Sekundární metabolity jsou v zásadě nízké molekulární váha sloučeniny, někdy mající složité struktury, které nejsou nezbytné pro normální procesy růst, rozvoj nebo reprodukce. Fungují v procesech tak různorodých jako imunita, anti-herbivory, opylovač atrakce, sdělení mezi rostlinami, udržování symbiotický sdružení s půdní flórou nebo zvýšení rychlosti oplodnění, a proto jsou významné z hlediska evo-devo. Sekundární metabolity jsou strukturně a funkčně různorodé a odhaduje se, že do procesu jejich výroby mohou být zapojeny stovky tisíc enzymů, přičemž tyto enzymy kóduje asi 15–25% genomu a každý druh má svůj jedinečný arzenál sekundární metabolity.[159] Mnoho z těchto metabolitů, jako např kyselina salicylová mají pro člověka lékařský význam.
Účel produkce tolika sekundárních metabolitů, se značnou částí metabolome věnovaný této činnosti je nejasný. Předpokládá se, že většina z těchto chemikálií pomáhá vytvářet imunitu, a v důsledku toho je rozmanitost těchto metabolitů výsledkem neustálého závody ve zbrojení mezi rostlinami a jejich parazity. Některé důkazy tento případ podporují. Ústřední otázka zahrnuje reprodukční náklady na udržení tak velkého množství genů určených k produkci sekundárních metabolitů. Byly navrženy různé modely, které zkoumají tento aspekt otázky, ale ještě musí být dosaženo konsensu o rozsahu nákladů;[160] protože je stále obtížné předpovědět, zda rostlina s více sekundárními metabolity zvyšuje přežití nebo reprodukční úspěch ve srovnání s jinými rostlinami v jejím okolí.
Zdá se, že produkce sekundárního metabolitu během evoluce vznikla poměrně brzy. Zdá se, že v rostlinách se rozšířily pomocí mechanismů včetně duplikace genů nebo evoluce nových genů. Výzkum dále ukázal, že pro některé z těchto sloučenin může být pozitivně vybrána rozmanitost. I když je role evoluce nových genů ve vývoji sekundárního metabolismu jasná, existuje několik příkladů, kdy byly malými metabolickými změnami v reakci vytvořeny nové metabolity. Například, kyanogenové glykosidy Bylo navrženo, že se několikrát vyvinuly v různých liniích rostlin. Existuje několik takových případů konvergentní evoluce. Například enzymy pro syntézu limonen - a terpen - jsou si více podobné mezi angiospermy a gymnospermy než jejich vlastním enzymům pro syntézu terpenů. To naznačuje nezávislý vývoj biosyntetické dráhy limonenu v těchto dvou liniích.[161]
Vývoj interakcí rostlin a mikrobů

Původ mikrobů na Zemi, které sahají až k počátku života před více než 3,5 miliardami let, naznačuje, že interakce mikrobů a mikrobů se v průběhu času neustále vyvíjely a diverzifikovaly, dlouho předtím, než rostliny začaly kolonizovat zemi před 450 miliony let. Je proto pravděpodobné, že jak intermikrobiální interakce uvnitř, tak mezi královstvími jsou silnými hnacími silami zavádění rostlinných mikrobiální konsorcia na rozhraní půda-kořen. Zůstává však nejasné, do jaké míry tyto interakce v rhizosféře / fylosféře a v endofytických částech rostlin (tj. V hostiteli) formují mikrobiální sdružení v přírodě a zda mikrobiální adaptace na stanoviště rostlin řídí strategie interakce mikrobů s mikroby specifické pro stanoviště fitness rostlin. Příspěvek konkurenčních a kooperativních interakcí mezi mikroby a mikroby k celkové struktuře komunity je dále obtížné v přírodě vyhodnotit kvůli silnému hluku prostředí.[162]
Koevoluce rostlin a houbových parazitů
Dalším přispívajícím faktorem u některých rostlin vedoucích k evoluční změně je síla způsobená koevolucí s houbovými parazity. V prostředí s plísňovými parazity, které je v přírodě běžné, musí rostliny provést adaptaci, aby se vyhnuly škodlivým účinkům parazita.[165]
Kdykoli parazitická houba odsává omezené zdroje z rostliny, existuje selektivní tlak na fenotyp, který je lépe schopen zabránit parazitickému napadení houbami. Plísně, které jsou lépe vybaveny k tomu, aby se vyhnuly obraně rostliny, budou mít zároveň vyšší kondici. Kombinace těchto dvou faktorů vede k nekonečnému cyklu evolučních změn v systému hostitel-patogen.[166]
Protože každý druh ve vztahu je ovlivňován neustále se měnícím symbiontem, k evoluční změně obvykle dochází rychlejším tempem, než kdyby jiný druh nebyl přítomen. To platí pro většinu případů koevoluce. Díky tomu je schopnost populace rychle se vyvíjet zásadní pro její přežití. Také pokud je patogenní druh příliš úspěšný a ohrožuje přežití a reprodukční úspěch hostitelských rostlin, riskují patogenní houby ztrátu zdroje živin pro budoucí generace. Tyto faktory vytvářejí dynamiku, která formuje evoluční změny v obou druzích generace po generaci.[166]
Geny, které kódují obranné mechanismy v rostlinách, se musí neustále měnit, aby držely krok s parazitem, který neustále pracuje na vyhýbání se obraně. Geny, které kódují mechanismy připevnění, jsou nejdynamičtější a přímo souvisejí s únikovou schopností hub.[167] Čím větší jsou změny v těchto genech, tím větší jsou změny v mechanismu připevnění. Po selektivních silách na výsledné fenotypy dochází k evoluční změně, která podporuje únik obrany hostitele.
Houby se nejen vyvíjejí, aby se vyhnuly obranyschopnosti rostlin, ale také se snaží zabránit rostlině v uzákonění mechanismů pro zlepšení její obrany. Cokoli, co houby mohou udělat pro zpomalení procesu evoluce hostitelských rostlin, zlepší kondici budoucích generací, protože rostlina nebude schopna držet krok s evolučními změnami parazita. Jedním z hlavních procesů, kterými se rostliny rychle vyvíjejí v reakci na životní prostředí, je sexuální reprodukce. Bez pohlavního rozmnožování by nebylo možné rozšířit výhodné vlastnosti rostlinnou populací tak rychle, aby houby získaly konkurenční výhodu. Z tohoto důvodu jsou pohlavní reprodukční orgány rostlin terčem útoků hub. Studie ukázaly, že mnoho různých současných druhů obligátních parazitických rostlinných hub vyvinulo mechanismy, které zabraňují nebo jinak ovlivňují pohlavní rozmnožování rostlin. Pokud bude úspěšný, proces pohlavní reprodukce se u rostliny zpomalí, čímž se zpomalí evoluční změna, nebo v extrémních případech mohou houby způsobit, že rostlina bude sterilní, což zvýhodní patogeny. Není přesně známo, jak se tento adaptivní rys vyvinul u hub, ale je zřejmé, že vztah k rostlině si vynutil vývoj procesu.[168]
Někteří vědci také studují, jak řada faktorů ovlivňuje rychlost evolučních změn a výsledky změn v různých prostředích. Například, stejně jako u většiny evolucí, zvyšování dědičnosti v populaci umožňuje větší evoluční reakci za přítomnosti selektivního tlaku. U vlastností specifických pro koevoluci rostlin a hub vědci zkoumali, jak virulence napadajícího patogenu ovlivňuje koevoluci. Studie zahrnující Mycosphaerella graminicola důsledně prokázali, že virulence patogenu nemá významný dopad na evoluční stopu hostitelské rostliny.[169]
Proces koevoluce mohou ovlivnit i další faktory. Například u malých populací je výběr relativně slabší silou na populaci kvůli genetický drift. Genetický drift zvyšuje pravděpodobnost vzniku pevných alel, což snižuje genetickou variabilitu populace. Pokud tedy v oblasti se schopností společné reprodukce existuje pouze malá populace rostlin, může genetický drift působit proti účinkům selekce, která způsobí, že rostlina bude v nevýhodném postavení pro houby, které se mohou vyvíjet normální rychlostí. Rozptyl v hostitelské i patogenní populaci je hlavním determinantem evolučního úspěchu ve srovnání s jinými druhy. Čím větší je genetická odchylka, tím rychleji se druh může vyvinout, aby působil proti vyhýbání se nebo obranným mechanismům jiného organismu.[165]
Vzhledem k procesu opylování rostlin je efektivní velikost populace obvykle větší než u hub, protože opylovači mohou spojovat izolované populace způsobem, který houba není schopna. To znamená, že pozitivní vlastnosti, které se vyvíjejí v nesousedících, ale blízkých oblastech, lze předat do blízkých oblastí. Houby se musí individuálně vyvíjet, aby se vyhnuly obraně hostitele v každé oblasti. To je zjevně jasná konkurenční výhoda pro hostitelské rostliny. Sexuální reprodukce se širokou populací s vysokou variabilitou vede k rychlým evolučním změnám a vyššímu reprodukčnímu úspěchu potomků.[170]
V evolučních výsledcích hraje roli také prostředí a klimatické vzorce. Studie s duby a obligátním houbovým parazitem v různých nadmořských výškách tento rozdíl jasně ukazují. U stejného druhu měly různé výškové polohy drasticky odlišné rychlosti evoluce a změny v reakci na patogeny způsobené organismem, a to i v selektivním prostředí vzhledem k jejich okolí.[171]
Koevoluce je proces, který souvisí s hypotéza červené královny. Hostitelská rostlina i parazitické houby musí i nadále přežít, aby zůstali ve svém ekologickém výklenku. Pokud se jeden ze dvou druhů ve vztahu vyvíjí podstatně rychlejším tempem než druhý, pomalejší druhy budou v konkurenční nevýhodě a riskují ztrátu živin. Jelikož jsou tyto dva druhy v systému tak úzce propojeny, reagují společně na vnější faktory prostředí a každý druh ovlivňuje vývoj druhého. Jinými slovy, každý druh vyvíjí na druhý selektivní tlak. Velikost populace je také hlavním faktorem výsledku, protože rozdíly v toku genů a genetickém driftu mohou způsobit evoluční změny, které neodpovídají směru výběru očekávanému silami způsobenými jiným organismem. Koevoluce je důležitým jevem nezbytným pro pochopení zásadního vztahu mezi rostlinami a jejich houbovými parazity.
Viz také
- Rostliny
- Obecný vývoj
- Studium rostlin
- Interakce rostlin
- Nové trendy
Reference
- ^ T. Cavalier Smith 2007, Vývoj a vztahy hlavních větví řas stromu života. od: Odhalení řas, Brodie & Lewis. CRC Press
- ^ Ševčíková, Tereza; et al. (2015). „Aktualizace evolučních vztahů s řasami pomocí sekvenování plastidového genomu“. Vědecké zprávy. 5: 10134. Bibcode:2015NatSR ... 510134S. doi:10.1038 / srep10134. PMC 4603697. PMID 26017773.
- ^ Theodor Cole a Hartmut Hilger 2013 Fylogeneze mechorostů Archivováno 2015-11-23 na Wayback Machine
- ^ Theodor Cole a Hartmut Hilger 2013 Fylogeneze trachaeofytů Archivováno 04.03.2016 na Wayback Machine
- ^ Theodor Cole a Hartmut Hilger 2015 Angiosperm Phylogeny, Systematika kvetoucích rostlin. Freie Universität Berlin
- ^ A b C d E F G h i j k l m Stewart, W.N .; Rothwell, G.W. (1993). Paleobotanika a vývoj rostlin (2. vyd.). Cambridge University Press. ISBN 978-0-521-23315-6.
- ^ A b Strother, Paul K .; Battison, Leila; Brasier, Martin D .; Wellman, Charles H. (2011). „Nejčasnější mimomořští eukaryoti Země“. Příroda. 473 (7348): 505–509. Bibcode:2011Natur.473..505S. doi:10.1038 / nature09943. PMID 21490597. S2CID 4418860.
- ^ A b C Knauth, L. Paul; Kennedy, Martin J. (2009). „Pozdní prekambrijská ekologizace Země“. Příroda. 460 (7256): 728–732. Bibcode:2009Natur.460..728K. doi:10.1038 / nature08213. PMID 19587681. S2CID 4398942.
- ^ Rothwell, G. W .; Scheckler, S.E .; Gillespie, W. H. (1989). "Elkinsia gen. nov., pozdně devonský gymnosperm s kupulárními vajíčky “. Botanický věstník. 150 (2): 170–189. doi:10.1086/337763. S2CID 84303226.
- ^ A b P. Kenrick, P.R. Crane (1997) (1997). Původ a časná diverzifikace suchozemských rostlin. Kladistická studie. Smithsonian Institution Press, Washington a Londýn. Washington: Smithsonian Inst. Lis. ISBN 978-1-56098-729-1.
- ^ A b C d E F G h i j k l m n Raven, J. A.; Edwards, D. (2001). „Kořeny: evoluční původ a biogeochemický význam“. Journal of Experimental Botany. 52 (90001): 381–401. doi:10.1093 / jexbot / 52.suppl_1.381. PMID 11326045.
- ^ Del-Bem, L. E. (2018). „Evoluce xyloglukanu a terrestrializace zelených rostlin“. Nový fytolog. 219 (4): 1150–1153. doi:10.1111 / nph.15191. PMID 29851097.
- ^ Heckman, D. S .; Geiser, D. M .; Eidell, B. R .; Stauffer, R.L .; Kardos, N.L .; Hedges, S. B. (srpen 2001). "Molekulární důkazy pro časnou kolonizaci půdy houbami a rostlinami". Věda. 293 (5532): 1129–1133. doi:10.1126 / science.1061457. ISSN 0036-8075. PMID 11498589. S2CID 10127810.
- ^ Battison, Leila; Brasier, Martin D. (srpen 2009). „Výjimečná ochrana raných suchozemských komunit v lacustrinfosfátu před jednou miliardou let“ (PDF). In Smith, Martin R .; O'Brien, Lorna J .; Caron, Jean-Bernard (eds.). Abstraktní svazek. Mezinárodní konference o kambrijské explozi (Walcott 2009). Toronto, Ontario, Kanada: The Burgess Shale Consortium (zveřejněno 31. července 2009). ISBN 978-0-9812885-1-2.
- ^ Battistuzzi, F. U .; Feijao, A .; Hedges, S. B. (2004). „Genomická časová osa evoluce prokaryot: pohledy na původ methanogeneze, fototrofie a kolonizace půdy“. BMC Evoluční biologie. 4: 44. doi:10.1186/1471-2148-4-44. PMC 533871. PMID 15535883.
- ^ Strother, P.K .; Al ‐ Hajri, S .; Traverse, A. (1996). „Nové důkazy o suchozemských rostlinách ze spodního středního ordoviku Saúdské Arábie“. Geologie. 24 (1): 55–59. Bibcode:1996Geo .... 24 ... 55S. doi:10.1130 / 0091-7613 (1996) 024 <0055: NEFLPF> 2.3.CO; 2.
- ^ Rubinstein, C. V .; Gerrienne, P .; de la Puente, G. S .; Astini, R. A .; Steemans, P. (2010). „Počátky raného středního ordoviku pro pozemní rostliny v Argentině (východní Gondwana)“. Nový fytolog. 188 (2): 365–369. doi:10.1111 / j.1469-8137.2010.03433.x. PMID 20731783.
- ^ Wellman, Charles H .; Osterloff, Peter L .; Mohiuddin, Uzma (2003). „Fragmenty prvních suchozemských rostlin“ (PDF). Příroda. 425 (6955): 282–285. Bibcode:2003 Natur.425..282W. doi:10.1038 / nature01884. PMID 13679913. S2CID 4383813.
- ^ Steemans, P .; Lepota K .; Marshallb, C.P .; Le Hérisséc, A .; Javauxa, E.J. (2010). "FTIR charakterizace chemického složení silurských miospor (kryptospor a výtrusů trilete) z Gotlandu ve Švédsku". Recenze paleobotaniky a palynologie. 162 (4): 577–590. doi:10.1016 / j.revpalbo.2010.07.006.
- ^ Kump, L. R .; Pavlov, A .; Arthur, M. A. (2005). „Masivní uvolňování sirovodíku do povrchového oceánu a atmosféry v intervalech oceánské anoxie“. Geologie. 33 (5): 397. Bibcode:2005Geo .... 33..397 tis. doi:10.1130 / G21295.1.
- ^ Butterfield, N. J. (2009). „Kyslík, zvířata a oceánská ventilace: alternativní pohled“. Geobiologie. 7 (1): 1–7. doi:10.1111 / j.1472-4669.2009.00188.x. PMID 19200141.
- ^ Steemans, P .; Herisse, L .; Melvin, J .; Miller, A .; Paris, F .; Verniers, J .; Wellman, H. (duben 2009). „Původ a záření nejstarších cévnatých rostlin“. Věda. 324 (5925): 353. Bibcode:2009Sci ... 324..353S. doi:10.1126 / science.1169659. ISSN 0036-8075. PMID 19372423. S2CID 206518080.
- ^ Rubinstein, Claudia; Vajda, Vivi (2019). „Kolébka raných suchozemských rostlin Baltica? Nejstarší záznamy o triletních sporách a rozmanitých kryptosporových seskupeních; důkazy z ordovických následnictví Švédska“. GFF (Journal of the Geological Society of Sweden). 141 (3): 181–190. doi:10.1080/11035897.2019.1636860.
- ^ A b C Gray, J .; Chaloner, W. G .; Westoll, T. S. (1985). „Mikrofosilní záznam raných pozemkových rostlin: pokrok v porozumění rané terrestrializaci, 1970–1984“. Filozofické transakce královské společnosti B. 309 (1138): 167–195. Bibcode:1985RSPTB.309..167G. doi:10.1098 / rstb.1985.0077. JSTOR 2396358.
- ^ Tomescu, A. M. F. (2006). „Mokřady před tracheofyty: Thalloidní suchozemská společenství bioty raně silurské pasáže Creek (Virginie)“. Mokřady v čase (PDF). doi:10.1130/2006.2399(02). ISBN 9780813723990 http://www.humboldt.edu/biosci/docs/faculty/TomescuRothwell2006.pdf. Citováno 2014-05-28. Chybějící nebo prázdný
| název =(Pomoc) - ^ Tomescu, A. M. F .; Honegger, R .; Rothwell, G. W. (2008). „Nejstarší fosilní záznamy konsorcií bakteriální-sinice: raná biota z počátku Silurian Passage Creek (440 Ma, Virginie, USA)“. Geobiologie. 6 (2): 120–124. doi:10.1111 / j.1472-4669.2007.00143.x. PMID 18380874.
- ^ „První suchozemské rostliny a houby změnily zemské klima a připravily tak cestu explozivnímu vývoji suchozemských zvířat, navrhuje nová genová studie“. science.psu.edu. Citováno 9. dubna 2018.
- ^ Glasspool, IJ; Edwards, D; Axe, L (2004). „Dřevěné uhlí ve Siluru jako důkaz nejranějšího požáru“. Geologie. 32 (5): 381–383. Bibcode:2004Geo .... 32..381G. doi:10.1130 / G20363.1.
- ^ Bernstein, H; Byers, GS; Michod, RE (1981). „Evoluce sexuální reprodukce: Důležitost opravy DNA, komplementace a variace“. Americký přírodovědec. 117 (4): 537–549. doi:10.1086/283734. S2CID 84568130.
- ^ Michod, RE; Gayley, TW (1992). "Maskování mutací a vývoj pohlaví". Americký přírodovědec. 139 (4): 706–734. doi:10.1086/285354. S2CID 85407883.
- ^ Szövényi, Péter; Ricca, Mariana; Hock, Zsófia; Shaw, Jonathan A .; Shimizu, Kentaro K. & Wagner, Andreas (2013). „Výběr není u haploidů účinnější než u diploidních životních stadií krytosemenných rostlin a mechů.“. Molekulární biologie a evoluce. 30 (8): 1929–39. doi:10,1093 / molbev / mst095. PMID 23686659.
- ^ A b C d Boyce, C. K. (2008). „Jak zelená byla Cooksonia? Význam velikosti pro pochopení raného vývoje fyziologie v linii cévnatých rostlin ". Paleobiologie. 34 (2): 179–194. doi:10.1666 / 0094-8373 (2008) 034 [0179: HGWCTI] 2.0.CO; 2. ISSN 0094-8373.
- ^ Kerp, H .; Trewin, N.H .; Hass, H. (2004). "Nové gametofyty z raně devonského rohy Rhynie". Transakce Royal Society of Edinburgh. 94 (4): 411–428. doi:10.1017 / s026359330000078x.
- ^ Taylor, T.N .; Kerp, H .; Hass, H. (2005). "Biologie historie raných suchozemských rostlin: dešifrování fáze gametofytů". Sborník Národní akademie věd Spojených států amerických. 102 (16): 5892–5897. Bibcode:2005PNAS..102.5892T. doi:10.1073 / pnas.0501985102. PMC 556298. PMID 15809414.
- ^ Holloway, John E. (1939). „Gametofyt, embryo a mladý oddenek Psilotum triquetrum (Swartz) ". Annals of Botany. 3 (2): 313–336. doi:10.1093 / oxfordjournals.aob.a085063.
- ^ Kidston, R. & Lang, W.H. (1920), „Na rostlinách ze starého červeného pískovce, které vykazují strukturu, z postele Rhynie Chert, Aberdeenshire. Část II. Další poznámky k Rhynia gwynne-vaughaniKidston a Lang; s popisem Rhynia major, n.sp. a Hornea lignieri, n.g., n.sp ", Transakce Royal Society of Edinburgh, 52 (3): 603–627, doi:10.1017 / s0080456800004488
- ^ Remy, W .; Taylor, T.N .; Hass, H .; Kerp, H. (1994). „4 miliony let staré vezikulárně-arbuskulární mykorhizy“. Sborník Národní akademie věd Spojených států amerických. 91 (25): 11841–11843. Bibcode:1994PNAS ... 9111841R. doi:10.1073 / pnas.91.25.11841. PMC 45331. PMID 11607500.
- ^ Schüßler, A .; et al. (2001). „Nový houbový kmen, Glomeromycota: fylogeneze a evoluce ". Mycol. Res. 105 (12): 1416. doi:10.1017 / S0953756201005196.
- ^ A b Smith, Sally E .; Přečtěte si, David J. (2008). Mykorhizní symbióza (3. vyd.). Akademický tisk. ISBN 9780123705266.
- ^ Simon, L .; Bousquet, J .; Lévesque, R.C .; Lalonde, M. (1993). "Původ a diverzifikace endomykorhizních hub a shoda s cévnatými suchozemskými rostlinami". Příroda. 363 (6424): 67–69. Bibcode:1993Natur.363 ... 67S. doi:10.1038 / 363067a0. S2CID 4319766.
- ^ Simon, L .; Bousquet, J .; Lévesque, R. C .; Lalonde, M. (1993). "Původ a diverzifikace endomykorhizních hub a shoda s cévnatými suchozemskými rostlinami". Příroda. 363 (6424): 67–69. Bibcode:1993Natur.363 ... 67S. doi:10.1038 / 363067a0. S2CID 4319766.
- ^ Humphreys, C. P .; Franks, P. J .; Rees, M .; Bidartondo, M. I .; Leake, J. R .; Beerling, D. J. (2010). „Mutualistická mykorhizická symbióza v nejstarší skupině suchozemských rostlin“. Příroda komunikace. 1 (8): 103. Bibcode:2010NatCo ... 1E.103H. doi:10.1038 / ncomms1105. PMID 21045821.
- ^ Brundrett, M. C. (2002). "Koevoluce kořenů a mykorhiz z suchozemských rostlin". Nový fytolog. 154 (2): 275–304. doi:10.1046 / j.1469-8137.2002.00397.x.
- ^ A b C d E F G h i j k l m n Ó str q r Sperry, J. S. (2003). "Vývoj vodní dopravy a xylemové struktury". International Journal of Plant Sciences. 164 (3): S115 – S127. doi:10.1086/368398. JSTOR 3691719. S2CID 15314720.
- ^ A b C d Raven, John (1977). "Vývoj cévnatých suchozemských rostlin ve vztahu k procesům supracelulárního transportu". Pokroky v botanickém výzkumu. 1977: 153–219. doi:10.1016 / S0065-2296 (08) 60361-4. ISBN 9780120059058.
- ^ Qiu, Y.L .; Li, L .; Wang, B .; Chen, Z .; Knoop, V .; Groth-malonek, M .; Dombrovská, O .; Lee, J .; Kent, L .; Rest, J .; et al. (2006). „Nejhlubší rozdíly v rostlinách odvozené z fylogenomických důkazů“. Sborník Národní akademie věd. 103 (42): 15511–6. Bibcode:2006PNAS..10315511Q. doi:10.1073 / pnas.0603335103. PMC 1622854. PMID 17030812.
- ^ Edwards, D .; Davies, K.L .; Axe, L. (1992). „Cévně vodivý řetězec v rané suchozemské rostlině Cooksonia". Příroda. 357 (6380): 683–685. Bibcode:1992 Natur.357..683E. doi:10.1038 / 357683a0. S2CID 4264332.
- ^ Niklas, K. J .; Smocovitis, V. (1983). „Důkazy pro vodivý pramen v ranně silurských (llandoverovských) rostlinách: důsledky pro vývoj suchozemských rostlin“. Paleobiologie. 9 (2): 126–137. doi:10.1017 / S009483730000751X. JSTOR 2400461. S2CID 35550235.
- ^ A b C d E Niklas, K. J. (1985). „Vývoj průměru tracheidů v časných cévních rostlinách a jeho důsledky pro hydraulickou vodivost primárního pramene Xylem“. Vývoj. 39 (5): 1110–1122. doi:10.2307/2408738. JSTOR 2408738. PMID 28561493.
- ^ Niklas, K .; Pratt, L. (1980). „Důkazy o složkách podobných ligninu ve fosilních rostlinách raného siluru (Llandoverian)“. Věda. 209 (4454): 396–397. Bibcode:1980Sci ... 209..396N. doi:10.1126 / science.209.4454.396. PMID 17747811. S2CID 46073056.
- ^ Pittermann J .; Sperry J.S .; Hacke U.G .; Wheeler J.K .; Sikkema E.H. (Prosinec 2005). „Jámy Torus-Margo pomáhají jehličnanům soutěžit s krytosemennými rostlinami“. Vědecký časopis. 310 (5756): 1924. doi:10.1126 / science.1120479. PMID 16373568.
- ^ Proč vánoční stromky nevymřely
- ^ A b Kenrick, Paul (2001). "Převrácení nového listu". Příroda. 410 (6826): 309–310. Bibcode:2001 Natur.410..309K. doi:10.1038/35066649. PMID 11268183. S2CID 4335355.
- ^ A b C Beerling D.; Osborne, C. P .; Chaloner, W. G. (2001). „Vývoj listové formy v suchozemských rostlinách spojený s atmosférickým CO2 úpadek v pozdní paleozoice “ (PDF). Příroda. 410 (6826): 352–354. Bibcode:2001 Natur.410..352B. doi:10.1038/35066546. PMID 11268207. S2CID 4386118.
- ^ Crane, P.R .; Kenrick, P. (1997). „Odkloněný vývoj reprodukčních orgánů: Zdroj morfologické inovace v suchozemských rostlinách“. Systematika a evoluce rostlin. 206 (1): 161–174. doi:10.1007 / BF00987946. S2CID 23626358.
- ^ Zimmermann, W. (1959). Die Phylogenie der Pflanzen (2. vyd.). Stuttgart: Gustav Fischer Verlag.
- ^ Piazza, P .; et al. (2005). "Vývoj mechanismů vývoje listů". Nový Phytol. 167 (3): 693–710. doi:10.1111 / j.1469-8137.2005.01466.x. PMID 16101907.
- ^ Hagemann, W. 1976. Sind Farne Kormophyten? Eine Alternative zur Telomtheorie.Plant Systematika a evoluce 124: 251–277.
- ^ Hagemann, W (1999). „Směrem k organickému konceptu suchozemských rostlin: marginální blastozon a vývoj vegetačního těla vybraných frondózních gametofytů játrovek a kapradin“. Systematika a evoluce rostlin. 216 (1–2): 81–133. doi:10.1007 / bf00985102. S2CID 21483458.
- ^ Sattler, R (1992). "Morfologie procesu: strukturální dynamika ve vývoji a vývoji". Canadian Journal of Botany. 70 (4): 708–714. doi:10.1139 / b92-091.
- ^ Sattler, R. 1998. O původu symetrie, větvení a fylotaxe v suchozemských rostlinách. In: R.V. Jean a D. Barabé (eds) Symetrie v rostlinách. World Scientific, Singapur, s. 775-793.
- ^ James, P.J. (2009). "'Strom a list ': Jiný úhel ". Linnean. 25: 17.
- ^ „Pohled na CO2 teorie rané evoluce listů “. Archivovány od originál dne 29.06.2011. Citováno 2011-03-08.
- ^ Kotyk, ME; Basinger, JF; Gensel, PG; de Freitas, TA (2002). „Morfologicky složitá rostlinná makrofosílie z pozdního siluru v arktické Kanadě“. American Journal of Botany. 89 (6): 1004–1013. doi:10,3732 / ajb.89.6.1004. PMID 21665700.
- ^ Rickards, R.B. (2000). „Věk nejstarších mechů klubu: flóra silurian Baragwanathia ve Victorii v Austrálii“ (abstraktní). Geologický časopis. 137 (2): 207–209. Bibcode:2000 GeoM..137..207R. doi:10.1017 / S0016756800003800. Citováno 2007-10-25.
- ^ A b C d E Kaplan, D.R. (2001). „The Science of Plant Morfhology: Definition, History, and Role in Modern Biology“. American Journal of Botany. 88 (10): 1711–1741. doi:10.2307/3558347. JSTOR 3558347. PMID 21669604.
- ^ Taylor, T.N .; Hass, H .; Kerp, H .; Krings, M .; Hanlin, R.T. (2005). "Perithecial ascomycetes od 400 milionů let staré Rhynie chert: příklad rodového polymorfismu". Mykologie. 97 (1): 269–285. doi:10,3852 / mycologia.97.1.269. hdl:1808/16786. PMID 16389979.
- ^ A b C Boyce, C. K.; Knoll, A.H. (2002). „Evoluce vývojového potenciálu a mnohonásobný nezávislý původ listů v prvohorních cévnatých rostlinách“. Paleobiologie. 28 (1): 70–100. doi:10.1666 / 0094-8373 (2002) 028 <0070: EODPAT> 2.0.CO; 2. ISSN 0094-8373.
- ^ Hao, S .; Beck, C.B .; Deming, W. (2003). „Struktura nejranějších listů: adaptace na vysokou koncentraci atmosféry CO
2". International Journal of Plant Sciences. 164 (1): 71–75. doi:10.1086/344557. S2CID 84741832. - ^ Berner, R.A .; Kothavala, Z. (2001). „Geocarb III: Revidovaný model atmosféry CO
2 přes fanerozoický čas “. American Journal of Science. 301 (2): 182–204. Bibcode:2001AmJS..301..182B. CiteSeerX 10.1.1.393.582. doi:10.2475 / ajs.301.2.182. Archivovány od originál (abstraktní) dne 29. 1. 2009. Citováno 2008-04-07. - ^ Taylor, T.N .; Taylor, E.L. (1993). „Biologie a vývoj fosilních rostlin“. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Shellito, C.J .; Sloan, L.C. (2006). „Rekonstrukce ztraceného eocénního ráje: Část I. Simulace změny v globálním rozložení květin při počátečním tepelném maximu eocénu“. Globální a planetární změna. 50 (1–2): 1–17. Bibcode:2006GPC .... 50 .... 1S. doi:10.1016 / j.gloplacha.2005.08.001.
- ^ Aerts, R. (1995). "Výhody stálezelené". Trendy v ekologii a evoluci. 10 (10): 402–407. doi:10.1016 / S0169-5347 (00) 89156-9. PMID 21237084.
- ^ Labandeira, C.C .; Dilcher, D.L .; Davis, D.R .; Wagner, D.L. (1994). „Devadesát sedm milionů let asociace krytosemenných hmyzu: paleobiologický pohled na význam koevoluce“. Sborník Národní akademie věd Spojených států amerických. 91 (25): 12278–12282. Bibcode:1994PNAS ... 9112278L. doi:10.1073 / pnas.91.25.12278. PMC 45420. PMID 11607501.
- ^ Brown V; et al. (1991). "Herbivory a vývoj velikosti a tvaru listů". Filozofické transakce královské společnosti B. 333 (1267): 265–272. doi:10.1098 / rstb.1991.0076.
- ^ Harrison C. J .; et al. (2005). "Nezávislý nábor konzervovaného vývojového mechanismu během evoluce listu". Příroda. 434 (7032): 509–514. Bibcode:2005 Natur.434..509H. doi:10.1038 / nature03410. PMID 15791256. S2CID 4335275.
- ^ Jackson D .; Hake S. (1999). "Kontrola fylotaxyskupiny v kukuřici genem ABPHYL1". Rozvoj. 126 (2): 315–323. PMID 9847245.
- ^ Cronk Q. (2001). „Evoluce a vývoj rostlin v postgenomickém kontextu“. Genetika hodnocení přírody. 2 (8): 607–619. doi:10.1038/35084556. PMID 11483985. S2CID 22929939.
- ^ Tattersall; et al. (2005). „Mutant Crispa odhaluje více rolí pro PHANTASTICA při vývoji listů hrachové směsi“. Rostlinná buňka. 17 (4): 1046–1060. doi:10.1105 / tpc.104.029447. PMC 1087985. PMID 15749758.
- ^ Bharathan, Geeta; Sinha, Neelima Roy (Prosinec 2001). „Regulace vývoje složených listů“. Plant Physiol. 127 (4): 1533–1538. doi:10.1104 / pp.010867. PMC 1540187. PMID 11743098.
- ^ Nath, U; Crawford, BC; Carpenter, R; et al. (2003). "Genetická kontrola zakřivení povrchu". Věda. 299 (5611): 1404–1407. CiteSeerX 10.1.1.625.1791. doi:10.1126 / science.1079354. PMID 12610308. S2CID 8059321.
- ^ Li, Chao; Zhang, Baohong (únor 2016). "MicroRNA v řízení vývoje rostlin". Journal of Cellular Physiology. 231 (2): 303–13. doi:10.1002 / jcp.25125. PMID 26248304. S2CID 23434501.
- ^ Mecchia, MA; Debernardi, JM; Rodriguez, RE; Schommer, C; Palatnik, JF (leden 2013). „MicroRNA miR396 a RDR6 synergicky regulují vývoj listů“. Mechanismy rozvoje. 130 (1): 2–13. doi:10.1016 / j.mod.2012.07.005. PMID 22889666.
- ^ de Souza, Rocheli; Ambrosini, Adriana; Passaglia, Luciane M.P. (Prosinec 2015). „Bakterie podporující růst rostlin jako očkovací látky v zemědělských půdách“. Genetika a molekulární biologie. 38 (4): 401–19. doi:10.1590 / S1415-475738420150053. PMC 4763327. PMID 26537605.
- ^ Mora, C.I .; Driese, S.G .; Colarusso, L.A. (1996). „Střední až pozdní paleozoické atmosférické CO
2 Úrovně z uhličitanu půdy a organických látek ". Věda. 271 (5252): 1105–1107. Bibcode:1996Sci ... 271.1105M. doi:10.1126 / science.271.5252.1105. S2CID 128479221. - ^ Berner, R.A. (1994). „GEOCARB II: Revidovaný model atmosféry CO
2 během fanerozoického času “. Dopoledne. J. Sci. 294 (1): 56–91. Bibcode:1994AmJS..294 ... 56B. doi:10,2475 / ajs.294.1.56. - ^ A b Algeo, T.J .; Berner, R.A .; Maynard, J.B .; Scheckler, S.E .; Archivy, G.S.A.T. (1995). „Pozdní devonské oceánské anoxické události a biotické krize:„ zakořeněné “ve vývoji cévnatých suchozemských rostlin?“. GSA dnes. 5 (3).
- ^ Retallack, G. J. (1986). Wright, V. P. (ed.). Paleosoly: jejich uznání a interpretace. Oxford: Blackwell.
- ^ "Tracheophyta - 2". Paleos - život v hlubokém čase.
- ^ Richard M. Bateman, Peter R. Crane, William A. DiMichele, Paul R. Kenrick, Nick P. Rowe, Thomas Speck a William E. Stein (1998). „VČASNÝ VÝVOJ POZEMKOVÝCH ROSTLIN: Fylogeneze, fyziologie a ekologie primárního pozemského záření“. Výroční přehled ekologie a systematiky. 29: 263–292. doi:10.1146 / annurev.ecolsys.29.1.263. S2CID 44508826.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Hetherington, Alexander J; Dolan, Liam (2017). „Bilaterálně symetrické osy s rhizoidy tvořily kořenovou strukturu společného předka cévnatých rostlin“. Filozofické transakce Královské společnosti B: Biologické vědy. 373 (1739): 20170042. doi:10.1098 / rstb.2017.0042. PMC 5745339. PMID 29254968.
- ^ A b C d E F G h i Algeo, T. J.; Scheckler, S.E. (1998). „Pozemní a námořní propojení v devonu: vazby mezi vývojem suchozemských rostlin, procesy zvětrávání a mořskými anoxickými událostmi“. Filozofické transakce královské společnosti B. 353 (1365): 113–130. doi:10.1098 / rstb.1998.0195. PMC 1692181.
- ^ Hetherington, Alexander J .; Dolan, Liam (2018). „Postupný a nezávislý původ kořenů mezi suchozemskými rostlinami“. Příroda. 561 (7722): 235–238. Bibcode:2018Natur.561..235H. doi:10.1038 / s41586-018-0445-z. PMC 6175059. PMID 30135586.
- ^ Coudert, Yoan; Anne Dievart; Gaetan Droc; Pascal Gantet (2012). „Fylogeneze ASL / LBD naznačuje, že genetické mechanismy iniciace kořenů po proudu auxinu jsou odlišné v lykofytech a euphyllofytech“. Molekulární biologie a evoluce. 30 (3): 569–72. doi:10,1093 / molbev / mss250. ISSN 0737-4038. PMID 23112232.
- ^ A b Kenrick, P .; Crane, P.R. (1997). "Původ a časný vývoj rostlin na zemi". Příroda. 389 (6646): 33–39. Bibcode:1997 Natur.389 ... 33 tis. doi:10.1038/37918. S2CID 3866183.
- ^ Alain Pierret, Jean-Luc Maeght, Corentin Clément, Jean-Pierre Montoroi, Christian Hartmann, Santimaitree Gonkhamdee (červenec 2016). „Pochopení hlubokých kořenů a jejich funkcí v ekosystémech: obhajoba netradičního výzkumu“. Annals of Botany. 118 (4): 621–635. doi:10.1093 / aob / mcw130. PMC 5055635. PMID 27390351.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Gerrienne, Philippe; Gensel, Patricia G .; Strullu-Derrien, Christine; Lardeux, Hubert; Steemans, Philippe; Prestianni, Cyrille (2011). "Jednoduchý druh dřeva ve dvou raných devonských rostlinách". Věda. 333 (6044): 837. Bibcode:2011Sci ... 333..837G. doi:10.1126 / science.1208882. PMID 21836008. S2CID 23513139.
- ^ Kinver, Mark (16. srpna 2011). "'Rané vzorky dřeva přetvářejí historii rostlin “. BBC novinky.
- ^ Stein, W. E.; Mannolini, F .; Hernick, L.V .; Landing, E .; Berry, C.M. (2007). „Obří cladoxylopsidové stromy řeší záhadu nejstarších lesních pařezů na Zemi v Gilboa.“ Příroda. 446 (7138): 904–7. Bibcode:2007Natur.446..904S. doi:10.1038 / nature05705. PMID 17443185. S2CID 2575688.
- ^ Retallack, G.J .; Catt, J. A.; Chaloner, W.G. (1985). „Fosilní půdy jako důvody pro interpretaci příchodu velkých rostlin a zvířat na souši [a diskuse]“. Filozofické transakce královské společnosti B. 309 (1138): 105–142. Bibcode:1985RSPTB.309..105R. doi:10.1098 / rstb.1985.0074. JSTOR 2396355.
- ^ Dannenhoffer, J.M .; Bonamo, P.M. (1989). "Rellimia thomsonii od Givetiana z New Yorku: Sekundární růst ve třech řádech větvení ". American Journal of Botany. 76 (9): 1312–1325. doi:10.2307/2444557. JSTOR 2444557.
- ^ Davis, P; Kenrick, P. (2004). Fosilní rostliny. Smithsonian Books, Washington D.C. ISBN 978-1-58834-156-3.
- ^ Donoghue, M. J. (2005). „Klíčové inovace, konvergence a úspěch: makroevoluční lekce z fylogeneze rostlin“ (abstraktní). Paleobiologie. 31 (2): 77–93. doi:10.1666 / 0094-8373 (2005) 031 [0077: KICASM] 2.0.CO; 2. ISSN 0094-8373. Citováno 2008-04-07.
- ^ A b C Bowe, L.M .; Coat, G .; Depamphilis, C.W. (2000). „Fylogeneze semenných rostlin založená na všech třech genomových kompartmentech: Existující gymnospermy jsou monofyletické a Gnetalesovi nejbližší příbuzní jsou jehličnany“. Sborník Národní akademie věd. 97 (8): 4092–7. Bibcode:2000PNAS ... 97.4092B. doi:10.1073 / pnas.97.8.4092. PMC 18159. PMID 10760278.
- ^ A b C Chaw, S.M .; Parkinson, C.L .; Cheng, Y .; Vincent, T. M.; Palmer, J. D. (2000). „Fylogeneze semenných rostlin odvozená ze všech tří rostlinných genomů: Monophyly existujících gymnospermů a původ Gnetales z jehličnanů“. Sborník Národní akademie věd. 97 (8): 4086–91. Bibcode:2000PNAS ... 97.4086C. doi:10.1073 / pnas.97.8.4086. PMC 18157. PMID 10760277.
- ^ A b C Soltis, D.E .; Soltis, P.S .; Zanis, M.J. (2002). „Fylogeneze semenných rostlin na základě důkazů z osmi genů“. American Journal of Botany. 89 (10): 1670–81. doi:10,3732 / ajb.89.10.1670. PMID 21665594. Archivovány od originál (abstraktní) dne 2008-04-12. Citováno 2008-04-08.
- ^ Friis, E.M .; Pedersen, K.R .; Crane, P.R. (2006). "Křídové krytosemenné květiny: Inovace a vývoj v reprodukci rostlin". Paleogeografie, paleoklimatologie, paleoekologie. 232 (2–4): 251–293. Bibcode:2006PPP ... 232..251F. doi:10.1016 / j.palaeo.2005.07.006.
- ^ A b Hilton, J .; Bateman, R.M. (2006). „Pteridospermy jsou páteří fylogeneze semenných rostlin“. The Journal of the Torrey Botanical Society. 133 (1): 119–168. doi:10.3159 / 1095-5674 (2006) 133 [119: PATBOS] 2.0.CO; 2. ISSN 1095-5674.
- ^ A b Bateman, R.M .; Hilton, J .; Rudall, P.J. (2006). „Morfologický a molekulární fylogenetický kontext krytosemenných rostlin: kontrastní přístupy„ shora dolů “a„ zdola nahoru “používané k odvození pravděpodobných charakteristik prvních květů“. Journal of Experimental Botany. 57 (13): 3471–503. doi:10.1093 / jxb / erl128. PMID 17056677.
- ^ A b C d Frohlich, M.W .; Chase, M.W. (2007). „Po dvanácti letech pokroku je původ krytosemenných rostlin stále velkou záhadou“. Příroda. 450 (7173): 1184–9. Bibcode:2007 Natur.450.1184F. doi:10.1038 / nature06393. PMID 18097399. S2CID 4373983.
- ^ „Science Magazine“. Runcaria, předchůdce semen středního devonu. Americká asociace pro rozvoj vědy. 2011. Citováno 22. března 2011.
- ^ A b C Mapes, G .; Rothwell, G.W .; Haworth, M.T. (1989). „Vývoj klidu semen“. Příroda. 337 (6208): 645–646. Bibcode:1989 Natur.337..645M. doi:10.1038 / 337645a0. S2CID 4358761.
- ^ Bawa, KS; Webb, CJ (1984). „Potraty květin, plodů a semen u tropických lesních stromů. Důsledky pro vývoj otcovských a mateřských reprodukčních vzorců“. American Journal of Botany. 71 (5): 736–751. doi:10.2307/2443371. JSTOR 2443371.
- ^ Cheah KS, Osborne DJ (duben 1978). "Léze DNA se vyskytují se ztrátou životaschopnosti embryí stárnoucího žitného semene". Příroda. 272 (5654): 593–9. Bibcode:1978Natur.272..593C. doi:10.1038 / 272593a0. PMID 19213149. S2CID 4208828.
- ^ Koppen G, Verschaeve L (2001). „Alkalická jednobuněčná gelová elektroforéza / kometová zkouška: způsob studia opravy DNA v buňkách radikálu klíčící Vicia faba“. Folia Biol. (Praha). 47 (2): 50–4. PMID 11321247.
- ^ Bray CM, West CE (prosinec 2005). „Mechanismy opravy DNA v rostlinách: klíčové senzory a efektory pro udržení integrity genomu“. Nový Phytol. 168 (3): 511–28. doi:10.1111 / j.1469-8137.2005.01548.x. PMID 16313635.
- ^ Bernstein C, Bernstein H. (1991) Stárnutí, sex a oprava DNA. Academic Press, San Diego. ISBN 0120928604 ISBN 978-0120928606
- ^ Feild, T. S .; Brodribb, T. J .; Iglesias, A .; Chatelet, D. S .; Baresch, A .; Upchurch, G. R .; Gomez, B .; Mohr, B. A. R .; Coiffard, C .; Kvacek, J .; Jaramillo, C. (2011). „Fosilní důkazy eskalace křídy v evoluci listové žíly krytosemenných rostlin“. Sborník Národní akademie věd. 108 (20): 8363–8366. Bibcode:2011PNAS..108,8363F. doi:10.1073 / pnas.1014456108. PMC 3100944. PMID 21536892.
- ^ A b Lawton-Rauh, A .; Alvarez-Buylla, E.R .; Purugganan, M.D. (2000). "Molekulární vývoj vývoje květů". Trendy v ekologii a evoluci. 15 (4): 144–149. doi:10.1016 / S0169-5347 (99) 01816-9. PMID 10717683.
- ^ Čínská akademie věd (18. prosince 2018). „Květiny vznikly o 50 milionů let dříve, než se dříve myslelo“. EurekAlert!. Citováno 18. prosince 2018.
- ^ Coiro, Mario; Doyle, James A .; Hilton, Jason (2019-01-25). „Jak hluboký je konflikt mezi molekulárními a fosilními důkazy o věku krytosemenných rostlin?“. Nový fytolog. 223 (1): 83–99. doi:10.1111 / nph.15708. PMID 30681148.
- ^ Nam, J .; Depamphilis, CW; Ma, H; Nei, M (2003). "Starověk a vývoj rodiny genů MADS-Box, která řídí vývoj květin v rostlinách". Mol. Biol. Evol. 20 (9): 1435–1447. doi:10,1093 / molbev / msg152. PMID 12777513.
- ^ A b C Crepet, W. L. (2000). „Pokrok v porozumění historii, úspěchu a vztahům krytosemenných rostlin: Darwinův ohavně“ zmatený fenomén"". Sborník Národní akademie věd. 97 (24): 12939–41. doi:10.1073 / pnas.97.24.12939. PMC 34068. PMID 11087846.
- ^ Sun, G .; Ji, Q .; Dilcher, D.L .; Zheng, S .; Nixon, K.C .; Wang, X. (2002). "Archaefructaceae, nová bazální krytosemenná rodina". Věda. 296 (5569): 899–904. Bibcode:2002Sci ... 296..899S. doi:10.1126 / science.1069439. PMID 11988572. S2CID 1910388.
- ^ Ve skutečnosti, Archaefructus pravděpodobně nenesl pravé květiny: viz
- Friis, E.M .; Doyle, J. A.; Endress, P.K .; Leng, Q. (2003). „Archaefructus - předchůdce krytosemenných rostlin nebo specializovaný časný krytosemenný rostlin?“. Trendy ve vědě o rostlinách. 8 (8): 369–373. doi:10.1016 / S1360-1385 (03) 00161-4. PMID 12927969.
- ^ A b Wing, S.L .; Boucher, L.D. (1998). "Ekologické aspekty radiace kvetoucích rostlin křídy". Výroční přehled o Zemi a planetárních vědách. 26 (1): 379–421. Bibcode:1998AREPS..26..379W. doi:10.1146 / annurev.earth.26.1.379.
- ^ A b Feild, T.S .; Arens, N.C .; Doyle, J. A.; Dawson, T.E .; Donoghue, M. J. (2004). „Temný a narušený: nový obraz ekologie raného krytosemenných rostlin“ (abstraktní). Paleobiologie. 30 (1): 82–107. doi:10.1666 / 0094-8373 (2004) 030 <0082: DADANI> 2.0.CO; 2. ISSN 0094-8373. Citováno 2008-04-08.
- ^ Gabbott, prof. Sarah (1. srpna 2017). „Vypadala první květina takto?“. BBC novinky. Citováno 1. srpna 2017.
- ^ Sauquet, Hervé; et al. (1. srpna 2017). „Rodová květina krytosemenných rostlin a její časná diverzifikace“. Příroda komunikace. 8: 16047. Bibcode:2017NatCo ... 816047S. doi:10.1038 / ncomms16047. PMC 5543309. PMID 28763051.
- ^ Amborella Genome Project (20. prosince 2013). „The Amborella Genom a vývoj kvetoucích rostlin “. Věda. 342 (6165): 1241089. doi:10.1126 / science.1241089. PMID 24357323. S2CID 202600898. Citováno 1. února 2020.
- ^ Zuccolo, A .; et al. (2011). "Fyzická mapa pro Amborella trichopoda genom osvětluje vývoj struktury genomu krytosemenných rostlin “. Genome Biology. 12 (5): R48. doi:10.1186 / gb-2011-12-5-r48. PMC 3219971. PMID 21619600.
- ^ Medarg NG, Yanofsky M (březen 2001). "Funkce a evoluce genové rodiny rostlin MADS-box". Genetika hodnocení přírody. 2 (3): 186–195. doi:10.1038/35056041. PMID 11256070. S2CID 7399106.
- ^ Jager; et al. (2003). „Geny MADS-Box v Ginkgo biloba a vývoj AGAMOUS rodiny“. Mol. Biol. Evol. 20 (5): 842–854. doi:10,1093 / molbev / msg089. PMID 12679535.
- ^ Překladová biologie: Od květů Arabidopsis po architekturu květenství trávy. Beth E. Thompson * a Sarah Hake, 2009, Plant Physiology 149: 38–45.
- ^ Kitahara K, Matsumoto S (2000). "Rose MADS-box geny 'MASAKO C1 a D1' homologní s geny květinové identity třídy C". Plant Science. 151 (2): 121–134. doi:10.1016 / S0168-9452 (99) 00206-X. PMID 10808068.
- ^ Kater M; et al. (1998). „Mnoho AGAMOUS homologů z okurky a petunie se liší v jejich schopnosti vyvolat osud reprodukčních orgánů“. Rostlinná buňka. 10 (2): 171–182. doi:10.1105 / tpc.10.2.171. PMC 143982. PMID 9490741.
- ^ Soltis D; et al. (2007). „Květinový genom: evoluční historie duplikace genů a měnící se vzorce genové exprese“. Trends Plant Sci. 12 (8): 358–367. doi:10.1016 / j.tplantts.2007.06.012. PMID 17658290.
- ^ Putterhill; et al. (2004). „Je čas kvést: genetická kontrola doby květu“. BioEssays. 26 (4): 353–363. doi:10.1002 / bies.20021. PMID 15057934. S2CID 43335309. Archivovány od originál dne 2012-12-16.
- ^ Blazquez; et al. (2001). "Kvetoucí včas: geny, které regulují květinový přechod". Zprávy EMBO. 2 (12): 1078–1082. doi:10.1093 / embo-reports / kve254. PMC 1084172. PMID 11743019.
- ^ Frohlich, Michael W .; Parker, David S. (2000). „The Mostly Male Theory of Flower Evolutionary Origins: from Genes to Fossils“. Syst. Bot. 25 (2): 155–170. doi:10.2307/2666635. JSTOR 2666635. S2CID 85612923.
- ^ Li A, Mao L (2007). „Vývoj rostlinných genových rodin mikroRNA“. Cell Research. 17 (3): 212–218. doi:10.1038 / sj.cr.7310113. PMID 17130846.
- ^ Doebley J.F. (2004). „Genetika vývoje kukuřice“. Annu. Genet. 38 (1): 37–59. doi:10.1146 / annurev.genet.38.072902.092425. PMID 15568971.
- ^ Purugannan; et al. (2000). „Variace a výběr v květnatém homeotickém genu CAULIFLOWER doprovázejícím vývoj domestikované rostliny Brassica olerace“. Genetika. 155 (2): 855–862. PMC 1461124. PMID 10835404.
- ^ A b Williams BP, Johnston IG, Covshoff S, Hibberd JM (září 2013). „Fenotypový závěr krajiny odhaluje několik evolučních cest k fotosyntéze C₄“. eLife. 2: e00961. doi:10,7554 / eLife.00961. PMC 3786385. PMID 24082995.
- ^ Christin, P. -A .; Osborne, C. P .; Chatelet, D. S .; Columbus, J. T .; Besnard, G .; Hodkinson, T. R .; Garrison, L. M.; Vorontsova, M. S.; Edwards, E. J. (2012). "Anatomical enablers and the evolution of C4 photosynthesis in grasses". Sborník Národní akademie věd. 110 (4): 1381–1386. Bibcode:2013PNAS..110.1381C. doi:10.1073/pnas.1216777110. PMC 3557070. PMID 23267116.
- ^ A b C d Osborne, C.P.; Beerling, D.J. (2006). "Review. Nature's green revolution: the remarkable evolutionary rise of C4 plants" (PDF). Filozofické transakce královské společnosti B. 361 (1465): 173–194. doi:10.1098 / rstb.2005.1737. PMC 1626541. PMID 16553316. Citováno 2008-02-11.[trvalý mrtvý odkaz ]
- ^ A b Retallack, G. J. (1 August 1997). "Neogene Expansion of the North American Prairie". PALAIOS. 12 (4): 380–390. Bibcode:1997Palai..12..380R. doi:10.2307/3515337. ISSN 0883-1351. JSTOR 3515337.
- ^ Thomasson, J.R.; Nelson, M.E.; Zakrzewski, R.J. (1986). "A Fossil Grass (Gramineae: Chloridoideae) from the Miocene with Kranz Anatomy". Věda. 233 (4766): 876–878. Bibcode:1986Sci...233..876T. doi:10.1126/science.233.4766.876. PMID 17752216. S2CID 41457488.
- ^ O'Leary, Marion (May 1988). "Uhlíkové izotopy ve fotosyntéze". BioScience. 38 (5): 328–336. doi:10.2307/1310735. JSTOR 1310735.
- ^ Osborne, P.; Freckleton, P. (Feb 2009). "Ecological selection pressures for C4 photosynthesis in the grasses". Sborník: Biologické vědy. 276 (1663): 1753–1760. doi:10.1098/rspb.2008.1762. ISSN 0962-8452. PMC 2674487. PMID 19324795.
- ^ Bond, W. J.; Woodward, F.I.; Midgley, G.F. (2005). „Globální distribuce ekosystémů ve světě bez ohně“. Nový fytolog. 165 (2): 525–538. doi:10.1111 / j.1469-8137.2004.01252.x. PMID 15720663.
- ^ Above 35% atmospheric oxygen, the spread of fire is unstoppable. Many models have predicted higher values and had to be revised, because there was not a total extinction of plant life.
- ^ Pagani, M .; Zachos, J.C.; Freeman, K.H.; Tipple, B.; Bohaty, S. (2005). "Marked Decline in Atmospheric Carbon Dioxide Concentrations During the Paleogene". Věda. 309 (5734): 600–603. Bibcode:2005Sci...309..600P. doi:10.1126/science.1110063. PMID 15961630. S2CID 20277445.
- ^ Piperno, D.R .; Žaluje, H.D. (2005). „Dinosauři večeřeli na trávě“. Věda. 310 (5751): 1126–8. doi:10.1126 / science.1121020. PMID 16293745. S2CID 83493897.
- ^ Prasad, V.; Stroemberg, C.A.E.; Alimohammadian, H.; Sahni, A. (2005). "Dinosaur Coprolites and the Early Evolution of Grasses and Grazers". Věda. 310 (5751): 1177–1180. Bibcode:2005Sci...310.1177P. doi:10.1126/science.1118806. PMID 16293759. S2CID 1816461.
- ^ Keeley, J.E.; Rundel, P.W. (2005). "Fire and the Miocene expansion of C4 grasslands". Ekologie Dopisy. 8 (7): 683–690. doi:10.1111/j.1461-0248.2005.00767.x.
- ^ A b Retallack, G.J. (2001). "Cenozoic Expansion of Grasslands and Climatic Cooling". Žurnál geologie. 109 (4): 407–426. Bibcode:2001JG....109..407R. doi:10.1086/320791. S2CID 15560105.
- ^ Jin, JP; On, K; Tang, X; Li, Z; Lv, L; Zhao, Y; Luo, J; Gao, G (July 2015). „Transkripční regulační mapa Arabidopsis odhaluje odlišné funkční a evoluční rysy nových transkripčních faktorů“. Molekulární biologie a evoluce. 32 (7): 1767–1773. doi:10.1093 / molbev / msv058. PMC 4476157. PMID 25750178.
- ^ Pichersky E.; Gang D. (2000). "Genetics and biochemistry of secondary metabolites in plants: an evolutionary perspective". Trends Plant Sci. 5 (10): 439–445. doi:10.1016/S1360-1385(00)01741-6. PMID 11044721.
- ^ Nina Theis; Manuel Lerdau (2003). "The evolution of function in plant secondary metabolites". Int. J. Plant Sci. 164 (S3): S93–S102. doi:10.1086/374190. S2CID 85705162.
- ^ Bohlmann J.; et al. (1998). "Plant terpenoid synthases: molecular and phylogenetic analysis". Proc. Natl. Acad. Sci. USA. 95 (8): 4126–4133. Bibcode:1998PNAS ... 95.4126B. doi:10.1073 / pnas.95.8.4126. PMC 22453. PMID 9539701.
- ^ A b Hassani, M.A., Durán, P. and Hacquard, S. (2018) "Microbial interactions within the plant holobiont". Mikrobiom, 6(1): 58. doi:10.1186/s40168-018-0445-0.
 Materiál byl zkopírován z tohoto zdroje, který je k dispozici pod a Mezinárodní licence Creative Commons Attribution 4.0.
Materiál byl zkopírován z tohoto zdroje, který je k dispozici pod a Mezinárodní licence Creative Commons Attribution 4.0. - ^ Lucking, R., Huhndorf, S., Pfister, D.H., Plata, E.R. and Lumbsch, H.T. (2009) "Fungi evolved right on track". Mykologie, 101(6): 810–822. doi:10.3852/09-016.
- ^ Heckman, D.S., Geiser, D.M., Eidell, B.R., Stauffer, R.L., Kardos, N.L. and Hedges, S.B. (2001) "Molecular evidence for the early colonization of land by fungi and plants". Věda, 293(5532): 1129–1133. doi:10.1126/science.1061457.
- ^ A b Capelle, J.; Neema, C. (Nov 2005). "Local adaptation and population structure at a micro-geographical scale of a fungal parasite on its host plant". Journal of Evolutionary Biology. 18 (6): 1445–1454. doi:10.1111/j.1420-9101.2005.00951.x. PMID 16313457. S2CID 12986653.
- ^ A b Burdon, J.J.; Thrall, P.H. (2009). "Co-evolution of plants and their pathogen in natural habitats". Věda. 324 (5928): 755–756. Bibcode:2009Sci...324..755B. doi:10.1126/science.1171663. PMC 2689373. PMID 19423818.
- ^ Sahai, A.S.; Manocha, M.S. (1992). "Chitinases of fungi and plants: their involvement in morphogenesis and host-parasite interaction". Recenze mikrobiologie FEMS. 11 (4): 317–338. doi:10.1111/j.1574-6976.1993.tb00004.x.
- ^ Clay, Keith (1991). "Parasitic castration of plants by fungi". Trendy v ekologii a evoluci. 6 (5): 162–166. doi:10.1016/0169-5347(91)90058-6. PMID 21232447.
- ^ Zhan, J.; Mundt, C.C.; Hoffer, M.E.; McDonald, B.A. (2002). "Local adaptation and effect of host genotype on the rate of pathogen evolution: an experimental test in a plant pathosystem". Journal of Evolutionary Biology. 15 (4): 634–647. doi:10.1046/j.1420-9101.2002.00428.x. S2CID 83662474.
- ^ Delmotte, F.; Bucheli, E.; Shykoff, J.A. (1999). "Host and parasite population structure in a natural plant-pathogen system". Dědičnost. 82 (3): 300–308. doi:10.1038/sj.hdy.6884850. PMID 10336705.
- ^ Desprez-Loustau, M.-L.; Vitasse, Y.; Delzon, S.; Capdevielle, X.; Marcais, B.; Kremer, A. (2010). "Are plant pathogen populations adapted for encounter with their host? A case study of phenological synchrony between oak and an obligate fungal parasite along an altitudinal gradient" (PDF). Journal of Evolutionary Biology. 23 (1): 87–97. doi:10.1111/j.1420-9101.2009.01881.x. PMID 19895655. S2CID 25006120.