RuBisCO - RuBisCO
| Ribulóza-1,5-bisfosfátkarboxyláza oxygenáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 3D zobrazení aktivovaného RuBisCO ze špenátu v otevřené formě s přístupným aktivním webem. Zbytky aktivního místa Lys175 jsou označeny růžově a detail zbytku je poskytnut vpravo pro jeden z monomerů tvořících enzym. | |||||||||
| Identifikátory | |||||||||
| EC číslo | 4.1.1.39 | ||||||||
| Číslo CAS | 9027-23-0 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Ribulóza-1,5-bisfosfátkarboxyláza-oxygenáza, obecně známé pod zkratkami RuBisCo, rubisco,[1] RuBPCasenebo RuBPco, je enzym zapojen do prvního významného kroku roku uhlíková fixace, proces, při kterém atmosférický oxid uhličitý je přeměňován rostlinami a jinými fotosyntetický organismy energeticky bohatý molekuly jako glukóza. Z chemického hlediska katalyzuje karboxylace z ribulóza-1,5-bisfosfát (také známý jako RuBP). Je to pravděpodobně nejhojnější enzym na Zemi.[2][3][4]
Alternativní způsoby fixace uhlíku
RuBisCO je důležité biologicky protože to katalyzuje primární chemická reakce kterými anorganický uhlík vstupuje do biosféra. Zatímco mnoho autotrofních bakterií a archea fixuje uhlík prostřednictvím reduktivní acetyl CoA dráha, 3-hydroxypropionátový cyklus, nebo obrácený Krebsův cyklus, tyto cesty jsou relativně malými přispěvateli ke globální fixaci uhlíku ve srovnání s cestou katalyzovanou RuBisCO. Fosfoenolpyruvátkarboxyláza, na rozdíl od RuBisCO, pouze dočasně fixuje uhlík. S ohledem na jeho důležitost je RuBisCO nejhojnějším proteinem listy, což představuje 50% rozpustného listového proteinu v C3 rostliny (20–30% celkového listového dusíku) a 30% rozpustného listového proteinu v C4 rostliny (5–9% celkového listového dusíku).[4] Vzhledem ke své důležité roli v biosféře, genetické inženýrství o RuBisCO v plodinách je trvalý zájem (viz níže ).
Struktura


V rostlinách řasy, sinice, a fototrofní a chemoautotrofní proteobakterie enzym obvykle sestává ze dvou typů proteinové podjednotky, které se nazývají velký řetězec (L, asi 55 000 Da ) a malý řetěz (S, asi 13 000 Da). The velký řetěz gen (rbcL) je kódován chloroplast DNA v rostlinách.[5] Existuje obvykle několik souvisejících malý řetěz geny v jádro rostlinných buněk a malé řetězce se dovážejí do stromální oddělení chloroplastů z cytosol křížením vnějšího chloroplastová membrána.[6][7] Enzymaticky aktivní Podklad (ribulóza 1,5-bisfosfát) vazebná místa jsou umístěny ve velkém řetězy ta forma dimery ve kterém aminokyseliny z každého velkého řetězce přispívají k vazebným místům. Celkem osm velkých řetězců (= 4 dimery) a osm malých řetězců se sdružuje do většího komplexu asi 540 000 Da.[8] V některých proteobakterie a dinoflageláty byly nalezeny enzymy sestávající pouze z velkých podjednotek.[9]
Hořčík ionty (Mg2+
) jsou potřebné pro enzymatickou aktivitu. Správné umístění Mg2+
v Aktivní stránky enzymu zahrnuje přidání „aktivující“ molekuly oxidu uhličitého (CO
2 ) na a lysin v aktivním místě (tvořící a karbamát ).[10] Mg2+ funguje tak, že řídí deprotonaci zbytku Lys210, což způsobuje, že se zbytek Lys otáčí o 120 stupňů k trans konformer, zmenšující vzdálenost mezi dusíkem Lys a uhlíkem CO
2. Těsná blízkost umožňuje vytvoření kovalentní vazby, která vede k karbamátu.[11] Mg2+ je nejprve umožněno vázat se na aktivní místo rotací His335 do alternativní konformace. Mg2+ je poté koordinován His zbytky aktivního místa (His300, His302, His335) a je částečně neutralizován koordinací tří molekul vody a jejich přeměnou na −ACH.[11] Tato koordinace vede k nestabilnímu komplexu, ale vytváří příznivé prostředí pro vazbu Mg2+. Tvorba karbamátu je podporována zásaditý pH. PH a koncentrace iontů hořčíku v tekutinovém oddělení (v rostlinách, stroma chloroplastů[12]) se zvyšuje ve světle. Je diskutována role změny úrovně pH a iontů hořčíku v regulaci aktivity enzymu RuBisCO níže. Jakmile je karbamát vytvořen, His335 dokončí aktivaci návratem do své původní polohy prostřednictvím teplotních fluktuací.[11]
Enzymatická aktivita

RuBisCO je jedním z mnoha enzymů v Calvinův cyklus. Když Rubisco usnadňuje útok CO2 na uhlíku C2 RuBP a následném štěpení vazby mezi uhlíkem C3 a C2 vznikají 2 molekuly glycerát-3-fosfátu. Převod zahrnuje tyto kroky: enolýza, karboxylace, hydratace, Štěpení vazby C-C a protonace.[13][14][15]
Substráty
Substráty pro RuBisCO jsou ribulóza-1,5-bisfosfát a oxid uhličitý (odlišný od „aktivačního“ oxidu uhličitého).[16] RuBisCO také katalyzuje reakci ribulózy-1,5-bisfosfátu a molekulární kyslík (Ó
2) místo oxidu uhličitého (CO
2). Rozlišování mezi substráty CO2 a O.2 je přičítán různým interakcím substrátu kvadrupólové momenty a vysoká elektrostatické pole spád.[11] Tento gradient je stanoven dimer forma minimálně aktivního RuBisCO, který se svými dvěma složkami poskytuje kombinaci opačně nabitých domén potřebných pro interakci enzymu s O2 a CO
2. Tyto podmínky pomáhají vysvětlit nízkou míru obratu zjištěnou v RuBisCO: Aby se zvýšila síla společnosti elektrické pole nezbytné pro dostatečnou interakci se substráty kvadrupólové momenty, C- a N- koncové segmenty enzymu musí být uzavřeny, což umožňuje izolaci aktivního místa z rozpouštědla a snížení dielektrická konstanta.[17] Tato izolace má významné entropický náklady a má za následek špatnou míru obratu.
Vazba RuBP
Karbamylace e-aminoskupiny Lys201 je stabilizována koordinací s Mg2+.[18] Tato reakce zahrnuje vazbu karboxylátových konců Asp203 a Glu204 na Mg2+ ion. Substrát RuBP váže Mg2+ vytěsnění dvou ze tří aquo ligandů.[13][19][20]
Enolizace
Enolizace RuBP je přeměna keto tautomeru RuBP na enediol (ate). Enolizace je zahájena deprotonací na C3. Enzymová báze v tomto kroku byla diskutována, [19][21] ale sterická omezení pozorovaná v krystalických strukturách učinila z Lys201 nejpravděpodobnějšího kandidáta.[13] Konkrétně karbamátový kyslík na Lys201, který není koordinován s iontem Mg, deprotonuje uhlík C3 z RuBP za vzniku 2,3-enediolátu.[19][20]
Karboxylace

Karboxylace 2,3-enediolátu vede k meziproduktu 3-keto-2'-karboxyarabinitol-1,5-bisfosfátu a Lys334 je umístěn tak, aby usnadňoval přidání substrátu CO2, protože nahrazuje třetí molekulu vody koordinovanou Mg2 + a přidává přímo na enediol. V tomto procesu se netvoří žádný Michaelisův komplex.[13][21] Hydratace tohoto ketonu vede k další hydroxyskupině na C3, čímž se vytvoří meziprodukt gem-diol.[19][22] Karboxylace a hydratace byly navrženy buď jako jediný společný krok[19] nebo jako dva postupné kroky.[22] Sloučený mechanismus je podporován blízkostí molekuly vody k C3 RuBP ve více krystalických strukturách. Ve struktuře špenátu jsou dobře umístěny další zbytky, které napomáhají hydratačnímu kroku, protože jsou ve vzdálenosti vodíkové vazby od molekuly vody.[13]
Štěpení vazby CC
Gem-diolový meziprodukt štěpí na vazbě C2-C3 za vzniku jedné molekuly glycerát-3-fosfátu a negativně nabitého karboxylátu.[13] Stereo specifická protonace C2 tohoto karbaniontu vede k další molekule glycerát-3-fosfátu. Předpokládá se, že tento krok usnadňuje Lys175 nebo potenciálně karbamylovaný Lys201.[13]
produkty
Pokud je oxidem uhličitým substrát, je produktem karboxylázové reakce nestabilní šestikarbonový fosforylovaný meziprodukt známý jako 3-keto-2-karboxyarabinitol-1,5-bisfosfát, který se rychle rozpadá na dvě molekuly glycerát-3-fosfátu. 3-fosfoglycerát lze použít k výrobě větších molekul, jako je např glukóza.
Rubisco vedlejší činnosti může vést k zbytečným nebo inhibičním vedlejším produktům; jeden takový produkt je xylulóza-1,5-bisfosfát, který inhibuje aktivitu Rubisco.[23]
Když je molekulárním kyslíkem substrát, produkty kyslíkové reakce jsou fosfoglykolát a 3-fosfoglycerát. Fosfoglykolát se recykluje prostřednictvím sledu reakcí nazývaných fotorespirace, který zahrnuje enzymy a cytochromy umístěné v mitochondrie a peroxisomy (toto je případ oprava metabolitů ). V tomto procesu se dvě molekuly fosfoglykolátu přemění na jednu molekulu oxidu uhličitého a jednu molekulu 3-fosfoglycerátu, což může znovu vstoupit do Calvinova cyklu. Část fosfoglykolátu vstupujícího do této dráhy si mohou rostliny ponechat a produkovat tak další molekuly, jako např glycin. Při okolních úrovních oxidu uhličitého a kyslíku je poměr reakcí přibližně 4 ku 1, což vede k čisté fixaci oxidu uhličitého pouze 3,5. Neschopnost enzymu zabránit reakci s kyslíkem tedy výrazně snižuje fotosyntetickou kapacitu mnoha rostlin. Některé rostliny, mnoho řas a fotosyntetické bakterie překonaly toto omezení vytvořením prostředků ke zvýšení koncentrace oxidu uhličitého kolem enzymu, včetně C4 uhlíková fixace, metabolismus kyseliny crassulacean a použití pyrenoid.
Rychlost enzymatické aktivity
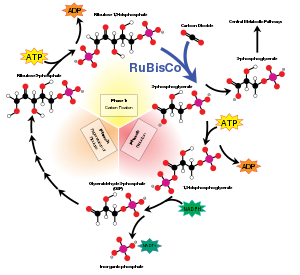
Některé enzymy mohou provádět tisíce chemických reakcí každou sekundu. RuBisCO je však pomalý a fixuje pouze 3–10 molekul oxidu uhličitého každou sekundu na molekulu enzymu.[24] Reakce katalyzovaná RuBisCO je tedy primárním faktorem omezujícím rychlost Calvinova cyklu během dne. Nicméně za většiny podmínek a když světlo jinak neomezuje fotosyntézu, rychlost RuBisCO reaguje pozitivně na zvyšující se koncentraci oxidu uhličitého.
RuBisCO je obvykle aktivní pouze během dne, protože 1,5-bisfosfát ribulózy se ve tmě neregeneruje. To je způsobeno regulací několika dalších enzymů v Calvinově cyklu. Kromě toho je aktivita RuBisCO koordinována s aktivitou ostatních enzymů Calvinova cyklu několika dalšími způsoby:
Ionty
Po osvětlení chloroplastů se pH z stroma stoupá z 7,0 na 8,0 kvůli protonu (vodíkový iont, H+
) přechod vytvořený přes thylakoid membrána. Pohyb protonů do tylakoidů je poháněn světlem a je zásadní pro ATP syntéza v chloroplastech (Další čtení: Centrum fotosyntetické reakce; Reakce závislé na světle ). Aby se vyrovnal iontový potenciál přes membránu, ionty hořčíku (Mg2+
) se v reakci pohybují ven z tylakoidů a zvyšují koncentraci hořčíku ve stromatu chloroplastů. RuBisCO má vysoké optimální pH (může být> 9,0, v závislosti na koncentraci iontů hořčíku), a proto se „aktivuje“ zavedením oxidu uhličitého a hořčíku do aktivních míst, jak je popsáno výše.
RuBisCO aktiváza
V rostlinách a některých řasách je další enzym, RuBisCO aktiváza (Rca, GO: 0046863, P10896), je umožněn rychlý vznik kritického stavu karbamát na aktivním webu RuBisCO.[25][26] To je nutné, protože ribulóza 1,5-bisfosfát (RuBP) se silněji váže na aktivní místa RuBisCO, když je přítomen nadbytek karbamátu, což brání tomu, aby se procesy pohybovaly vpřed. Ve světle RuBisCO aktiváza podporuje uvolňování inhibičního (nebo - v některých pohledech -) skladování RuBP z katalytických míst RuBisCO. Aktiváza je také vyžadována u některých rostlin (např. Tabák a mnoho fazolí), protože ve tmě je RuBisCO inhibován (nebo chráněn před hydrolýzou) kompetitivním inhibitorem syntetizovaným těmito rostlinami, analogem substrátu 2-Karboxy-D-arabitinol-1-fosfát (CA1P).[27] CA1P se pevně váže na aktivní místo karbamylovaného RuBisCO a v ještě větší míře inhibuje katalytickou aktivitu. Bylo také prokázáno, že CA1P udržuje RuBisCO v a konformace která je chráněna před proteolýza.[28] Ve světle RuBisCO aktiváza také podporuje uvolňování CA1P z katalytických míst. Poté, co je CA1P uvolněn z RuBisCO, je rychle přeměněn na neinhibiční formu světlem aktivovaným CA1P-fosfatáza. I bez těchto silných inhibitorů nejsou jednou za několik set reakcí normální reakce s oxidem uhličitým nebo kyslíkem dokončeny; další inhibiční substrátové analogy se stále tvoří v aktivním místě. RuBisCO aktiváza může znovu podporovat uvolňování těchto analogů z katalytických míst a udržovat enzym v katalyticky aktivní formě. Při vysokých teplotách se však RuBisCO aktiváza agreguje a již nemůže aktivovat RuBisCO. To přispívá ke snížené karboxylační kapacitě pozorované během tepelného stresu.[29][30]
Prostřednictvím ATP / ADP a stavu stromální redukce / oxidace prostřednictvím aktivázy
Odstranění inhibičního RuBP, CA1P a dalších analogů inhibičního substrátu aktivázou vyžaduje konzumaci ATP. Tato reakce je inhibována přítomností ADP, a tedy aktivita aktivázy závisí na poměru těchto sloučenin ve chloroplastovém stromatu. Kromě toho je u většiny rostlin citlivost aktivázy k poměru ATP / ADP modifikována stromální redukcí / oxidací (redox ) stav přes další malý regulační protein, thioredoxin. Tímto způsobem lze aktivitu aktivázy a aktivační stav RuBisCO modulovat v reakci na intenzitu světla, a tedy na rychlost tvorby substrátu ribulózy 1,5-bisfosfátu.[31]
Fosfátem
U sinic, anorganické fosfát (Stri) se také podílí na koordinované regulaci fotosyntézy: Pi váže se na aktivní místo RuBisCO a na jiné místo ve velkém řetězci, kde může ovlivňovat přechody mezi aktivovanými a méně aktivními konformacemi enzymu. Tímto způsobem může být aktivace bakteriálního RuBisCO zvláště citlivá na Pi úrovně, které by mohly způsobit, že bude působit podobně, jako funguje RuBisCO aktiváza ve vyšších rostlinách.[32]
Oxidem uhličitým
Protože kysličník uhličitý a kyslík soutěžit v aktivním místě RuBisCO lze fixaci uhlíku pomocí RuBisCO zvýšit zvýšením hladiny oxidu uhličitého v kompartmentu obsahujícím RuBisCO (chloroplastové stroma ). Během vývoje rostlin se několikrát vyvinuly mechanismy pro zvýšení hladiny oxidu uhličitého ve stromatu (viz C4 uhlíková fixace ). Použití kyslíku jako substrátu se zdá být záhadným procesem, protože se zdá, že zabíjí zachycenou energii. Může to však být mechanismus pro zabránění přetížení sacharidy během období vysokého světelného toku. Tato slabost v enzymu je příčinou fotorespirace, takže zdravé listy v jasném světle mohou mít nulovou čistou fixaci uhlíku, když je poměr Ó
2 na CO
2 k dispozici RuBisCO posune příliš daleko směrem ke kyslíku. Tento jev je primárně závislý na teplotě: Vysoké teploty mohou snížit koncentraci CO
2 rozpuštěný ve vlhkosti listových tkání. Tento jev také souvisí s vodní stres: Protože listy rostlin jsou odpařovány odpařováním, omezená voda způsobuje vysoké teploty listů. C4 rostliny použijte enzym PEP karboxyláza zpočátku, který má vyšší afinitu k CO
2. Tento proces nejprve vytvoří 4-uhlíkovou meziproduktovou sloučeninu, která je dopravována na místo C3 fotosyntéza potom dekarboxylován, uvolněn CO
2 zvýšit koncentraci CO
2, odtud název C.4 rostliny.
Metabolismus kyseliny Crassulacean (CAM) rostliny udržují své průduchy během dne uzavřeno, což šetří vodu, ale brání reakcím nezávislým na světle (aka Calvinův cyklus ), protože tyto reakce vyžadují CO
2 projít výměnou plynu těmito otvory. Odpařování přes horní stranu listu je zabráněno vrstvou vosk.
Genetické inženýrství
Vzhledem k tomu, že RuBisCO často omezuje rychlost fotosyntézy v rostlinách, je možné jej vylepšit fotosyntetická účinnost úpravou genů RuBisCO v rostlinách za účelem zvýšení katalytické aktivity a / nebo snížení rychlosti okysličování.[33][34][35][36] To by se mohlo zlepšit biosekvestrace z CO
2 a být oba důležití klimatická změna strategie a strategie pro zvýšení výnosů plodin.[37] Zkoumané přístupy zahrnují přenos genů RuBisCO z jednoho organismu do jiného organismu, inženýrství Rubisco aktivázy z termofilních sinic do rostlin citlivých na teplotu, zvýšení úrovně exprese podjednotek RuBisCO, exprimování malých řetězců RuBisCO z chloroplastová DNA a změna genů RuBisCO za účelem zvýšení specificity pro oxid uhličitý nebo jiného zvýšení rychlosti fixace uhlíku.[38][39]
Mutageneze u rostlin
Obecně, místně zaměřená mutageneze RuBisCO byl většinou neúspěšný,[37] ačkoli u rostlin tabáku s podjednotkou C bylo dosaženo mutovaných forem proteinu4 druh,[40] a RuBisCO s více C.4- podobné kinetické vlastnosti byly v rýži dosaženy jadernou transformací.[41]
Jednou z možností je představit varianty RuBisCO s přirozeně vysokými hodnotami specificity, jako jsou ty z červená řasa Galdieria partita do rostlin. To může zlepšit fotosyntetickou účinnost plodin, i když je třeba ještě zkoumat možné negativní dopady.[42] Pokroky v této oblasti zahrnují nahrazení tabákového enzymu enzymem fialové fotosyntetické bakterie Rhodospirillum rubrum.[43] V roce 2014 dvě transplastomické tabákové linky s funkčním RuBisCO z sinice Synechococcus elongatus PCC7942 (Se7942) byly vytvořeny nahrazením RuBisCO geny velké a malé podjednotky enzymu Se7942, v kombinaci buď s odpovídajícím montážním chaperonem Se7942, RbcX, nebo s interním karboxysomálním proteinem CcmM35. Oba mutanti se zvýšili CO
2 rychlosti fixace měřené jako molekuly uhlíku na RuBisCO. Mutantní rostliny však rostly pomaleji než divoký typ.[44]
Nedávná teorie zkoumá kompromis mezi relativní specificitou (tj. Schopností upřednostňovat CO
2 fixace skončila Ó
2 začlenění, což vede k procesu plýtvání energií fotorespirace ) a rychlost tvorby produktu. Autoři docházejí k závěru, že RuBisCO se ve skutečnosti mohlo vyvinout, aby dosáhlo bodu „téměř dokonalosti“ v mnoha rostlinách (s velmi odlišnou dostupností substrátu a podmínkami prostředí), čímž dosáhlo kompromisu mezi specificitou a reakční rychlostí.[45] Bylo také navrženo, že oxygenázová reakce RuBisCO zabraňuje CO2 vyčerpání v blízkosti svých aktivních míst a zajišťuje udržování redoxního stavu chloroplastů.[46]
Protože fotosyntéza je jediným nejúčinnějším přirozeným regulátorem oxid uhličitý v zemské atmosféře,[47] biochemický model reakce RuBisCO se používá jako základní modul modelů změny klimatu. Správný model této reakce je tedy nezbytný pro základní pochopení vztahů a interakcí environmentálních modelů.
Exprese v bakteriálních hostitelích
V současné době existuje velmi málo účinných metod pro expresi funkční rostliny Rubisco v bakteriálních hostitelích pro studie genetické manipulace. To je do značné míry způsobeno požadavkem společnosti Rubisco na komplexní buněčné strojní zařízení pro jeho biogenezi a metabolickou údržbu, včetně jaderných kódovaných podjednotek RbcS, které se obvykle dovážejí do chloroplasty jako rozložené proteiny.[48][49] Kromě toho je hlavní výzvou také dostatečná exprese a interakce s Rubisco aktivázou.[50] Jedna úspěšná metoda pro expresi Rubisco v E-coli zahrnuje koexpresi několika chaperonů chloroplastů, i když to bylo prokázáno pouze pro Arabidopsis thaliana Rubisco.[51]
Vyčerpání v proteomických studiích
Díky vysokému množství v rostlinách (obvykle 40% celkového obsahu bílkovin) RuBisCO často brání analýze důležitých signálních proteinů, jako je transkripční faktory, kinázy a regulační proteiny nalezené v rostlinách v menším množství (10 - 100 molekul na buňku).[52] Například pomocí hmotnostní spektrometrie na směsích rostlinných bílkovin by vedlo k několika intenzivním vrcholům podjednotky RuBisCO, které interferují a skrývají vrcholy jiných proteinů.
Nedávno jedna účinná metoda srážení RuBisCO zahrnuje použití protamin sulfát řešení.[53] Mezi další existující metody pro vyčerpání RuBisCO a studium proteinů s nižším výskytem patří frakcionace techniky s vápníkem a fytátem,[54] Gelová elektroforéza s polyethylenglykolem,[55][56] afinitní chromatografie,[57][58] a agregace pomocí DTT,[59] i když jsou tyto metody časově náročnější a méně účinné ve srovnání se srážením protamin sulfátu.[52]
Fylogenetické studie
Gen chloroplastů rbcL, který kóduje velkou podjednotku RuBisCO byl široce používán jako vhodný místo pro analýzu fylogenetika v taxonomie rostlin.[60]
Vývoj RuBisCO
S vývojem C.4- fixační dráha u určitých druhů rostlin, C3 RuBisCO se vyvinulo tak, aby mělo rychlejší obrat CO
2 výměnou za nižší specificitu v důsledku větší lokalizace CO
2 z buňky mezofylu do buňky pláště svazku.[61] Toho bylo dosaženo zvýšením konformační flexibility přechodu „otevřeno-zavřeno“ v EU Calvinův cyklus. Laboratorní fylogenetické studie ukázaly, že tento vývoj byl omezen kompromisem mezi stabilitou a aktivitou vyvolanou řadou nezbytných mutace pro C.4 RuBisCO.[62] Navíc, aby se udržely destabilizující mutace, evoluce k C.4 RuBisCO předcházelo období, ve kterém mutace poskytly enzymu zvýšenou stabilitu a vytvořily pufr pro udržení a udržení mutací požadovaných pro C4 RuBisCO. Aby se pomohlo s tímto pufrovacím procesem, bylo zjištěno, že nově vyvinutý enzym dále vyvinul řadu stabilizačních mutací. Zatímco RuBisCO vždy akumuloval nové mutace, většina z těchto mutací, které přežily, neměla významné účinky na stabilitu proteinu. Destabilizující C4 mutace na RuBisCO byly udržovány tlaky na životní prostředí, jako jsou nízké CO
2 koncentrace vyžadující obětování stability pro nové adaptivní funkce.[62]
Historie pojmu
Termín „RuBisCO“ vytvořil vtipně v roce 1979 autor David Eisenberg na semináři na počest odchodu raného prominentního výzkumného pracovníka RuBisCO do důchodu, Sam Wildman, a také se zmiňoval o obchodním jménu občerstvení “Nabisco „s odkazem na Wildmanovy pokusy vytvořit z tabákových listů jedlý proteinový doplněk.[63][64]
Velká písmena jména byla dlouho diskutována. Může být psáno velkými písmeny pro každé písmeno celého jména (Ribuprohrát-1,5 bisfosfát Carboxyláza /Óxgenase), ale také se tvrdí, že by všechny měly být psány malými písmeny (rubisco), podobně jako jiné výrazy jako potápění nebo laser.
Viz také
|
|
Reference
- ^ Sharkey, TD (2019). "Objev kanonického Calvin-Bensonova cyklu". Photosynth Res. 53 (2): 835–18. doi:10.1007 / s11120-018-0600-2. OSTI 1607740. PMID 30374727. S2CID 53092349.
- ^ Cooper, Geoffrey M. (2000). "10. Chloroplastový genom". Buňka: Molekulární přístup (2. vyd.). Washington, DC: ASM Press. ISBN 978-0-87893-106-4.
, jedna z podjednotek ribulózy bisfosfátkarboxylázy (rubisco) je kódována chloroplastovou DNA. Rubisco je kritický enzym, který katalyzuje přidání CO
2 na ribulóza-1,5-bisfosfát během Calvinova cyklu. Rovněž se považuje za jediný nejhojnější protein na Zemi, takže je pozoruhodné, že jedna z jejích podjednotek je kódována genomem chloroplastů. - ^ Dhingra A, Portis AR, Daniell H (duben 2004). „Vylepšený překlad genu RbcS exprimovaného chloroplasty obnovuje malé hladiny podjednotky a fotosyntézu v jaderných rostlinách RbcS antisense“. Sborník Národní akademie věd Spojených států amerických. 101 (16): 6315–20. Bibcode:2004PNAS..101,6315D. doi:10.1073 / pnas.0400981101. PMC 395966. PMID 15067115.
(Rubisco) je nejrozšířenějším enzymem na této planetě a představuje 30–50% celkového rozpustného proteinu v chloroplastu;
- ^ A b Feller U, Anders I, Mae T (2008). „Rubiscolytics: osud Rubisco po ukončení jeho enzymatické funkce v buňce“ (PDF). Journal of Experimental Botany. 59 (7): 1615–24. doi:10.1093 / jxb / erm242. PMID 17975207.
- ^ (Entrez GeneID:)
- ^ Dhingra A, Portis AR, Daniell H (duben 2004). „Vylepšený překlad genu RbcS exprimovaného chloroplasty obnovuje malé hladiny podjednotky a fotosyntézu v jaderných rostlinách RbcS antisense“. Sborník Národní akademie věd Spojených států amerických. 101 (16): 6315–20. Bibcode:2004PNAS..101,6315D. doi:10.1073 / pnas.0400981101. PMC 395966. PMID 15067115.
- ^ Arabidopsis thaliana má čtyři geny malého řetězce RuBisCO.
Yoon M, Putterill JJ, Ross GS, Laing WA (duben 2001). "Stanovení relativních úrovní exprese genů malé podjednotky rubisco v Arabidopsis rychlou amplifikací konců cDNA". Analytická biochemie. 291 (2): 237–44. doi:10.1006 / abio.2001.5042. PMID 11401297. - ^ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. (2002). "20. Calvinův cyklus a fosfátová cesta pentózy". Biochemie (5. vydání). San Francisco: W.H. Freemane. ISBN 978-0-7167-3051-4.
Obrázek 20.3. Struktura Rubisco. (Barevně odlišený pásový diagram)
- ^ Struktura RuBisCO z fotosyntetické bakterie Rhodospirillum rubrum bylo určeno Rentgenová krystalografie viz: PDB: 9 RUB. Srovnání struktur eukaryotický a bakteriální RuBisCO je uveden v Proteinová datová banka hlavní článek na Rubisco.
- ^ Molekulární buněčná biologie, 4. vydání, Harvey Lodish, Arnold Berk, S. Lawrence Zipursky, Paul Matsudaira, David Baltimore a James E. Darnell. Vydal W. H. Freeman & Co. (2000) New York. Online učebnice. Obrázek 16-48 ukazuje strukturní model aktivního místa, včetně zapojení hořčíku. Článek o funkci Protein Data Bank o RuBisCO také obsahuje model hořčík v aktivním místě Archivováno 09.01.2006 na Wayback Machine.
- ^ A b C d Stec B (listopad 2012). "Strukturální mechanismus aktivace RuBisCO karbamylací aktivního místa lysinu". Sborník Národní akademie věd Spojených států amerických. 109 (46): 18785–90. Bibcode:2012PNAS..10918785S. doi:10.1073 / pnas.1210754109. PMC 3503183. PMID 23112176.
- ^ The Podat učebnici popisuje lokalizaci RuBisCO do stromálního prostoru chloroplastů. Obrázek 17-7 ilustruje, jak se malé podjednotky RuBisCO přesouvají do chloroplastového stromatu a sestavují se s velkými podjednotkami.
- ^ A b C d E F G Andersson, Inger (květen 2008). „Katalýza a regulace v Rubiscu“. Journal of Experimental Botany. 59 (7): 1555–1568. doi:10.1093 / jxb / ern091. PMID 18417482.
- ^ Erb, Tobias; Zarzycki, leden (únor 2018). „Krátká historie RubisCO: vzestup a pokles (?) Převládajícího CO v přírodě2 fixační enzym ". Aktuální názor na biotechnologie. 49: 100–107. doi:10.1016 / j.copbio.2017.07.017. PMID 28843191.
- ^ Schneider, Gunter; Lundqvis, Tomáš (5. července 1991). „Krystalová struktura aktivovaného ribulóza-1,5-bisfosfátkarboxylázy v komplexu se svým substrátem, ribulóza-1,5-bisfosfát *“. The Journal of Biological Chemistry. 266 (19): 12604–12611. PMID 1905726.
- ^ The chemické reakce katalyzované RuBisCO jsou popsány online Biochemie učebnice od Stryera a kol.
- ^ Satagopan S, Spreitzer RJ (červenec 2008). „Rostlinné substituce v karboxykonci Chlamydomonas Rubisco s velkou podjednotkou zvyšují specificitu CO2 / O2“. Biologie rostlin BMC. 8: 85. doi:10.1186/1471-2229-8-85. PMC 2527014. PMID 18664299.
- ^ Lorimer, G; Miziorko, H (1980). „Tvorba karbamátu na c-aminoskupině lysylového zbytku jako základu pro aktivaci ribulosa-bisfosfátkarboxylázy pomocí C02 a Mg2 +“. Biochemie. 19 (23): 5321–5328. doi:10.1021 / bi00564a027. PMID 6778504.
- ^ A b C d E Cleland, W; Lorimer, G (1998). „Mechanism of Rubisco: The Carbamate as General Base“. Chemické recenze. 98 (2): 549−561. doi:10.1021 / cr970010r. PMID 11848907.
- ^ A b Andersson, já; Rytíř, S; Schneider, G; Lindqvist, Y; Lindqvist, T; Brändén, CI; Lorimer, GH (1989). "Krystalová struktura aktivního místa ribulóza-bisfosfátkarboxylázy". Příroda. 337 (6204): 229–234. Bibcode:1989 Natur.337..229A. doi:10.1038 / 337229a0. S2CID 4370073.
- ^ A b Hartman, F. C .; Harpel, M. R. (1994). "Struktura, funkce, regulace a montáž D-ribulóza-1,5-bisfosfátkarboxylázy / oxygenázy". Roční přehled biochemie. 63: 197–232. doi:10.1146 / annurev.bi.63.070194.001213. PMID 7979237.
- ^ A b Taylor, TC; Andersson, I (1997). "Struktura komplexu mezi rubisco a jeho přirozeným substrátem ribulóza-1,5-bisfosfát". Journal of Molecular Biology. 265 (4): 432–444. doi:10.1006 / jmbi.1996.0738. PMID 9034362.
- ^ Pearce FG (listopad 2006). „Katalytická tvorba vedlejších produktů a vazba ligandu pomocí ribulosa-bisfosfátkarboxyláz z různých fylogenezí“. The Biochemical Journal. 399 (3): 525–34. doi:10.1042 / BJ20060430. PMC 1615894. PMID 16822231.
- ^ Ellis RJ (leden 2010). "Biochemie: Řešení neinteligentního designu". Příroda. 463 (7278): 164–5. Bibcode:2010Natur.463..164E. doi:10.1038 / 463164a. PMID 20075906. S2CID 205052478.
- ^ Portis AR (2003). „Rubisco aktivase - Rubiscoův katalytický chaperon“. Fotosyntetický výzkum. 75 (1): 11–27. doi:10.1023 / A: 1022458108678. PMID 16245090. S2CID 2632.
- ^ Jin SH, Jiang DA, Li XQ, Sun JW (srpen 2004). „Charakteristika fotosyntézy u rostlin rýže transformovaných genem antisense Rubisco aktivázy“. Journal of Zhejiang University Science. 5 (8): 897–9. doi:10.1631 / jzus.2004.0897. PMID 15236471. S2CID 1496584.
- ^ Andralojc PJ, Dawson GW, Parry MA, Keys AJ (prosinec 1994). „Začlenění uhlíku z fotosyntetických produktů do 2-karboxyarabinitol-1-fosfátu a 2-karboxyarabinitolu“. The Biochemical Journal. 304 (Pt 3) (3): 781–6. doi:10.1042 / bj3040781. PMC 1137402. PMID 7818481.
- ^ Khan S, Andralojc PJ, Lea PJ, Parry MA (prosinec 1999). „2'-karboxy-D-arabitinol-1-fosfát chrání ribulosu 1,5-bisfosfát-karboxylázu / oxygenázu před proteolytickým rozkladem“ (PDF). European Journal of Biochemistry. 266 (3): 840–7. doi:10.1046 / j.1432-1327.1999.00913.x. PMID 10583377.
- ^ Salvucci ME, Osteryoung KW, Crafts-Brandner SJ, Vierling E (listopad 2001). „Výjimečná citlivost Rubisco aktivasy na tepelnou denaturaci in vitro a in vivo“. Fyziologie rostlin. 127 (3): 1053–64. doi:10.1104 / pp.010357. PMC 129275. PMID 11706186.
- ^ Crafts-Brandner SJ, Salvucci ME (listopad 2000). „Rubisco aktiváza omezuje fotosyntetický potenciál listů při vysoké teplotě a CO2“. Sborník Národní akademie věd Spojených států amerických. 97 (24): 13430–5. Bibcode:2000PNAS ... 9713430C. doi:10.1073 / pnas.230451497. PMC 27241. PMID 11069297.
- ^ Zhang N, Kallis RP, Ewy RG, Portis AR (březen 2002). „Světelná modulace Rubisca u Arabidopsis vyžaduje kapacitu pro redoxní regulaci větší izoformy Rubisco aktivázy“. Sborník Národní akademie věd Spojených států amerických. 99 (5): 3330–4. Bibcode:2002PNAS ... 99.3330Z. doi:10.1073 / pnas.042529999. PMC 122518. PMID 11854454.
- ^ Marcus Y, Gurevitz M (říjen 2000). „Aktivace sinic RuBP-karboxylázy / oxygenázy je usnadněna anorganickým fosfátem dvěma nezávislými mechanismy“. European Journal of Biochemistry. 267 (19): 5995–6003. doi:10.1046 / j.1432-1327.2000.01674.x. PMID 10998060.
- ^ Spreitzer RJ, Salvucci ME (2002). „Rubisco: struktura, regulační interakce a možnosti lepšího enzymu“. Roční přehled biologie rostlin. 53: 449–75. doi:10.1146 / annurev.arplant.53.100301.135233. PMID 12221984. S2CID 9387705.
- ^ Timmer J (7. prosince 2017). „Nyní můžeme být schopni vytvořit nejdůležitější mizerný enzym na planetě.“. Ars Technica. Citováno 5. ledna 2019.
- ^ Timmer J (3. ledna 2019). „Oprava fotosyntézy jeho inženýrstvím k recyklaci toxické chyby“. Ars Technica. Citováno 5. ledna 2019.
- ^ South PF, Cavanagh AP, Liu HW, Ort DR (leden 2019). „Metody metabolismu glykolátu stimulují růst plodiny a produktivitu na poli. Věda. 363 (6422): eaat9077. doi:10.1126 / science.aat9077. PMID 30606819.
- ^ A b Furbank RT, Quick WP, Sirault XR (2015). „Zlepšení fotosyntézy a potenciálu výnosu v obilninových plodinách cílenou genetickou manipulací: vyhlídky, pokrok a výzvy“. Výzkum polních plodin. 182: 19–29. doi:10.1016 / j.fcr.2015.04.009.
- ^ Parry MA, Andralojc PJ, Mitchell RA, Madgwick PJ, Keys AJ (květen 2003). „Manipulace s Rubisco: množství, aktivita, funkce a regulace“. Journal of Experimental Botany. 54 (386): 1321–33. doi:10.1093 / jxb / erg141. PMID 12709478.
- ^ Ogbaga CC, Stepien P, Athar HU, Ashraf M (červen 2018). „Engineering Rubisco activase from thermophilic cyanobacteria into high-temperature sensitive plants“. Kritické recenze v biotechnologii. 38 (4): 559–572. doi:10.1080/07388551.2017.1378998. PMID 28937283. S2CID 4191791.
- ^ Whitney SM, Sharwood RE, Orr D, White SJ, Alonso H, Galmés J (srpen 2011). „Isoleucin 309 působí jako katalyzátor C4, který zvyšuje rychlost karboxylace ribulóza-1,5-bisfosfátkarboxylázy / oxygenázy (rubisco) ve Flaverii“. Sborník Národní akademie věd Spojených států amerických. 108 (35): 14688–93. Bibcode:2011PNAS..10814688W. doi:10.1073 / pnas.1109503108. PMC 3167554. PMID 21849620.
- ^ Ishikawa C, Hatanaka T, Misoo S, Miyake C, Fukayama H (červenec 2011). „Funkční začlenění malé podjednotky čiroku zvyšuje rychlost katalytického obratu Rubisca v transgenní rýži“. Fyziologie rostlin. 156 (3): 1603–11. doi:10.1104 / pp.111.177030. PMC 3135941. PMID 21562335.
- ^ Whitney SM, Andrews TJ (prosinec 2001). „Bakteriální ribulosa-1,5-bisfosfátkarboxyláza / oxygenáza (RubisCO) kódovaná plastomy podporuje fotosyntézu a růst tabáku“. Sborník Národní akademie věd Spojených států amerických. 98 (25): 14738–43. Bibcode:2001PNAS ... 9814738W. doi:10.1073 / pnas.261417298. PMC 64751. PMID 11724961.
- ^ John Andrews T, Whitney SM (červen 2003). „Manipulace s ribulózou, bisfosfátkarboxylázou / oxygenázou v chloroplastech vyšších rostlin“. Archivy biochemie a biofyziky. 414 (2): 159–69. doi:10.1016 / S0003-9861 (03) 00100-0. PMID 12781767.
- ^ Lin MT, Occhialini A, Andralojc PJ, Parry MA, Hanson MR (září 2014). „Rychlejší Rubisco s potenciálem zvýšit fotosyntézu plodin“. Příroda. 513 (7519): 547–50. Bibcode:2014 Natur.513..547L. doi:10.1038 / příroda13776. PMC 4176977. PMID 25231869.
- ^ Tcherkez GG, Farquhar GD, Andrews TJ (květen 2006). „I přes pomalou katalýzu a zmatenou specificitu substrátu mohou být všechny ribulózo-bisfosfátkarboxylázy téměř dokonale optimalizovány.“. Sborník Národní akademie věd Spojených států amerických. 103 (19): 7246–51. Bibcode:2006PNAS..103.7246T. doi:10.1073 / pnas.0600605103. PMC 1464328. PMID 16641091.
- ^ Igamberdiev AU (2015). „Řízení funkce Rubisco pomocí homeostatické rovnováhy dodávky CO2“. Hranice ve vědě o rostlinách. 6: 106. doi:10.3389 / fpls.2015.00106. PMC 4341507. PMID 25767475.
- ^ Igamberdiev AU, Lea PJ (únor 2006). "Pozemní rostliny ekvilibrují koncentrace O2 a CO2 v atmosféře". Fotosyntetický výzkum. 87 (2): 177–94. doi:10.1007 / s11120-005-8388-2. PMID 16432665. S2CID 10709679.
- ^ Bracher A, Whitney SM, Hartl FU, Hayer-Hartl M (duben 2017). „Biogeneze a metabolická údržba Rubisca“. Roční přehled biologie rostlin. 68: 29–60. doi:10.1146 / annurev-arplant-043015-111633. PMID 28125284.
- ^ Sjuts I, Soll J, Bölter B (2017). „Import rozpustných proteinů do chloroplastů a potenciální regulační mechanismy“. Hranice ve vědě o rostlinách. 8: 168. doi:10.3389 / fpls.2017.00168. PMC 5296341. PMID 28228773.
- ^ Parry, M. A. J. (01.05.2003). „Manipulace s Rubisco: množství, aktivita, funkce a regulace“. Journal of Experimental Botany. 54 (386): 1321–1333. doi:10.1093 / jxb / erg141. ISSN 0022-0957. PMID 12709478.
- ^ Aigner H, Wilson RH, Bracher A, Calisse L, Bhat JY, Hartl FU, Hayer-Hartl M (prosinec 2017). „E. coli s pěti chaperony chloroplastů včetně BSD2“. Věda. 358 (6368): 1272–1278. Bibcode:2017Sci ... 358.1272A. doi:10.1126 / science.aap9221. PMID 29217567.
- ^ A b Heazlewood, Joshua (2012). Proteomické aplikace v biologii. New York: InTech Manhattan. ISBN 978-953-307-613-3.
- ^ Gupta R, Kim ST (2015). Proteomické profilování. Metody v molekulární biologii. 1295. Humana Press, New York, NY. str. 225–233. doi:10.1007/978-1-4939-2550-6_17. ISBN 9781493925490. PMID 25820725.
- ^ Krishnan HB, Natarajan SS (prosinec 2009). "Rychlá metoda pro vyčerpání Rubisco z listu sóji (Glycine max) pro proteomickou analýzu proteinů s nízkým výskytem". Fytochemie. 70 (17–18): 1958–64. doi:10.1016 / j.phytochem.2009.08.020. PMID 19766275.
- ^ Kim ST, Cho KS, Jang YS, Kang KY (červen 2001). "Dvourozměrná elektroforetická analýza proteinů rýže pomocí polyethylenglykolové frakcionace pro proteinová pole". Elektroforéza. 22 (10): 2103–9. doi:10.1002 / 1522-2683 (200106) 22:10 <2103 :: aid-elps2103> 3.0.co; 2-w. PMID 11465512.
- ^ Xi J, Wang X, Li S, Zhou X, Yue L, Fan J, Hao D (listopad 2006). „Polyethylenglykolová frakcionace zlepšila detekci málo hojných proteinů pomocí dvourozměrné elektroforetické analýzy rostlinného proteomu“. Fytochemie. 67 (21): 2341–8. doi:10.1016 / j.phytochem.2006.08.005. PMID 16973185.
- ^ Cellar NA, Kuppannan K, Langhorst ML, Ni W, Xu P, Young SA (January 2008). "Cross species applicability of abundant protein depletion columns for ribulose-1,5-bisphosphate carboxylase/oxygenase". Chromatografický deník B. 861 (1): 29–39. doi:10.1016/j.jchromb.2007.11.024. PMID 18063427.
- ^ Agrawal GK, Jwa NS, Rakwal R (February 2009). "Rice proteomics: ending phase I and the beginning of phase II". Proteomika. 9 (4): 935–63. doi:10.1002/pmic.200800594. PMID 19212951. S2CID 2455432.
- ^ Cho JH, Hwang H, Cho MH, Kwon YK, Jeon JS, Bhoo SH, Hahn TR (July 2008). "The effect of DTT in protein preparations for proteomic analysis: Removal of a highly abundant plant enzyme, ribulose bisphosphate carboxylase/oxygenase". Journal of Plant Biology. 51 (4): 297–301. doi:10.1007/BF03036130. ISSN 1226-9239. S2CID 23636617.
- ^ Chase a kol. 1993.
- ^ Sage RF, Sage TL, Kocacinar F (2012). "Photorespiration and the evolution of C4 photosynthesis". Roční přehled biologie rostlin. 63: 19–47. doi:10.1146 / annurev-arplant-042811-105511. PMID 22404472. S2CID 24199852.
- ^ A b Studer RA, Christin PA, Williams MA, Orengo CA (February 2014). "Stability-activity tradeoffs constrain the adaptive evolution of RubisCO". Sborník Národní akademie věd Spojených států amerických. 111 (6): 2223–8. Bibcode:2014PNAS..111.2223S. doi:10.1073/pnas.1310811111. PMC 3926066. PMID 24469821.
- ^ Wildman SG (2002). "Along the trail from Fraction I protein to Rubisco (ribulose bisphosphate carboxylase-oxygenase)". Fotosyntetický výzkum. 73 (1–3): 243–50. doi:10.1023/A:1020467601966. PMID 16245127. S2CID 7622999.
- ^ Portis AR, Parry MA (October 2007). "Discoveries in Rubisco (Ribulose 1,5-bisphosphate carboxylase/oxygenase): a historical perspective". Fotosyntetický výzkum. 94 (1): 121–43. doi:10.1007 / s11120-007-9225-6. PMID 17665149. S2CID 39767233.

Bibliografie
- Chase MW, Soltis DE, Olmstead RG, Morgan D, Les DH, Mishler BD, et al. (1993). „Fylogenetika semenných rostlin: Analýza nukleotidových sekvencí z plastidového genu rbcL " (PDF). Annals of the Missouri Botanical Garden. 80 (3): 528–580. doi:10.2307/2399846. JSTOR 2399846.
- Sugawara H, Yamamoto H, Shibata N, Inoue T, Okada S, Miyake C, Yokota A, Kai Y (May 1999). "Crystal structure of carboxylase reaction-oriented ribulose 1, 5-bisphosphate carboxylase/oxygenase from a thermophilic red alga, Galdieria partita". The Journal of Biological Chemistry. 274 (22): 15655–61. doi:10.1074/jbc.274.22.15655. PMID 10336462.
- Portis AR, Parry MA (October 2007). "Discoveries in Rubisco (Ribulose 1,5-bisphosphate carboxylase/oxygenase): a historical perspective". Fotosyntetický výzkum. 94 (1): 121–43. doi:10.1007 / s11120-007-9225-6. PMID 17665149. S2CID 39767233.
- Ashida H, Danchin A, Yokota A (2005). "Was photosynthetic RuBisCO recruited by acquisitive evolution from RuBisCO-like proteins involved in sulfur metabolism?". Výzkum v mikrobiologii. 156 (5–6): 611–8. doi:10.1016/j.resmic.2005.01.014. PMID 15950120.
- Marcus Y, Altman-Gueta H, Finkler A, Gurevitz M (June 2005). "Mutagenesis at two distinct phosphate-binding sites unravels their differential roles in regulation of Rubisco activation and catalysis". Journal of Bacteriology. 187 (12): 4222–8. doi:10.1128/JB.187.12.4222-4228.2005. PMC 1151729. PMID 15937184.
