Seratrodast - Seratrodast
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Bronica v Japonsku, Changnuo, Mai Xu Jia, Quan Kang Nuo v Číně a jako Seradair v Indii. .[1] |
| AHFS /Drugs.com | Mezinárodní názvy drog |
| Trasy z správa | Pusou (tablety, granule) |
| ATC kód | |
| Právní status | |
| Právní status |
|
| Farmakokinetické data | |
| Vazba na bílkoviny | >96% |
| Odstranění poločas rozpadu | 22 hodin |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| KEGG | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.220.176 |
| Chemické a fyzikální údaje | |
| Vzorec | C22H26Ó4 |
| Molární hmotnost | 354.446 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| | |
Seratrodast (vývojový název, AA-2414; prodáván původně jako Bronica)[2] je tromboxan A2 (TXA2) receptor (TP receptor) antagonista používá se především při léčbě astma.[3][4] Byl to první antagonista receptoru TP, který byl vyvinut jako antiastmatický lék a v Japonsku obdržel schválení v roce 1997.[5] Od roku 2017 byl seratrodast prodáván jako Bronica v Japonsku a jako Changnuo, Mai Xu Jia, Quan Kang Nuo v Číně.[1]
Na rozdíl od tromboxan syntáza inhibitory, jako jsou ozagrel, seratrodast neovlivňuje trombus tvorba, doba do okluze a doba krvácení.[6] Seratrodast nemá žádný vliv na protrombinový čas a aktivovaný parciální tromboplastinový čas, čímž vylučuje jakoukoli akci dne srážení krve kaskáda.[7]
Lékařské použití
Seratrodast se používá k léčbě astmatu.[8][9]
Adekvátní a dobře kontrolované studie seratrodastu u těhotných žen nejsou k dispozici. Lék by měl být používán v těhotenství, pouze pokud potenciální přínosy odůvodňují riziko pro plod.[9] Seratrodast by se neměl užívat během laktace.[9]
Bezpečnost a účinnost seratrodastu u dětí (<18 let) nebyla stanovena.[9]
Kontraindikace a interakce
Přípravek Seratrodast by neměly užívat osoby s onemocněním jater.[9]
Použijte s paracetamol nebo s cephem antibiotika zvyšují riziko poškození jater. Použijte s aspirin zvyšuje biologickou dostupnost seratrodastu.[9]
Nepříznivé účinky
Mezi nejčastěji pozorované (0,1 až 5%) nežádoucí účinky patří zvýšené transaminázy, nevolnost, ztráta chuti k jídlu, žaludeční nepohodlí, bolest břicha, průjem, zácpa, sucho v ústech, poruchy chuti, ospalost, bolest hlavy, závratě, bušení srdce a malátnost.[9] U méně než 0,1% pacientů se vyskytlo zvracení, trombocytopenie, epistaxe, sklon ke krvácení, nespavost, třes, necitlivost, návaly horka a otoky.[9] Všechny hlášené nežádoucí účinky byly mírné až střední závažnosti a odezněly po ukončení léčby.[9]
Farmakologie
Tromboxan A2 (TXA2) se vytváří v plicích lidí s astmatem a když signalizuje prostřednictvím tromboxanový receptor to způsobuje bronchokonstrikce, vazokonstrikce, sliznice sekrece a hyperreaktivita dýchacích cest. Seratrodast inhibuje aktivitu tromboxanový receptor, blokující účinky TXA2.[10]
Farmakokinetika
Farmakokinetika seratrodastu byla studována u Japonců a Kavkazanů, včetně indických zdravých dobrovolníků.[11][12][13][14] Plazmatické koncentrace seratrodastu se zvyšují se zvyšujícími se dávkami. Absorpce seratrodastu je relativně rychlá s maximálními plazmatickými koncentracemi 4,6–6 μg / ml dosaženými za 3 až 4 hodiny.[11] Rovnovážného stavu plazmatických koncentrací seratrodastu je dosaženo během 4–5 dnů.[13] Seratrodast je pomalu vylučován, hlavně jaterní biotransformací. Lék vykazuje biexponenciální rozpad v plazmatických profilech s průměrným eliminačním poločasem 22 hodin.[11][13] Přibližně 20% podané dávky je izolováno v moči, přičemž 60% obnovené moči je ve formě konjugátů [12]
Chemie
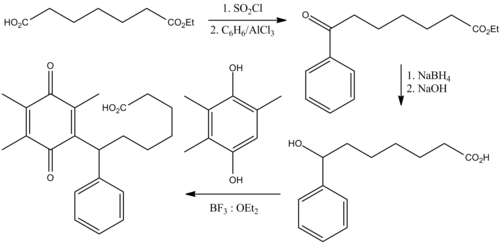
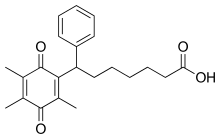
Seratrodast lze připravit v pěti krocích počínaje od kyselina pimelová monoester.[15]
Dějiny
Seratrodast byl první antagonista receptoru tromboxanu dostat se na trh jako léčba astmatu; byl schválen v Japonsku v roce 1997.[8]
Společnost a kultura
Od roku 2017 byl seratrodast prodáván jako Bronica v Japonsku, Changnuo, Mai Xu Jia, Quan Kang Nuo v Číně a jako Seretra & Seradair v Indii.[1]
Výzkum
Seratrodast byl studován v celoroční alergická rýma, chronická bronchitida a chronický plicní emfyzém kolem roku 2000 však bylo upuštěno od snahy uvést drogu na trh v těchto indikacích.[2]
Reference
- ^ A b C „Mezinárodní značky Seratrodast“. Drugs.com. Citováno 8. března 2017.
- ^ A b "Seratrodast". AdisInsight. Citováno 8. března 2017.
- ^ Endo S, Akiyama K (listopad 1996). „[Antagonista receptoru tromboxanu A2 v terapii astmatu]“. Nihon Rinsho. Japonský žurnál klinické medicíny (v japonštině). 54 (11): 3045–8. PMID 8950952.
- ^ Hada S, Hashizume M, Nishii S, Yoshioka F, Yasunaga K (leden 1993). „[Studie o inhibičním účinku AA-2414 na agregaci krevních destiček a jeho klinickém účinku u astmatických pacientů]“. Arerugi = [Alergie] (v japonštině). 42 (1): 18–25. PMID 8457165.CS1 maint: extra interpunkce (odkaz)
- ^ Dogné JM, de Leval X, Benoit P, Delarge J, Masereel B (2002). „Inhibice tromboxanu A2: terapeutický potenciál u bronchiálního astmatu“. American Journal of Respiratory Medicine. 1 (1): 11–7. doi:10.1007 / bf03257158. PMID 14720071.
- ^ Dogné JM, Hanson J, de Leval X, Kolh P, Tchana-Sato V, de Leval L, et al. (Květen 2004). „Farmakologická charakterizace N-terc-butyl-N '- [2- (4'-methylfenylamino) -5-nitrobenzensulfonyl] močoviny (BM-573), nového antagonisty receptoru tromboxanu A2 a inhibitoru tromboxan syntázy v modelu arteriálních potkanů trombóza a její účinky na dobu krvácení “. The Journal of Pharmacology and Experimental Therapeutics. 309 (2): 498–505. doi:10.1124 / jpet.103.063610. PMID 14742735.
- ^ Samara EE (1996). „Seratrodast (AA-2414) - román Thromboxane-A2 Antagonista receptoru ". Kardiovaskulární recenze drog. 14 (3): 272–85. doi:10.1111 / j.1527-3466.1996.tb00231.x.
- ^ A b Rolin S, Masereel B, Dogné JM (březen 2006). „Prostanoidy jako farmakologické cíle při CHOPN a astmatu“. European Journal of Pharmacology. 533 (1–3): 89–100. doi:10.1016 / j.ejphar.2005.12.058. PMID 16458293.
- ^ A b C d E F G h i „医療 用 医 薬 品: ブ ロ ニ カ (japonský štítek)“ (v japonštině). KEGG. Říjen 2016. Citováno 8. března 2017.
- ^ Dogné JM, de Leval X, Benoit P, Rolin S, Pirotte B, Masereel B (únor 2002). "Terapeutický potenciál inhibitorů tromboxanu u astmatu". Znalecký posudek na vyšetřované léky. 11 (2): 275–81. doi:10.1517/13543784.11.2.275. PMID 11829716.
- ^ A b C Otevřená, randomizovaná, zkřížená bioekvivalenční studie Seratrodastu 80 mg nalačno. Data v souboru (zobrazí se na webu dne Seretra )
- ^ A b Hiraga K, Tateno M (1993). „Klinická studie fáze I AA-2414, antagonisty receptoru tromboxanu A - studie s opakovanou dávkou 160 mg jednou denně po dobu 7 dnů.“ Clin Pharmacol. 9 (Příloha 8): 41–55.
- ^ A b C Hussein Z, Samara E, Locke CS, Orchard MA, Ringham GL, Granneman GR (duben 1994). „Charakterizace farmakokinetiky a farmakodynamiky nového perorálního antagonisty tromboxanu A2-receptoru AA-2414 u normálních subjektů: populační analýza“. Klinická farmakologie a terapeutika. 55 (4): 441–50. doi:10.1038 / clpt.1994.54. PMID 8162671.
- ^ Samara EE, Qian J, Locke C, Dean R, Killian A, Granneman GR (1996). „Jednodávková farmakokinetika seratrodastu v ustáleném stavu u zdravých dobrovolníků mužů a žen“. Pharm Res. 13 (Příloha 9).
- ^ Shiraishi M, Kato K, Terao S, Ashida Y, Terashita Z, Kito G (září 1989). "Chinony. 4. Noví antagonisté eikosanoidů: syntéza a farmakologické hodnocení". Journal of Medicinal Chemistry. 32 (9): 2214–21. doi:10.1021 / jm00129a030. PMID 2769691.
