Meloxikam - Meloxicam
 | |
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Mobic, Metacam, Anjeso a další |
| AHFS /Drugs.com | Monografie |
| MedlinePlus | a601242 |
| Licenční údaje | |
| Těhotenství kategorie | |
| Trasy z správa | Ústně, IV |
| ATC kód | |
| Právní status | |
| Právní status | |
| Farmakokinetické data | |
| Biologická dostupnost | 89%[2] |
| Vazba na bílkoviny | 99.4%[2] |
| Metabolismus | Játra (CYP2C9 a 3A4 - zprostředkovaný)[2] |
| Odstranění poločas rozpadu | 20 hodin[2] |
| Vylučování | Moč a výkaly stejně[2] |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| PDB ligand | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.113.257 |
| Chemické a fyzikální údaje | |
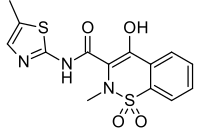
| Vzorec | C14H13N3Ó4S2 |
| Molární hmotnost | 351.40 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| | |
Meloxikam, prodávané pod značkou Mobic mimo jiné je a nesteroidní protizánětlivé léčivo (NSAID) používané k léčbě bolesti a zánětu v revmatické nemoci a artróza.[3][4] Používá se ústy nebo injekce do žíly.[4][5] Doporučuje se používat co nejkratší dobu a v nízké dávce.[4]
Mezi časté nežádoucí účinky patří bolest břicha, závratě, otoky, bolesti hlavy a vyrážka.[4] Mezi závažné nežádoucí účinky patří srdeční choroba, mrtvice, problémy s ledvinami a žaludeční vředy.[4] Použití se v třetí trimestr těhotenství.[4] Blokuje to cyklooxygenáza-2 (COX-2) více než blokuje cyklooxygenáza-1 (COX-1).[4] Je to v oxicam rodina chemikálií a úzce souvisí s piroxikam.[4]
Meloxicam byl patentován v roce 1977 a schválen pro lékařské použití ve Spojených státech v roce 2000.[4][6] Byl vyvinut společností Boehringer Ingelheim; je však také k dispozici jako generické léky.[4] V roce 2017 to bylo 38. nejčastěji předepsané léky ve Spojených státech, s více než 19 milion receptů.[7][8]
Nepříznivé účinky
Výsledkem užívání meloxikamu může být gastrointestinální toxicita a krvácení, bolesti hlavy, vyrážka a velmi tmavá nebo černá stolice (známka střevního krvácení). Jako ostatní NSAID, jeho použití je spojeno se zvýšeným rizikem kardiovaskulárních příhod, jako je infarkt a mrtvice.[9] Má méně gastrointestinálních vedlejších účinků než diklofenak,[10] piroxikam,[11] naproxen,[12] a možná i všechny ostatní NSAID, které nejsou selektivní pro COX-2.[10] Ačkoli meloxikam inhibuje tvorbu tromboxan Zdá se, že to není na úrovních, které by to rušily destička funkce.[nutná lékařská citace ]
Souhrnná analýza randomizovaných, kontrolovaných studií léčby meloxikamem v délce až 60 dnů zjistila, že meloxikam byl spojen se statisticky významně nižším počtem tromboembolický komplikace než NSAID diklofenak (0,2% oproti 0,8%), ale podobný výskyt tromboembolických příhod jako u naproxenu a piroxikamu.[13]
V říjnu 2020 USA Úřad pro kontrolu potravin a léčiv (FDA) požadoval štítek s drogami bude aktualizován pro všechny nesteroidní protizánětlivé léky, aby popsal riziko problémů s ledvinami u nenarozených dětí, které vedou k nedostatku plodové vody.[14][15] Doporučují vyhýbat se NSAID těhotným ženám ve 20. týdnu nebo později v těhotenství.[14][15]
Kardiovaskulární
Osoby s hypertenzí, vysokým cholesterolem nebo diabetem jsou ohroženy kardiovaskulárními vedlejšími účinky. Osoby s rodinnou anamnézou srdečních onemocnění, infarktu nebo cévní mozkové příhody musí informovat svého ošetřujícího lékaře, protože potenciál závažných kardiovaskulárních vedlejších účinků je významný.[16][17]
Gastrointestinální
NSAID způsobit a zvýšit riziko vážných gastrointestinální nežádoucí účinky včetně krvácení, ulcerace a perforace žaludku nebo střev, které mohou být smrtelné. Starší pacienti jsou vystaveni vyššímu riziku závažných gastrointestinálních příhod.[18]
Ústa
Doporučuje se přerušit užívání meloxikamu po dobu nejméně čtyř až šesti poločasů před chirurgickými nebo zubními procedurami kvůli zvýšenému riziku perverzní chuť, ulcerózní stomatitida a suchá ústa.[nutná lékařská citace ]
Mechanismus účinku
Bloky meloxikamu cyklooxygenáza (COX) enzym odpovědný za konverzi kyselina arachidonová do prostaglandin H2 —Prvý krok v syntéze prostaglandiny, které jsou mediátory zánětu. Meloxikam byl prokázán, zejména při svém nízké terapeutické dávky, selektivně inhibovat COX-2 přes COX-1.[2]
Koncentrace meloxikamu v synoviální tekutina se pohybují od 40% do 50% osob v EU plazma. Volná frakce v synoviální tekutině je 2,5krát vyšší než v plazmě, vzhledem k nižšímu obsahu albuminu v synoviální tekutině ve srovnání s plazmou. Význam této penetrace není znám,[18] ale může to vysvětlovat skutečnost, že při léčbě artritidy na zvířecích modelech funguje výjimečně dobře.[19]
Farmakokinetika
Vstřebávání
The biologická dostupnost meloxikamu se při perorálním podání sníží ve srovnání s ekvivalentní bolusovou dávkou IV. Užívání perorálního meloxikamu po snídani s vysokým obsahem tuku zvyšuje průměrné maximální hladiny léčiva o přibližně 22%; Výrobce však nedává žádná konkrétní doporučení ohledně jídla. Kromě toho použití antacida nevykazuje farmakokinetické interakce.[20]
Rozdělení
Průměrný distribuční objem meloxikamu je přibližně 10 litrů. Je silně vázán na bílkoviny, hlavně na albumin.[nutná lékařská citace ]
Metabolismus
Meloxikam je značně metabolizován v játrech pomocí enzymů CYP2C9 a CYP3A4 (menší) na čtyři neaktivní metabolity. Peroxidáza aktivita je považována za zodpovědnou za další dva zbývající metabolity.[20][21]
Vylučování
Meloxikam se vylučuje převážně ve formě metabolitů a vyskytuje se ve stejné míře močí a stolicí. Stopy nezměněného původního léčiva se nacházejí v moči a stolici. Průměrný eliminační poločas se pohybuje od 15 do 20 hodin.[20]
Specifické populace
Geriatrie
Užívání meloxikamu se nedoporučuje u lidí s peptickým vředem nebo se zvýšeným rizikem krvácení z trávicího traktu, včetně osob starších 75 let nebo u pacientů užívajících léky spojené s rizikem krvácení.[22] Bylo zjištěno, že nežádoucí účinky jsou závislé na dávce a souvisejí s délkou léčby.[22][20]
Veterinární použití
Meloxikam se používá v veterinární medicína, nejčastěji u psů a koček, ale také vidí použití mimo označení u jiných zvířat, jako je skot a exotika.[23][24]
Nežádoucí účinky u zvířat jsou podobné těm, které se vyskytují u lidí; hlavním vedlejším účinkem je podráždění trávicího traktu (zvracení, průjem a ulcerace ).[nutná lékařská citace ] Mezi vzácnější, ale důležité vedlejší účinky patří toxicita pro játra a ledviny.[nutná lékařská citace ]
U zdravých psů, kterým byl podáván meloxikam, nebyly při doporučených dávkách hlášeny žádné perioperační nežádoucí účinky na kardiovaskulární systém.[25] Perioperační podávání meloxikamu kočkám neovlivnilo pooperační dechovou frekvenci ani srdeční frekvenci.[26]
Recenzovaný článek v časopise uvádí NSAID, včetně meloxikamu, které způsobují gastrointestinální potíže a při vysokých dávkách akutní poškození ledvin a CNS příznaky, jako jsou záchvaty a koma u koček. Dodává, že kočky mají nízkou toleranci vůči NSAID.[27][28]
Při podávání meloxikamu kočkám s chronickým onemocněním ledvin nebyl pozorován žádný pokles vylučovací funkce ledvin. Kočky, které dostaly meloxikam, měly po 6 měsících větší proteinurii než kočky, které dostaly placebo. Byl vyvozen závěr, že meloxikam by měl být používán s opatrností u koček s chronickým onemocněním ledvin.[29]
Meloxikam byl zkoumán jako alternativa k diklofenak podle Královská společnost pro ochranu ptáků (RSPB) k prevenci úmrtí supi.[30]
Farmakokinetika
U psů vstřebávání meloxikamu ze žaludku není ovlivněna přítomností potravy,[31] s maximální koncentrací (Cmax ) meloxikamu vyskytujícího se v krvi 7–8 hodin po podání.[31] The poločas rozpadu meloxikamu je u psů přibližně 24 hodin.[31]
V koala (Phascolarctos cinereus), velmi málo meloxikamu se poté vstřebává do krve ústní podání (to znamená, že má špatné biologická dostupnost ).[32]
Právní status
Spojené státy
V roce 2003 byl meloxikam schválen v USA pro použití u psů k léčbě bolesti a zánětu spojeného s artróza jako ústní (kapalný ) formulace meloxikamu.[33] V lednu 2005 přidala příbalová informace varování tučným písmem: „Nepoužívat u koček.“[34] An injekční formulace pro použití u psů byla schválena USA Úřad pro kontrolu potravin a léčiv (FDA) v listopadu 2003.[35]
V říjnu 2004 byla schválena formulace pro použití u koček pouze před operací.[36] Toto je injekční meloxikam, který je indikován pouze jako jednorázová jednorázová dávka se specifickými a opakovanými varováními, aby se nepodávala druhá dávka.[37]
V roce 2005 USA Úřad pro kontrolu potravin a léčiv (FDA) zaslalo výrobci oznámení o porušení jeho propagačních materiálů, které zahrnovaly propagaci léčiva pro použití mimo značku.[38]
V únoru 2020 byla injekce meloxikamu schválena pro použití ve Spojených státech. FDA udělil souhlas společnosti Anjeso společnosti Baudax Bio.[5][39]
Evropská unie
V Evropě, kde je produkt k dispozici od počátku 90. let,[Citace je zapotřebí ] má licenci na další protizánětlivé výhody včetně úlevy od obou akutní a chronická bolest u psů. V červnu 2007 byla pro dlouhodobou úlevu od bolesti u koček povolena orální verze meloxikamu.[40]Meloxicam je také licencován pro použití u koní k úlevě od bolesti spojené s muskuloskeletální poruchy.[41]
Meloxikam byl povolen pro použití u skotu v celé Evropské unii v lednu 1998 prostřednictvím a centralizovaná registrace.[42] První obecný Produkt meloxicam byl schválen v roce 2006.[42]
Ostatní země
Od června 2008[Aktualizace], meloxikam je registrován pro dlouhodobé použití u koček v Austrálii, na Novém Zélandu a v Kanadě.[40]
Viz také
Reference
- ^ A b Používejte během těhotenství a kojení
- ^ A b C d E F Noble S, Balfour JA (březen 1996). „Meloxicam“. Drogy. 51 (3): 424–30, diskuse 431–32. doi:10.2165/00003495-199651030-00007. PMID 8882380.
- ^ Britské národní složení: BNF 76 (76 ed.). Pharmaceutical Press. 2018. s. 1112–1113. ISBN 9780857113382.
- ^ A b C d E F G h i j „Monografie meloxikamu pro profesionály“. Drugs.com. AHFS. Archivováno z původního dne 23. prosince 2018. Citováno 23. prosince 2018.
- ^ A b „Baudax Bio oznamuje schválení FDA společnosti Anjeso pro léčbu středně silné až silné bolesti“. Baudax Bio, Inc. (Tisková zpráva). 20. února 2020. Archivováno z původního dne 21. února 2020. Citováno 20. února 2020.
- ^ Fischer J, Ganellin CR (2006). Analogový objev drog. John Wiley & Sons. p. 519. ISBN 9783527607495. Archivováno z původního dne 10. července 2020. Citováno 30. června 2020.
- ^ „Top 300 roku 2020“. ClinCalc. Archivováno z původního dne 18. března 2020. Citováno 11. dubna 2020.
- ^ „Statistika užívání meloxikamu“. ClinCalc. 23. prosince 2019. Archivováno z původního dne 12. dubna 2020. Citováno 11. dubna 2020.
- ^ Stamm O, Latscha U, Janeček P, Campana A (leden 1976). „Vývoj speciální elektrody pro kontinuální subkutánní měření pH v pokožce hlavy dítěte“. American Journal of Obstetrics and Gynecology. 124 (2): 193–5. doi:10.1016 / S0002-9378 (16) 33297-5. PMID 2012.
- ^ A b Hawkey C, Kahan A, Steinbrück K, Alegre C, Baumelou E, Bégaud B a kol. (Září 1998). „Gastrointestinální snášenlivost meloxikamu ve srovnání s diklofenakem u pacientů s osteoartritidou. Mezinárodní studijní skupina MELISSA. Hodnocení bezpečnosti mezinárodní studie Meloxicam“. British Journal of Rheumatology. 37 (9): 937–45. doi:10.1093 / revmatologie / 37.9.937. PMID 9783757.
- ^ Dequeker J, Hawkey C, Kahan A, Steinbrück K, Alegre C, Baumelou E a kol. (Září 1998). „Zlepšení gastrointestinální snášenlivosti selektivního inhibitoru cyklooxygenázy (COX) -2, meloxikamu, ve srovnání s piroxikamem: výsledky studie o bezpečnosti a účinnosti ve velkém měřítku při hodnocení léčby COX-inhibující terapie (SELECT) u osteoartritidy“. British Journal of Rheumatology. 37 (9): 946–51. doi:10.1093 / revmatologie / 37.9.946. PMID 9783758.
- ^ Wojtulewski JA, Schattenkirchner M, Barceló P, Le Loët X, Bevis PJ, Bluhmki E, Distel M (duben 1996). „Šestiměsíční dvojitě zaslepená studie porovnávající účinnost a bezpečnost meloxikamu 7,5 mg denně a naproxenu 750 mg denně u pacientů s revmatoidní artritidou“. British Journal of Rheumatology. 35 Suppl 1: 22–8. doi:10.1093 / revmatologie / 35.suppl_1.22. PMID 8630632.
- ^ Singh G, Lanes S, Triadafilopoulos G (červenec 2004). „Riziko závažných tromboembolických komplikací horního zažívacího traktu a kardiovaskulárního systému s meloxikamem“. American Journal of Medicine. 117 (2): 100–6. doi:10.1016 / j.amjmed.2004.03.012. PMID 15234645.
- ^ A b „FDA varuje, že užívání léků proti bolesti a horečce ve druhé polovině těhotenství by mohlo vést ke komplikacím“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA) (Tisková zpráva). 15. října 2020. Citováno 15. října 2020.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ A b „NSAID mohou u nenarozených dětí způsobit vzácné problémy s ledvinami“. US Food and Drug Administration. 21. července 2017. Citováno 15. října 2020.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ „Meloxikam“. MedlinePlus. Archivováno z původního dne 29. listopadu 2014. Citováno 15. listopadu 2014.
- ^ „Meloxikam“. Drugs.com. Archivováno z původního dne 16. listopadu 2014. Citováno 15. listopadu 2014.
- ^ A b „Meloxicam, oficiální informace FDA, vedlejší účinky a použití“. Drugs.com. Březen 2010. Archivováno z původního dne 16. března 2010. Citováno 17. března 2010.
- ^ Engelhardt G, Homma D, Schlegel K, Utzmann R, Schnitzler C (říjen 1995). „Protizánětlivé, analgetické, antipyretické a související vlastnosti meloxikamu, nového nesteroidního protizánětlivého činidla s příznivou gastrointestinální tolerancí.“ Výzkum zánětu. 44 (10): 423–33. doi:10.1007 / BF01757699. PMID 8564518. S2CID 37937305.
- ^ A b C d „Štítek tablety Mobic- meloxicam“. DailyMed. 11. října 2018. Archivováno od původního dne 1. září 2020. Citováno 2. srpna 2019.
- ^ „Meloxicam (profesionální doporučení pro pacienta)“. Drugs.com. Archivováno z původního dne 6. srpna 2019. Citováno 6. srpna 2019.
- ^ A b Panel odborníků na aktualizaci kritérií americké společnosti pro geriatrickou společnost 2019 (duben 2019). „American Geriatrics Society 2019 updated AGS Beers Criteria® for Potentially Nevhodné Medication Use in Older Adults“. Journal of the American Geriatrics Society. 67 (4): 674–694. doi:10.1111 / jgs.15767. PMID 30693946. S2CID 59338182.
- ^ Použití mimo značku popsané v: Arnold Plotnick MS, DVM, ACVIM, ABVP, Správa bolesti pomocí Metacam Archivováno 14.07.2011 na Wayback Machine a Stein, Robert, Perioperační léčba bolesti Archivováno 18. dubna 2010 v Wayback Machine Část IV, Pohled za butorfanol, září 2006, Skupina pro podporu veterinární anestézie a analgetik.
- ^ Pro použití mimo označení u králíků viz Krempels, Dana, Paréza zadních končetin a paralýza u králíků Archivováno 17. června 2010 v Wayback Machine, Biologické oddělení University of Miami.
- ^ Boström IM, Nyman G, Hoppe A, Lord P (leden 2006). "Účinky meloxikamu na funkci ledvin u psů s hypotenzí během anestézie". Veterinární anestézie a analgezie. 33 (1): 62–9. doi:10.1111 / j.1467-2995.2005.00208.x. PMID 16412133.
- ^ Höglund OV, Dyall B, Gräsman V, Edner A, Olsson U, Höglund K (říjen 2018). "Vliv nesteroidních protizánětlivých léků na pooperační respirační a srdeční frekvenci u koček podrobených ovariohysterektomii". Journal of Feline Medicine and Surgery. 20 (10): 980–984. doi:10.1177 / 1098612X17742290. PMID 29165006. S2CID 30649716.
- ^ „Stručný přehled toxikologie: 10 nejčastějších toxikóz u koček“. Dvm360. 1. června 2006. Archivováno z původního dne 29. srpna 2018. Citováno 16. září 2018.
- ^ Merola V, Dunayer E (červen 2006). "10 nejčastějších toxikóz u koček" (PDF). Veterinární medicína: 340–342. Archivováno (PDF) z původního dne 9. srpna 2019. Citováno 9. srpna 2019.
- ^ KuKanich, Kate; George, Christopher; Roush, James K; Sharp, Sherry; Farace, Giosi; Yerramilli, Murthy; Peterson, Sarah; Grauer, Gregory F (29. června 2020). "Účinky nízké dávky meloxikamu u koček s chronickým onemocněním ledvin". Journal of Feline Medicine and Surgery: 1098612X2093575. doi:10.1177 / 1098612X20935750. PMID 32594827.
- ^ Swan G, Naidoo V, Cuthbert R, Green RE, Pain DJ, Swarup D a kol. (Březen 2006). „Odstranění hrozby diklofenaku kriticky ohroženým asijským supům“. PLOS Biology. 4 (3): e66. doi:10.1371 / journal.pbio.0040066. PMC 1351921. PMID 16435886.
- ^ A b C Khan SA, McLean MK (březen 2012). "Toxikologie často se vyskytujících nesteroidních protizánětlivých léků u psů a koček". Veterinární kliniky Severní Ameriky. Praxe pro malá zvířata. 42 (2): 289–306, vi – vii. doi:10.1016 / j.cvsm.2012.01.003. PMID 22381180.
- ^ Kimble B, Black LA, Li KM, Valtchev P, Gilchrist S, Gillett A, et al. (Říjen 2013). "Farmakokinetika meloxikamu u koal (Phascolarctos cinereus) po intravenózním, subkutánním a orálním podání". Journal of Veterinary Pharmacology and Therapeutics. 36 (5): 486–93. doi:10.1111 / jvp.12038. PMID 23406022.
- ^ „NADA 141-213: New Animal Drug Application Schválení (pro Metacam (meloxikam) 0,5 mg / ml a 1,5 mg / ml orální suspenze)“ (PDF). Úřad pro kontrolu potravin a léčiv (FDA). 15. dubna 2003. Archivovány od originál (PDF) dne 6. dubna 2017. Citováno 24. července 2010.
- ^ „Informační list klienta pro Metacam (meloxikam) 1,5 mg / ml perorální suspenze“ (PDF). Úřad pro kontrolu potravin a léčiv (FDA). Leden 2005. Archivovány od originál (PDF) dne 15. listopadu 2017.
Metacam je nesteroidní protizánětlivý lék na předpis (NSAID), který se používá k potlačení bolesti a zánětu (bolestivosti) v důsledku osteoartrózy u psů. Osteoartróza (OA) je bolestivý stav způsobený „opotřebením“ chrupavky a jiných částí kloubů, které může u vašeho psa vést k následujícím změnám nebo známkám: kulhání nebo kulhání, snížená aktivita nebo cvičení (neochota stát, šplhat schody, skok nebo běh nebo potíže s prováděním těchto činností), ztuhlost nebo snížený pohyb kloubů. Metacam se psům podává ústy. Nepoužívejte perorální suspenzi Metacam u koček. Akutní poranění ledvin a smrt byly spojeny s použitím meloxikamu u koček.
- ^ „NADA 141-219: Metacam (meloxicam) 5 mg / ml injekční roztok“ (PDF). NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 12. listopadu 2003. Archivovány od originál (PDF) dne 15. listopadu 2017. Citováno 8. srpna 2019.
- ^ „Metacam 5 mg / ml injekční roztok, dodatečné schválení“ (PDF). NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 28. října 2004. Archivovány od originál (PDF) dne 15. listopadu 2017. Citováno 8. srpna 2019.
- ^ Viz výrobce FAQ Archivováno 2. července 2011 v Wayback Machine na svých webových stránkách a klinické pokyny pro dávkování pro kočky. Archivováno 2008-09-06 na Wayback Machine
- ^ „Oznámení o porušení“ (PDF). NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 19. dubna 2005. Archivovány od originál (PDF) dne 13. ledna 2017. Citováno 8. srpna 2019.
- ^ „Injekce Anjeso (meloxikam) pro intravenózní podání“ (PDF). NÁS. Úřad pro kontrolu potravin a léčiv (FDA). Únor 2020. Archivováno (PDF) z původního dne 22. února 2020. Citováno 21. února 2020.
- ^ A b Gaschen FP, Schaer M, eds. (2016). „Nedávný vývoj NSAID“. Klinická medicína psa a kočky (3. vyd.). CRC Press. ISBN 9781482226065. Archivováno od původního dne 1. září 2020. Citováno 28. ledna 2020.
- ^ Maddison JE, Page SW, Church D, eds. (2008). „Meloxicam“. Klinická farmakologie malých zvířat (2. vyd.). Edinburgh: Saunders / Elsevier. str.301 –302. ISBN 9780702028588.
- ^ A b Wright E (březen 2007). „Generické a biologicky podobné léčivé přípravky v Evropské unii“ (PDF). Chemie dnes. 25 (2): 4–6. Archivováno (PDF) z původního dne 28. ledna 2020. Citováno 28. ledna 2020.
externí odkazy
- „Meloxikam“. Informační portál o drogách. Americká národní lékařská knihovna.
