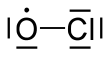Oxid chloričitý - Chlorine monoxide - Wikipedia
Tento článek obsahuje seznam obecných Reference, ale zůstává z velké části neověřený, protože postrádá dostatečné odpovídající vložené citace. (Duben 2020) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Oxid chloričitý | |||
| Systematický název IUPAC Chlorooxidanyl | |||
| Ostatní jména Chlor (II) oxid | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| Zkratky | ClO (.) | ||
| ChEBI | |||
| ChemSpider | |||
| Pletivo | Chlorosyl | ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| ClÓ | |||
| Molární hmotnost | 51.45 g · mol−1 | ||
| Termochemie | |||
Std entalpie of formace (ΔFH⦵298) | 101,8 kJ / mol[1] | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Oxid chloričitý je chemická látka radikální s chemickým vzorcem . Hraje důležitou roli v procesu poškozování ozonové vrstvy. V stratosféra, chlór atomy reagují s ozón molekuly za vzniku oxidu chloričitého a kyslík.
Tato reakce způsobuje vyčerpání ozonové vrstvy.[1] Tento výsledek radikály mohou dále reagovat jako takové:
regenerace chlorového radikálu. Tímto způsobem je celková reakce na rozklad ozonu katalyzována chlorem, protože nakonec chlor zůstává nezměněn. Celková reakce je:
To byl významný dopad používání CFC v horní stratosféře se však mnoho zemí dohodlo na zákazu používání CFC. Nereaktivní povaha CFC jim umožňuje přejít do stratosféry, kde procházejí foto-disociací za vzniku radikálů Cl. Ty pak snadno tvoří oxid chloričitý a tento cyklus může pokračovat až do dvou radikály reagovat na formu oxid chloričitý, ukončení radikální reakce. Protože koncentrace CFC v atmosféře je velmi nízká, je pravděpodobnost ukončení reakce mimořádně nízká, což znamená, že každý radikál může rozložit mnoho tisíc molekul ozonu.
I když bylo používání CFC v mnoha zemích zakázáno, CFC mohou zůstat v atmosféře asi 50-500 let. To způsobí produkci mnoha chlorových radikálů, a proto se značné množství molekul ozonu rozloží, než jsou chlorové radikály schopné reagovat s oxidem chlorovodíkem za vzniku Oxid dichlornatý.
Reference
- ^ A b Egon Wiberg; Nils Wiberg; Arnold Frederick Holleman (2001). Anorganická chemie. Akademický tisk. p. 462. ISBN 0-12-352651-5.
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |