Hydroxid hlinitý - Aluminium hydroxide
 | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC Hydroxid hlinitý | |
| Systematický název IUPAC Trioxidanid hlinitý (3+) | |
| Ostatní jména Kyselina hlinitá Hydroxid hlinitý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.040.433 |
| KEGG | |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti[1][2] | |
| Al (OH)3 | |
| Molární hmotnost | 78,00 g / mol |
| Vzhled | Bílý amorfní prášek |
| Hustota | 2,42 g / cm3, pevný |
| Bod tání | 300 ° C (572 ° F; 573 K) |
| 0,0001 g / 100 ml | |
Produkt rozpustnosti (K.sp) | 3×10−34 |
| Rozpustnost | rozpustný v kyseliny a zásady |
| Kyselost (strK.A) | >7 |
| Isoelektrický bod | 7.7 |
| Termochemie[3] | |
Std entalpie of formace (ΔFH⦵298) | -1277 kJ · mol−1 |
| Farmakologie[4] | |
| A02AB01 (SZO) | |
| |
| Nebezpečí | |
| Bezpečnostní list | Externí bezpečnostní list |
| Piktogramy GHS |  |
| H319, H335 | |
| P264, P261, P280, P271, P312, P304 + 340, P305 + 351 + 338, P337 + 313 | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | Nehořlavé |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | > 5000 mg / kg (potkan, orálně) |
| Související sloučeniny | |
jiný anionty | Žádný |
Související sloučeniny | Oxid sodný, hydroxid hlinitý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Hydroxid hlinitýAl (OH)3, se v přírodě vyskytuje jako minerál gibbsite (také známý jako hydrargillit) a jeho tři mnohem vzácnější polymorfy: bayerit, doyleit a nordstrandit. Hydroxid hlinitý je amfoterní v přírodě, tj. má obojí základní a kyselé vlastnosti. Úzce související jsou hydroxid hlinitý, AlO (OH) a oxid hlinitý nebo oxid hlinitý (Al2Ó3), druhý z nich je také amfoterický. Tyto sloučeniny společně tvoří hlavní složky hliníku Ruda bauxit.
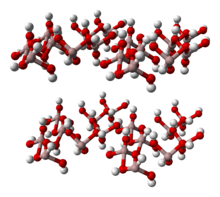
Struktura
Al (OH)3 je tvořen dvojitými vrstvami hydroxylových skupin s hliníkovými ionty zabírajícími dvě třetiny oktaedrických otvorů mezi těmito dvěma vrstvami.[5][6] Čtyři polymorfy jsou uznány.[7] Všechny vrstvy funkcí z osmistěn jednotky hydroxidu hlinitého, s Vodíkové vazby mezi vrstvami. Polymorfy se liší z hlediska skládání vrstev. Všechny formy Al (OH)3 krystaly jsou šestihranné[sporný ]:
- gibbsite je také známý jako γ-Al (OH)3 [8] nebo α-Al (OH)3[Citace je zapotřebí ]
- bayerit je také známý jako α-Al (OH)3 [8] nebo P-alumina trihydrát [Citace je zapotřebí]
- nordstrandite je také známý jako Al (OH)3[8]
- doyleit
Hydrargillit, kdysi považován za hydroxid hlinitý, je fosforečnan hlinitý. Nicméně obě gibbsite a hydrargillit odkazují na stejný polymorfismus hydroxidu hlinitého s gibbsite používané nejčastěji ve Spojených státech a hydrargillit v Evropě používán častěji. Hydrargillite je pojmenován po řecký slova pro vodu (Hydra) a jíl (argylles).
Vlastnosti
Hydroxid hlinitý je amfoterní. v kyselina, funguje jako Brønsted – Lowryho základna. Neutralizuje kyselinu a poskytuje sůl:[9]
- 3 HCl + Al (OH)3 → AlCl3 + 3 H2Ó
V základnách působí jako a Lewisova kyselina vazbou hydroxidových iontů:[9]
- Al (OH)3 + OH− → Al (OH)4−
Výroba

Prakticky veškerý komerčně používaný hydroxid hlinitý vyrábí společnost Bayerův proces[10] což zahrnuje rozpuštění bauxit v hydroxidu sodném při teplotách do 270 ° C (518 ° F). Odpadní pevná látka, hlušina z bauxitu, se odstraní a hydroxid hlinitý se vysráží ze zbývajícího roztoku hlinitan sodný. Tento hydroxid hlinitý lze převést na oxid hlinitý nebo oxid hlinitý kalcinace.
Zbytek nebo hlušina z bauxitu, který je většinou oxidem železitým, je vysoce leptavý kvůli zbytkovému hydroxidu sodnému. Historicky byl uložen v lagunách; to vedlo k Nehoda rostliny oxidu hlinitého Ajka v roce 2010 v Maďarsku, kde prasknutí hráze vedlo k utonutí devíti lidí. Dalších 122 hledalo léčbu chemických popálenin. Bláto kontaminovalo 40 kilometrů čtverečních (15 čtverečních mil) půdy a dosáhlo Dunaj. Zatímco bahno bylo považováno za netoxické kvůli nízkým hladinám těžkých kovů, související kal měl pH 13.[11]
Použití
Samozhášivá výplň
Hydroxid hlinitý také nachází použití jako samozhášivé plnivo pro polymerní aplikace. Je vybrán pro tyto aplikace, protože je bezbarvý (jako většina polymerů), levný a má dobré protipožární vlastnosti.[12] Hydroxid hořečnatý a směsi lovec a hydromagnesit se používají obdobně[13][14][15][16][17] Rozkládá se při asi 180 ° C (356 ° F), absorbuje značné množství tepla v procesu a vydává vodní páru. Kromě toho, že se chová jako zpomalovač hoření, je velmi účinný jako prostředek potlačující kouř v celé řadě polymerů, zejména v polyesterech, akrylech, ethylenvinylacetátu, epoxidech, PVC a gumě.[18]
Předchůdce Al sloučenin
Hydroxid hlinitý je a surovina pro výrobu jiných sloučenin hliníku: specialita kalcinovaný aluminy, síran hlinitý, polyaluminium chlorid, chlorid hlinitý, zeolity, hlinitan sodný, aktivovaný oxid hlinitý a dusičnan hlinitý.[6]
Vytvoří se čerstvě vysrážený hydroxid hlinitý gely, které jsou základem pro aplikaci solí hliníku jako flokulanty při čištění vody. Tento gel časem krystalizuje. Gely na bázi hydroxidu hlinitého lze dehydratovat (např. Použitím nevodných rozpouštědel mísitelných s vodou, např ethanol ) za vzniku prášku amorfního hydroxidu hlinitého, který je snadno rozpustný v kyselinách. Topení jej převádí na aktivované aluminy, které se používají jako vysoušedla, adsorbent při čištění plynu a nosiče katalyzátoru.[12]
Farmaceutické
Pod obecným názvem „algeldrate“ se hydroxid hlinitý používá jako antacida u lidí a zvířat (zejména koček a psů). Je upřednostňován před jinými alternativami, jako je hydrogenuhličitan sodný protože Al (OH)3, protože je nerozpustný, nezvyšuje pH žaludku nad 7, a proto nespouští sekreci přebytečné kyseliny žaludkem. Značky zahrnují Alu-Cap, Aludrox, Gaviscon nebo Pepsamar. Reaguje s přebytečnou kyselinou v žaludku a snižuje kyselost obsahu žaludku,[19][20] které mohou zmírnit příznaky vředy, pálení žáhy nebo dyspepsie. Takové výrobky mohou způsobit zácpa, protože ionty hliníku inhibují kontrakce hladký sval buňky v zažívacím traktu, zpomalují peristaltika a prodloužení doby potřebné k průchodu stolice skrz dvojtečka.[21] Některé takové produkty jsou formulovány tak, aby tyto účinky minimalizovaly zahrnutím stejných koncentrací hydroxid hořečnatý nebo uhličitan hořečnatý, které mají vyvažování projímadlo účinky.[22]
Tato sloučenina se také používá ke kontrole hyperfosfatémie (zvýšené fosfát nebo hladiny fosforu v krvi) u lidí a zvířat trpících selháním ledvin. Ledviny normálně filtrují přebytečný fosfát z krve, ale selhání ledvin může způsobit akumulaci fosfátu. Sůl hliníku se při požití váže na fosfát v střeva a snížit množství fosforu, které lze absorbovat.[23][24]
Srážky hydroxid hlinitý je zahrnut jako adjuvans v některých vakcíny (např. vakcína proti antraxu ). Jednou ze známých značek adjuvans hydroxidu hlinitého je Alhydrogel, vyráběný společností Brenntag Biosector.[25][úplná citace nutná ] Jelikož dobře absorbuje bílkoviny, funguje také ke stabilizaci vakcín tím, že zabraňuje srážení nebo ulpívání proteinů ve vakcíně během skladování na stěnách nádoby. Hydroxid hlinitý se někdy nazývá „kamenec ", termín obecně vyhrazený pro jeden z několika síranů.[Citace je zapotřebí ]
Vakcínové přípravky obsahující hydroxid hlinitý stimulují imunitní systém vyvoláním uvolnění kyselina močová, imunologický nebezpečí signál. To silně přitahuje určité typy monocyty které rozlišují na dendritické buňky. Dendritické buňky zachytí antigen a přenesou ho lymfatické uzliny a stimulovat T buňky a B buňky.[26] Zdá se, že to přispívá k vyvolání dobra Th2 reakce, takže je užitečná pro imunizaci proti patogenům, které jsou blokovány protilátkami. Má však malou kapacitu stimulovat buněčné (Th1) imunitní odpovědi, důležité pro ochranu před mnoha patogeny,[27] není také užitečné, pokud je antigen peptid -na základě.[28]
Bezpečnost
V 60. a 70. letech se spekulovalo, že hliník souvisí s různými neurologické poruchy, počítaje v to Alzheimerova choroba.[29][30] Od té doby několik epidemiologické studie nezjistily žádnou souvislost mezi expozicí prostředí nebo spolknutým hliníkem a neurologickými poruchami, ačkoli injekční hliník nebyl v těchto studiích zkoumán.[31][32][33]
Reference
- ^ Pro produkt rozpustnosti: „Archivovaná kopie“. Archivovány od originál dne 15. června 2012. Citováno 17. května 2012.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ Pro izoelektrický bod: Gayer, K. H .; Thompson, L. C .; Zajicek, O. T. (září 1958). „Rozpustnost hydroxidu hlinitého v kyselém a zásaditém prostředí při 25 ° C“. Canadian Journal of Chemistry. 36 (9): 1268–1271. doi:10.1139 / v58-184. ISSN 0008-4042.
- ^ Zumdahl, Steven S. (2009). Chemické principy (6. vydání). Společnost Houghton Mifflin. ISBN 978-0-618-94690-7.
- ^ Black, Ronald A .; Hill, D. Ashley (15. června 2003). „Volně prodejné léky v těhotenství“. Americký rodinný lékař. 67 (12): 2517–2524. ISSN 0002-838X. PMID 12825840. Citováno 1. července 2017.
- ^ Wells, A. F. (1975), Strukturní anorganická chemie (4. vydání), Oxford: Clarendon Press
- ^ A b Evans, K. A. (1993). "Vlastnosti a použití oxidů a hydroxidů hlinitých". V A. J. Downs (ed.). Chemie hliníku, gália, india a thalia (1. vyd.). Londýn; New York: Blackie Academic & Professional. ISBN 9780751401035.
- ^ Karamalidis, A. K .; Dzombak D. A. (2010). Modelování komplexace povrchů: Gibbsite. John Wiley & Sons. str. 15–17. ISBN 978-0-470-58768-3.
- ^ A b C Wefers, Karl; Misra, Chanakya (1987). Oxidy a hydroxidy hliníku. Alcoa Research Laboratories. str. 2. OCLC 894928306.
- ^ A b Bez hranic (26. července 2016). „Základní a amfoterní hydroxidy“. Neomezená chemie. Archivovány od originál dne 22. srpna 2017. Citováno 2. července 2017.
- ^ Hind, AR; Bhargava SK; Grocott SC (1999). „Surface Chemistry of Bayer Process Solids: A Review“. Koloidy surfují po fyziochemických aspektech. 146 (1–3): 359–74. doi:10.1016 / S0927-7757 (98) 00798-5.
- ^ „Maďarské bitvy zastavily příval toxického kalu“. BBC News Web. 5. října 2010.
- ^ A b Hudson, L. Keith; Misra, Chanakya; Perrotta, Anthony J .; Wefers, Karl; Williams, F. S. (2000). "Oxid hlinitý". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a01_557.
- ^ Hollingbery, LA; Hull TR (2010). „Chování zpomalujícího hoření huntitu a hydromagnesitu - recenze“ (PDF). Degradace polymerů a stabilita. 95 (12): 2213–2225. doi:10.1016 / j.polymdegradstab.2010.08.019.
- ^ Hollingbery, LA; Hull TR (2010). „Tepelný rozklad huntitu a hydromagnesitu - recenze“ (PDF). Thermochimica Acta. 509 (1–2): 1–11. doi:10.1016 / j.tca.2010.06.012.
- ^ Hollingbery, LA; Hull TR (2012). „Účinky huntitu zpomalujícího hoření v přírodních směsích s hydromagnesitem“ (PDF). Degradace polymerů a stabilita. 97 (4): 504–512. doi:10.1016 / j.polymdegradstab.2012.01.024.
- ^ Hollingbery, LA; Hull TR (2012). „Tepelný rozklad přírodních směsí huntitu a hydromagnesitu“ (PDF). Thermochimica Acta. 528: 45–52. doi:10.1016 / j.tca.2011.11.002.
- ^ Hull, TR; Witkowski A; Hollingbery LA (2011). „Činidlo zpomalující hoření minerálních plniv“ (PDF). Degradace polymerů a stabilita. 96 (8): 1462–1469. doi:10.1016 / j.polymdegradstab.2011.05.006.
- ^ Materiály vyvinuté společností Huber. „Aditiva zpomalující hoření od společnosti Halogen“ (PDF). Citováno 3. července 2017.
- ^ Galbraith, A; Bullock, S; Manias, E; Hunt, B; Richards, A (1999). Základy farmakologie: text pro zdravotní sestry a zdravotníky. Harlow: Pearson. str. 482.
- ^ Papich, Mark G. (2007). "Hydroxid hlinitý a uhličitan hlinitý". Saunders Handbook of Veterinary Drugs (2. vyd.). St. Louis, Mo: Saunders / Elsevier. str. 15–16. ISBN 9781416028888.
- ^ Washington, Neena (2. srpna 1991). Antacida a činidla proti zpětnému toku. Boca Raton, FL: CRC Press. str. 10. ISBN 978-0-8493-5444-1.
- ^ Bill, Robert L. (1. září 2016). Klinická farmakologie a terapeutika pro veterinární techniky - elektronická kniha. Elsevier Health Sciences. str. 105. ISBN 9780323444026.
- ^ Plumb, Donald C. (2011). "Hydroxid hlinitý". Příručka Plumb's Veterinary Drug Handbook (7. vydání). Stockholm, Wisconsin; Ames, Iowa: Wiley. s. 36–37. ISBN 9780470959640.
- ^ Lifelearn Inc. (1. listopadu 2010). "Hydroxid hlinitý". Poznej svého mazlíčka. Citováno 30. června 2017.
- ^ „O Brenntag Biosector - Brenntag“. brenntag.com. Citováno 19. dubna 2018.
- ^ Kool, M; Soullié T; van Nimwegen M; Willart MA; Muskens F; Jung S; Hoogsteden HC; Hammad H; Lambrecht BN (24. března 2008). „Kamencové adjuvans zvyšuje adaptivní imunitu indukcí kyseliny močové a aktivací zánětlivých dendritických buněk“. J Exp Med. 205 (4): 869–82. doi:10.1084 / jem.20071087. PMC 2807488. PMID 18362170.
- ^ Petrovsky N, Aguilar JC (2004). "Vakcínové adjuvans: současný stav a budoucí trendy". Immunol Cell Biol. 82 (5): 488–96. doi:10.1111 / j.0818-9641.2004.01272.x. PMID 15479434. S2CID 154670.
- ^ Cranage, MP; Robinson A (2003). Robinson A; Hudson MJ; Cranage MP (eds.). Protokoly o očkování - svazek 87 metod v biomedicínských protokolech v molekulární medicíně (2. vyd.). Springer. str. 176. ISBN 978-1-59259-399-6.
- ^ „Alzheimerův mýtus“. Alzheimerova asociace. Citováno 29. července 2012.
- ^ Khan, A (1. září 2008). „Hliník a Alzheimerova choroba“. Alzheimerova společnost. Archivovány od originál dne 11. března 2012. Citováno 8. března 2012.
- ^ Rondeau V (2002). „Přehled epidemiologických studií o hliníku a oxidu křemičitém ve vztahu k Alzheimerově chorobě a souvisejícím poruchám“. Rev Environ Health. 17 (2): 107–21. doi:10.1515 / REVEH.2002.17.2.107. PMC 4764671. PMID 12222737.
- ^ Martyn CN, Coggon DN, Inskip H, Lacey RF, Young WF (květen 1997). „Koncentrace hliníku v pitné vodě a riziko Alzheimerovy choroby“. Epidemiologie. 8 (3): 281–6. doi:10.1097/00001648-199705000-00009. JSTOR 3702254. PMID 9115023. S2CID 32190038.
- ^ Graves AB, Rosner D, Echeverria D, Mortimer JA, Larson EB (září 1998). „Pracovní expozice rozpouštědlům a hliníku a odhadované riziko Alzheimerovy choroby“. Occup Environ Med. 55 (9): 627–33. doi:10.1136 / oem.55.9.627. PMC 1757634. PMID 9861186.
externí odkazy
- Mezinárodní karta chemické bezpečnosti 0373
- „Některé vlastnosti hydroxidu hlinitého se vysráží za přítomnosti jílů“, Soil Research Institute, R C Turner, Department of Agriculture, Ottawa
- Vliv stárnutí na vlastnosti polynukleárních hydroxyaluminiových kationtů
- Druhý druh polynukleárního kationu hydroxyaluminia, jeho tvorba a některé jeho vlastnosti


