Hydroxid lanthanitý - Lanthanum hydroxide
Tento článek má několik problémů. Prosím pomozte vylepši to nebo diskutovat o těchto otázkách na internetu diskusní stránka. (Zjistěte, jak a kdy tyto zprávy ze šablony odebrat) (Zjistěte, jak a kdy odstranit tuto zprávu šablony)
|
 __ Los Angeles3+ __ ACH− | |
| Jména | |
|---|---|
| Název IUPAC Hydroxid lanthanitý (III) | |
| Identifikátory | |
| ChemSpider | |
| Informační karta ECHA | 100.034.994 |
| Číslo ES |
|
PubChem CID |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti | |
| La (OH)3 | |
| Molární hmotnost | 189,93 g / mol |
| K.sp= 2.00·10−21 | |
| Struktura | |
| šestihranný | |
| P63/ m, č. 176 | |
A = 6,447 Å, C = 3,854 Å | |
| Nebezpečí | |
| Hlavní nebezpečí | Dráždivý |
| R-věty (zastaralý) | R36 / 37 |
| S-věty (zastaralý) | S26, S22, S37 / 39 |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | Nehořlavé |
| Související sloučeniny | |
jiný anionty | Chlorid lanthanitý |
jiný kationty | Hydroxid ceritý Hydroxid skandnatý (III) Hydroxid yttritý Aktinium (III) hydroxid |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Hydroxid lanthanitý je La (OH)
3, a hydroxid z prvek vzácných zemin lanthan.
Syntéza
Hydroxid lanthanitý lze získat přidáním alkálie jako amoniak na vodné roztoky soli lanthanu jako dusičnan lanthanitý. Tak vznikne gel sraženina které pak mohou být sušeny na vzduchu.[1]
Alternativně jej může vyrobit společnost hydratační reakce (přidání vody) do oxid lanthanitý.[2]
Vlastnosti
Hydroxid lanthanitý příliš nereaguje s alkalickými látkami, je však mírně rozpustný v kyselém roztoku.[1] Při teplotách nad 330 ° C se rozkládá na hydroxid oxidu lanthanitého LaOOH, který se při dalším zahřívání rozkládá na oxid lanthanitý.[3]
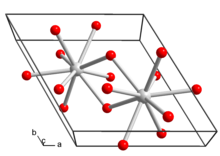
Hydroxid lanthanitý krystalizuje v hexagonální krystalový systém. Každý iont lanthanu v krystalové struktuře je obklopen devíti hydroxidovými ionty v a tricapped trigonální hranol.[4]
Reference
- ^ A b E.V. Shkolnikov: Termodynamická charakterizace amfoterismu hydroxidů a oxidů prvků podskupiny Scandium ve vodném prostředí, v: Russian Journal of Applied Chemistry, 2009, 82 (2), S. 2098–2104.
- ^ Jiawen Ding, Yanli Wu, Weili Sun, Yongxiu Li: Příprava La (OH)3 a La2Ó3 s Rod Morphology od Simple Hydration of La2Ó3, v: Journal of Rare Earths, 2006 Srpen, 24 (4), S. 440-442; doi:10.1016 / S1002-0721 (06) 60139-7.
- ^ Michael E. Brown, Patrick Kent Gallagher: Příručka tepelné analýzy a kalorimetrie, S. 482; ISBN 978-0-44453123-0.
- ^ Beall, G.W .; Milligan, W.O .; Wolcott, Herbert A. (1977). "Strukturální trendy v trihydroxidech lanthanoidu". Journal of Anorganic and Nuclear Chemistry. 39 (1): 65–70. doi:10.1016 / 0022-1902 (77) 80434-X.
externí odkazy
- "Lanthan - Informace o prvku, vlastnosti a použití - Periodická tabulka". rsc.org.
- Externí bezpečnostní list 1
- Externí bezpečnostní list 2
- Bezpečnostní list Oxidu lanthanitého
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |




![{ displaystyle mathrm {La (OH) _ {3} { xrightarrow [{- H_ {2} O}] {330 ^ {o} C}} LaOOH}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/950dafbdca1b182a25236f9c2beab44f63f5be62)
![{ displaystyle mathrm {2 LaOOH { xrightarrow [{- H_ {2} O}] { Delta}} La_ {2} O_ {3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fcf068415d4e63b6e97eeae2941dfdf7d8b69b9d)