Triacetát hlinitý - Aluminium triacetate
| Jména | |
|---|---|
| Název IUPAC Octan hlinitý | |
| Ostatní jména Octan hlinitý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.004.868 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti | |
| C6H9AlÓ6 | |
| Molární hmotnost | 204.114 g · mol−1 |
| Vzhled | bílá pevná látka[1] |
| rozpustný | |
| Související sloučeniny | |
Související sloučeniny | Základní diacetát hlinitý (hydroxyaluminium diacetát), CAS RN 142-03-0, HOAl (CH 3CO 2) 2[1] Dibasic monoacetát hlinitý (dihydroxyaluminiumacetát), CAS RN 7360-44-3, (HO) 2AlCH 3CO 2 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Triacetát hlinitý, formálně pojmenovaný octan hlinitý,[2] je chemická sloučenina se složením Al (CH
3CO
2)
3. Pod standardní podmínky vypadá to jako bílá, voda -rozpustná pevná látka[1] který se rozkládá při zahřátí na přibližně 200 ° C.[3] Triacetát hydrolyzuje na směs bazického hydroxidu / acetát soli,[4] a existuje několik druhů chemická rovnováha zejména ve vodných roztocích octanového iontu; název octan hlinitý se běžně používá pro tento smíšený systém.
Má terapeutické aplikace pro svou svědění, svíravý, a antiseptický vlastnosti,[5] a jako volně prodejná příprava jako Burowovo řešení,[6] používá se k léčbě ušní infekce.[7][8] Burowovy roztokové přípravky byly naředěny a upraveny aminokyseliny udělat je více chutný pro použití jako kloktadla pro podmínky jako aftové vředy úst.[9] v veterinární medicína se k léčbě používá trpkostní vlastnost triacetátu hlinitého Mortellaro nemoc u kopytníků, jako je skot.[10]
Triacetát hlinitý se používá jako a mořidlo prostředek s barvivy jako alizarin,[11] samostatně i v kombinaci. Dohromady s diacetát hlinitý[12] nebo s sulfacetát hlinitý[13] používá se s bavlna, jiný celulóza vlákna,[14] a hedvábí.[13] Bylo také kombinováno s octan železnatý k výrobě různých barev.[15]
Nomenklatura
Podle formální pravidla pro pojmenování anorganických sloučenin, název pro Al (CH
3CO
2)
3 je octan hlinitý,[2] i když jsou přijatelnější formálnější názvy, jako je octan hlinitý a ethanoát hlinitý.[4] Použití multiplikační předpony „tri“ v názvu triacetát hlinitý, i když to není technicky nutné, se pravidelně používá, aby se zabránilo možné záměně s příbuznými sloučeninami s hydroxo ligandy. Základní diacetát hlinitý, formálně hydroxyaluminium diacetát (CAS RN 142-03-0),[1] má složení HOAl (CH
3CO
2)
2 s jedním hydroxo ligandem místo acetátového ligandu a dvojsytný monoacetát hlinitý, formálně dihydroxyaluminiumacetát (CAS RN 7360-44-3), má složení (HO)
2AlCH
3CO
2 pouze s jedním acetátovým ligandem. Tyto tři sloučeniny se liší v pevné fázi, ale obvykle se s nimi zachází jako se skupinou a jsou popsány společně jako octan hlinitý v roztoku kvůli triacetátu. hydrolyzující na směs, která zahrnuje další dvě formy.[4] Zkratka jako AlAc, spolu s variantami jako AlAc2+
a AlAc+
2, se někdy používají v disciplíně geochemie,[16] i když to není v souladu se standardní praxí v hlavním proudu chemie.[A]
Struktura
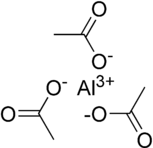

Vzorec Al (CH
3CO
2)
3 označuje přítomnost center kovového hliníku v +3 oxidační stav a acetát skupiny v poměru 1: 3. Obrázky použité k reprezentaci této látky, například ty, které jsou zobrazeny vlevo, představují dvě velmi zjednodušené aproximace struktury v pevné fázi: první je čistě čistá iontový sůl s jediným hliníkem (III) kation (Al3+) obklopen a přidružen elektrostaticky se třemi acetátovými anionty (CH
3CO−
2), ale toto by nemělo být bráno jako zprostředkování informací o Krystalická struktura. Například chlorid sodný (NaCl) má kation-an-anion stechiometrie 1: 1, ale má a kubická struktura s každým iontem obklopeným osmistěnně šesti ionty opačného náboje.[17]
Druhý obrázek je a molekulární tvoří se třemi acetátovými skupinami kovalentně vázané do kovového centra v a trigonální planární geometrie a intermolekulární interakce drží molekuly pohromadě v krystalové struktuře. Je vysoce pravděpodobné, že struktura v pevném stavu je komplikovanější a zahrnuje jak kovalentní, tak iontové charakteristiky a je možné, že více center hliníku a / nebo přemosťující acetát mohou být přítomny skupiny - obě byly hlášeny v octanu hlinitém řešení[18] a chlorid hlinitý je známo, že existuje jako Al
2Cl
6 dimer.[19]
NMR výzkumy vodného systému hliník / III prokázaly přítomnost hliníku jako hexaaqua komplex, [Al (H
2Ó)
6]3+
,[20] stejně jako mononukleární druhy s různými substitucemi. Výzkumy navíc ukazují, že významný druh fáze řešení je Al
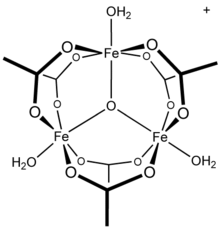
13 tridecamer,[21] A skupina uváděné v konfliktních mechanismech hydrolýzy a polymerace hliníkové roztoky.[22] Je známo, že další trojmocné kovové kationty tvoří polynukleární druhy: octan železitý například tvoří trojjadernou strukturu[23] s trojitě přemostěným oxo centrem[24] s kationtem [Fe3(μ3–O) (OAc)6(H2Ó)3]+.[25] Sloučenina hydroxid octan chromitý, Cr3(ACH)2(OAc)7, byl také popsán jako isostrukturní.[26] Analogický jsou známy sloučeniny ruthenia (III), vanadu (III), rhodia (III) a iridia (III) s trinukleárními strukturami.[27] Octan měďnatý a octan chromitý oba mají dvoujaderné dihydrátové struktury, M2(OAc)4(H2Ó)2,[28] stejně jako octan rhodnatý;[29] každý vykazuje významné interakce kov-kov.[28][29]
Chemie
Příprava
Podle CRC Handbook of Anorganic Compounds, triacetát hlinitý je bílá, ve vodě rozpustná pevná látka a obvykle se připravuje z chlorid hlinitý nebo přímo z hliník ohřevem v octová kyselina řešení s anhydrid kyseliny octové.[1]
- 3 CH
3COOH + AlCl
3 → Al (CH
3CO
2)
3 + 3 HCl
- 6 CH
3COOH + 2 Al → 2 Al (CH
3CO
2)
3 + 3 H
2
Teoreticky veškerý hliník / octan / hydroxid soli lze připravit z hydroxid hlinitý nebo hlinitan sodný a kyselinu octovou, ale tvorba triacetátu nastává pouze za nepřítomnosti vody.[4] V roztocích je hlavním produktem diacetát, který se také vyrábí zpracováním chloridu hlinitého s a octan sodný řešení v základních podmínkách.[30] Rovnice pro tyto procesy jsou:
- 2 CH
3CO
2Na + Al (OH)
3 → Al (CH
3CO
2)
2ACH + 2 NaOH
- 2 CH
3CO
2Na + AlCl
3 + NaOH → Al (CH
3CO
2)
2ACH + 3 NaCl
- 2 CH
3CO
2Na + NaAlO
2 + 2 H
2Ó → Al (CH
3CO
2)
2ACH + 3 NaOH
Vylepšený proces využívající kombinaci chlorid hlinitý a připravený hlinitan sodný s octanem sodným in situ byl patentováno:[31]
- 29 NaAlO
2 + 10 NaOH + 84 CH
3COOH + 13 AlCl
3 → 42 Al (CH
3CO
2)
2ACH + 39 NaCl + 26 H
2Ó
The mořidla triacetát hlinitý a sulfacetát hlinitý lze připravit z síran hlinitý, přičemž vzniklý produkt je určen množstvím octan olovnatý použitý:[13]
- Al
2(TAK
4)
3 + 3 Pb (CH
3CO
2)
2 → 2 Al (CH
3CO
2)
3 + 3 PbSO
4
- Al
2(TAK
4)
3 + 2 Pb (CH
3CO
2)
2 → Al
2TAK
4(CH
3CO
2)
4 + 2 PbSO
4
Rozklad
Při zahřívání se triacetát hlinitý rozkládá nad 200 ° C podobným způsobem jako v případě mravenčan hlinitý.[3] Proces začíná ztrátou anhydridu kyseliny octové (Ac
2Ó) mezi 120 a 140 ° C[1] za vzniku směsi bazických oxidových acetátů, jako je Al
2O (CH
3CO
2)
4 a Al
3O (CH
3CO
2)
7,[30] které se nakonec transformují na Al
2Ó
3 (oxid hlinitý ), nejprve jako amorfní bezvodý pevná látka a poté další pevná látka fáze (γ-, δ- a θ- krystalické formy ), aby se nakonec stal polymorfní α-Al
2Ó
3:[3]
- 2 Al (CH
3CO
2)
3 → Al
2O (CH
3CO
2)
4 + CH
3CO (O) COCH
3 → Al
2Ó
3 + 3 CH
3CO (O) COCH
3
- 2 Al (CH
3CO
2)
2ACH → Al
2Ó
3 + 2 CH
3COOH + CH
3CO (O) COCH
3
Hydrolýza
Triacetát hlinitý hydrolyzuje za vzniku mono- a di-bazického hydroxidu acetátu v roztoku nebo v hygroskopie:[4]
- Al (CH
3CO
2)
3 + H
2Ó → Al (CH
3CO
2)
2ACH + CH
3COOH
- Al (CH
3CO
2)
3 + 2 H
2Ó → Al (CH
3CO
2)(ACH)
2 + 2 CH
3COOH
Použití
Podle Národní onkologický institut, jsou použity octany hlinité místně u lidí jako antiseptické látky, které také způsobují tělesné tkáně se zmenšují.[5] Jeho adstringentní vlastnost se také používá k léčbě Mortellaro nemoc u kopytníků, jako je skot.[10] Octan hlinitý podporuje hojení infikovaná kůže a také pomáhá s zánět, svědění a bodání.[5] The Úřad pro kontrolu potravin a léčiv schválila pro použití k „dočasné úlevě od drobných podráždění kůže v důsledku ...“jedovatý břečťan,' 'jedovatý dub,' 'jed škumpy,' 'hmyzí štípnutí,' 'atletovo chodidlo „nebo„ vyrážky způsobené mýdly, čisticími prostředky, kosmetikou nebo šperky. ““[32] U těchto aplikací volně prodejné přípravky jako Burowovo řešení jsou obvykle používány,[6] zatímco zředěné formy se používají jako kloktadla pro podmínky jako aftové vředy úst, včetně s aminokyselina přísady ke zlepšení chutnost a chuť.[9] Nejběžnějším použitím Burowova řešení je léčba ušní infekce[7][8] počítaje v to otomykóza, ačkoli to obecně není tak efektivní jako klotrimazol při těchto plísňových infekcích.[33] Topický adstringentní prášek Domeboro obsahuje tetradekhydrát síranu hlinitého, [Al (H
2Ó)
6]
2(TAK
4)
3• 2H
2Ó, a monohydrát octanu vápenatého, Ca (CH
3CO
2)
2• H
2Ó, a po rozpuštění vytvoří roztok octanu hlinitého podobný Burowovu roztoku.[34] Roztoky Domeboro v teplé vodě lze použít v případech zarostlé nehty,[35] snížit podráždění a potlačit jakoukoli přítomnou infekci.
Mořidlo
Moridlo je látka používaná k tuhnutí barviva na tkaninách nebo tkáňových řezech vytvořením a koordinační komplex s barvivem, které se následně připojí k látce nebo tkáni.[37] Moridlo často obsahuje a polyvalentní kovový iont, obvykle hliník nebo železo,[38] jako je tomu u směsí triacetátu hlinitého se sulfacetátem hlinitým[13] nebo s bazickým diacetátem hlinitým.[12] Triacetát hlinitý se používá s bavlna, jiný celulóza - vlákna na bázi,[14] a hedvábí.[13] Byly také kombinovány s octan železnatý k výrobě různých barev.[15]
V případě barviva alizarin (1,2-dihydroxyantrachinon, H
2Az) se předpokládalo, že morbidace zahrnuje vytvoření dianionu alizarinu. To by vytvořilo pětisouřadový hliníkový komplex, CaAl (OH) Az
2,[39] který může přijímat vodu a tvořit hydrát se šesti souřadnicemi dianionu se středem hliníku, Ca [Al (H
2O) (OH) Az
2] • 2H
2Ó.[40] Návrh byl založen na infračervené spektroskopické data a následně byla zpochybněna prací navrhující strukturu se dvěma můstkovými hydroxylovými ligandy spojujícími dinukleární jádro, Az
2Al (μ-OH)
2AlAz4−
2, se dvěma alizarinem skupiny každý chelátování ke každému hliníkovému středu.[36] Strukturu navrhl Soubayrol et al. na základě 27Al NMR spektroskopie a ionizace elektrosprejem hmotnostní spektrometrie důkaz.[41] Uváděli, že stupeň hydratace závisí na identitě protiontu, přičemž sodná sůl je stabilní tetrahydrát a monohydrát se tvoří z hydroxid draselný. Byly rozlišitelné na základě jejich chemické směny, což naznačuje, že vody jsou spojeny s hliníkovými centry nebo alizarinovými skupinami a nechovají se tak, jak je typické pro vody krystalizace.[41]
Související struktura s ionty vápníku byla popsána v roce 1994 a v ní alizariny chelatují s ionty vápníku za vzniku můstků AzCaAz mezi hliníkovými centry (které jsou také přemostěny hydroxoskupinami) a hliníková centra se následně vážou na deprotonované fenol zbytky barviva;[11] v modelu Soubayrol je každý alizarin spojen s jediným hliníkovým kationtem.[41] Stejně jako u samotné struktury octanu hlinitého nebyly vyřešeny formy, které má v aplikacích.
Poznámky
A Toto „AC“ neodkazuje na prvek aktinium. Používá se tímto způsobem, konvence v organická chemie je pro Ac odkazovat se na acetyl skupina, radikální forma je CH
3CO,[42] a OAc nebo AcO by byly použity pro acetát radikální, CH
3CO
2,[43] někdy také nazývaný „acetoxy“. Acetátovým iontem by pak byl AcO−, CH
3CO−
2a kyselinou octovou by byl AcOH nebo HOAc. Podle této konvence by triacetát hlinitý byl Al (OAc)3. Publikace v geochemie však používají Ac k označení spíše acetátu než acetylu, a tedy AlAc+
2 v geochemii by se psalo podle obvyklejších chemických konvencí jako [Al (OAc)
2]+
nebo [Al (CH
3CO
2)
2]+
.
Reference
- ^ A b C d E F Perry, Dale L .; Phillips, Sidney L., eds. (1995). Příručka anorganických sloučenin. CRC Press. p. 3. ISBN 9780849386718.
- ^ A b Mezinárodní unie pro čistou a aplikovanou chemii (2005). Názvosloví anorganické chemie Doporučení IUPAC 2005 (PDF). Publikování RSC. ISBN 0854044388.
- ^ A b C Sato, Taichi; Ikoma, Shuji; Ozawa, Fusaji (1984). „Tepelný rozklad organických bazických solí hliníku - mravenčan a octan“. Thermochim. Acta. 75 (1–2): 129–137. doi:10.1016/0040-6031(84)85013-3.
- ^ A b C d E Daintith, John, ed. (2008). "Ethhanoát hlinitý (octan hlinitý)". Slovník chemie (6. vydání). Oxford University Press. ISBN 9780191726569.
- ^ A b C „Acetát hlinitý (kód C47387)“. Národní onkologický institut tezaurus (NCIt). 31. října 2016. Archivovány od originál 16. prosince 2016. Citováno 15. listopadu 2016.
- ^ A b „Roztok kyselina octová / octan hlinitý“. Drugs.com. 3. listopadu 2016. Citováno 23. listopadu 2016.
- ^ A b Thorp, M. A .; Kruger, J .; Oliver, S .; Nilssen, E. L. K .; Prescott, C. A. J. (1998). "Antibakteriální aktivita kyseliny octové a Burowova roztoku jako topických otologických přípravků". J. Laryng. Otol. 112 (10): 925–928. doi:10.1017 / S0022215100142100. PMID 10211213.
- ^ A b Kashiwamura, Masaaki; Chida, Eiji; Matsumura, Michiya; Nakamaru, Yuuji; Suda, Noriyuki; Terayama, Yoshihiko; Fukuda, Satoshi (2004). „Účinnost Burowova roztoku jako přípravku pro ucho k léčbě chronických infekcí ucha“. Otol. Neurotol. 25 (1): 9–13. doi:10.1097/00129492-200401000-00002. PMID 14724484. S2CID 7562816.
- ^ A b USA poskytly 5250569 „Godfrey, John C.,„ Aminokyselinové příchutě hliníku adstringentního pro orální použití “, zveřejněné 5. 10. 1993, vydané 10. 10. 1993, přidělené společnosti Godfrey Science & Design, Inc.
- ^ A b USA poskytly 8703104, Morelli, Joseph P .; Fernandes, Jeffrey R. & Verkaar, Edward L. C. a kol., „Použití kovových adstringentů k léčbě bradavic s chlupy na patě“, publikováno 22. 4. 2014, přidělené Ecolab USA Inc.
- ^ A b C Wunderlich, Christian-Heinrich; Bergerhoff, Günter (1994). „Ústava a společnost von Alizarin- a Purpurin-Farblacken“. Chem. Ber. (v němčině). 127 (7): 1185–1190. doi:10.1002 / cber.19941270703.
- ^ A b Haar, Sherry; Schrader, Erica; Gatewood, Barbara M. (2013). „Srovnání hliníkových mořidel s barevnou stálostí přírodních barviv na bavlně“ (PDF). Tkanina. & Textiles Res. J. 31 (2): 97–108. doi:10.1177 / 0887302X13480846. hdl:2097/16316. S2CID 56218102.
- ^ A b C d E Georgievics, Von (2013). Chemická technologie textilních vláken - jejich původ, struktura, příprava, praní, bělení, barvení, tisk a úprava. Číst knihy. ISBN 9781447486121.
- ^ A b Brown, Donna; de Souza, Diane; Ellis, Catharine (2010). „Jak mořit bavlnu - dovolte mi spočítat způsoby“. Turkey Red Journal. 15 (2).
- ^ A b Ellis, Catharine (2016). „Transformační procesy“. Weaver's Studio Woven Shibori. F + W Media, Inc. 83–84. ISBN 9781632503541.
- ^ Wesolowski, D. J .; Blencoe, J. G .; Cole, D. R .; Bell, J. L. S .; Palmer, D. A. (1992). "Geochemie krustových procesů na vysoké teploty a tlaky". Souhrny výzkumu geověd FY 92 (PDF). Ministerstvo energetiky Spojených států. s. 38–44.
- ^ Myerson, Allan S .; Ginde, Rajiv (2002). „Krystaly, růst krystalů a nukleace“. V Myerson, Allan S. (ed.). Příručka průmyslové krystalizace (2. vyd.). Butterworth-Heinemann. p. 37. ISBN 9780080533513.
- ^ Alcock, Nathaniel W .; Tracy, Valerie M .; Waddington, Thomas C. (1976). "Acetáty a acetato-komplexy. Část 2. Spektroskopické studie". J. Chem. Soc., Dalton Trans. 1976 (21): 2243–2246. doi:10.1039 / DT9760002243.
- ^ Daintith, John, ed. (2008). „Chlorid hlinitý“. Slovník chemie (6. vydání). Oxford University Press. ISBN 9780191726569.
- ^ Kubicki, J. D .; Sykes, D .; Apitz, S.E. (1999). "Ab Initio Výpočet vodného hliníku a komplexu hliníku a karboxylátu Energetika a 27Al NMR chemické posuny ". J. Phys. Chem. A. 103 (7): 903–915. Bibcode:1999JPCA..103..903K. doi:10.1021 / jp983462w.
- ^ Thomas, Fabien; Masion, Armand; Bottero, Jean Yves; Rouiller, James; Genevrier, Francine; Boudot, Denis (1991). "Speciace hliníku (III) s octanem a oxalátem. Potenciometrický a 27Al NMR studie ". Environ. Sci. Technol. 25 (9): 1553–1559. doi:10.1021 / es00021a004.
- ^ Bi, Shuping; Wang, Chenyi; Cao, Qing; Zhang, Caihua (2004). „Studie mechanismu hydrolýzy a polymerace solí hliníku ve vodném roztoku: korelace mezi modelem„ Core-links “a„ Cage-like “Keggin-Al13 Modelka". Coord. Chem. Rev. 248 (5–6): 441–455. doi:10.1016 / j.ccr.2003.11.001.
- ^ Weinland, R .; Dinkelacker, P. (1909). „Über Salze einer Hexaacetato (formiato) -trichrombase. II“. Ber. Dtsch. Chem. Ges. (v němčině). 42 (3): 2997–3018. doi:10,1002 / cber.19090420318.
- ^ Figgis, B. N .; Robertson, G. B. (1965). "Krystalová-molekulární struktura a magnetické vlastnosti Cr3(CH3.VRKAT)6OCl.5H2Ó". Příroda. 205 (4972): 694–695. Bibcode:1965Natur.205..694F. doi:10.1038 / 205694a0. S2CID 4283321.
- ^ Burgess, J .; Twigg, M. V. (2005). King, R. Bruce (ed.). Encyclopedia of Anorganic Chemistry (10. vydání). Wiley. ISBN 9780470860786.
- ^ „Hydroxid octanu chromitého“. chemicalbook.com. Chemická kniha. 2016. Citováno 18. listopadu 2016.
- ^ Catterick, Janet; Thornton, Peter (1977). "Struktury a fyzikální vlastnosti polynukleárních karboxylátů". v Emeléus, H. J.; Sharpe, A. G. (eds.). Pokroky v anorganické chemii a radiochemii. 20. Akademický tisk. str. 291–362. ISBN 9780080578699.
- ^ A b Van Niekerk, J. N .; Schoening, F. R. L. (1953). „Rentgenové důkazy pro vazby kov na kov v měďnatém a chromovém octanu“. Příroda. 171 (4340): 36–37. Bibcode:1953Natur.171 ... 36V. doi:10.1038 / 171036a0. S2CID 4292992.
- ^ A b Cotton, F. A.; Deboer, B.G .; Laprade, M. D .; Pipal, J. R .; Ucko, D. A. (1971). „Krystaly a molekulární struktury dihydrátu dichromium-tetraacetátu a dihydrátu dirhodium-tetraacetátu“ (PDF). Acta Crystallogr. B. 27 (8): 1664. doi:10.1107 / S0567740871004527.
- ^ A b Wade, K .; Banister, A. J. (1973). „Chemie hliníku, gália, india a thalia“. In Bailar, J. C .; Emeléus, H. J .; Nyholm, R. (eds.). Komplexní anorganická chemie. Elsevier. p. 1047. ISBN 9781483153223.
- ^ USA poskytly 6498262 Jerome, James E .; Fleming, Glenda L. & Swinson, Joel H., „Proces výroby monobázického diacetátu hlinitého“, publikovaný 24. 12. 2002, přidělený společnosti Chattem Chemicals, Inc.
- ^ Úřad pro kontrolu potravin a léčiv (1. dubna 2016). „Část 347 - Léčivé přípravky na ochranu kůže pro humánní použití na přepážce“. CFR - Kodex federálních předpisů, hlava 21. Ministerstvo zdravotnictví a sociálních služeb USA. Citováno 15. listopadu 2016.
- ^ Munguia, Raymundo; Daniel, Sam J. (2008). „Ototopická antimykotika a otomykóza: recenze“. Int. J. Ped. Otorinolaryng. 72 (4): 453–459. doi:10.1016 / j.ijporl.2007.12.005. PMID 18279975.
- ^ "Domeboro - síran hlinitý tetradekhydrát, prášek monohydrátu octanu vápenatého, pro roztok". DailyMed. Americká národní lékařská knihovna. 12. května 2016. Citováno 23. listopadu 2016.
- ^ Simon, Harvey (31. ledna 2013). „Zarostlé nehty na nohou“. The New York Times. Citováno 23. listopadu 2016.
- ^ A b Atta-ur-Rahman (2002). „Rubia tinctorum L“. Bioaktivní přírodní produkty (část G). Studie v chemii přírodních produktů. 26. Elsevier. 629–684. ISBN 9780080542065.
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “mořidlo ". doi:10.1351 / zlatá kniha.M04029
- ^ Llewellyn, Bryan D. (květen 2005). „Teorie skvrn - Jak fungují mořidla“. Archivovány od originál dne 14. srpna 2007.
- ^ Kiel, E. G .; Heertjes, P. M. (1965). "Kovové komplexy Alizarin V - vyšetřování bavlněných tkanin barvených alizarinem". Technologie barvení. 81 (3): 98–102. doi:10.1111 / j.1478-4408.1965.tb02647.x.
- ^ Kiel, E. G .; Heertjes, P. M. (1963). „Metal Complexes of Alizarin I - The Structure of the Calcium-Aluminium Lake of Alizarin“. Technologie barvení. 79: 21–27. doi:10.1111 / j.1478-4408.1963.tb02507.x.
- ^ A b C Soubayrol, Patrick; Dana, Gilbert; Člověk, Pascal P. (1996). „Aluminium-27 Solid-State NMR Study of Aluminium Coordination Complex of Alizarin“. Magnetická rezonance v chemii. 34 (8): 638–645. doi:10.1002 / (SICI) 1097-458X (199608) 34: 8 <638 :: AID-OMR926> 3.0.CO; 2-5.
- ^ Hanson, James Ralph (2001). Chemie funkčních skupin. Royal Society of Chemistry. p. 11. ISBN 0854046275.
- ^ „Společné zkratky v organické chemii“ (PDF). Imperial College. Citováno 18. listopadu 2016.
Acetylhalogenidy a jejich soli acetát ion | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | On | ||||||||||||||||||
| LiOAc | Být (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | Ahoj | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 ALSOL Al (OAc)2ACH Al2TAK4(OAc)4 | Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Jako (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Pozn | Mo (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | Cd (OAc)2 | v | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Ta | Ž | Re | Os | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Bi (OAc)3 | Po | Na | Rn | |||
| Fr. | Ra | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La (OAc)3 | Ce (OAc)X | Pr | Nd | Odpoledne | Sm (OAc)3 | EU (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Ho (OAc)3 | Er | Tm | Yb (OAc)3 | Lu (OAc)3 | |||||
| Ac | Čt | Pa | UO2(OAc)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||


