Diisobutylaluminium hydrid - Diisobutylaluminium hydride
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Diisobutylaluminium hydrid | |
| Ostatní jména DIBAH; DIBAL; DiBAlH; DIBAL-H; DIBALH | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.013.391 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C8H19Al (monomer) C16H38Al2 (dimer) | |
| Molární hmotnost | 142,22 g / mol (monomer) 284,44 g / mol (dimer) |
| Vzhled | Bezbarvá kapalina |
| Hustota | 0,798 g / cm3 |
| Bod tání | −80 ° C (−112 ° F; 193 K) |
| Bod varu | 116 až 118 ° C (241 až 244 ° F; 389 až 391 K) při 1 mmHg |
| Prudce reaguje s vodou | |
| Rozpustnost v uhlovodíkových rozpouštědlech | Rozpustný |
| Nebezpečí | |
| Hlavní nebezpečí | vznítí ve vzduchu |
| Piktogramy GHS |   |
| Signální slovo GHS | Nebezpečí |
| H220, H225, H250, H260, H314, H318 | |
| P210, P222, P223, P231 + 232, P233, P240, P241, P242, P243, P260, P264, P280, P301 + 330 + 331, P302 + 334, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P321, P335 + 334, P363, P370 + 378, P377, P381, P402 + 404 | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
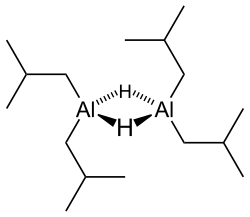
Diisobutylaluminium hydrid (DIBALH, DIBAL, DIBAL-H nebo DIBAH, /ˈdaɪb…l/ DY-bal ) je redukční činidlo s vzorec (i-Bu2AlH)2, kde i-Bu představuje isobutyl (-CH2CH (CH3)2). Tento organohlinitá sloučenina byl vyšetřován původně jako kokatalyzátor pro polymerizace z alkeny.[1]
Vlastnosti
Stejně jako většina organoaluminiových sloučenin je struktura sloučeniny pravděpodobně více, než naznačuje její struktura empirický vzorec. Různé techniky, kromě Rentgenová krystalografie, naznačují, že sloučenina existuje jako a dimer a trimer, sestávající z čtyřboká hliníkových center sdílejících přemostění hydrid ligandy.[2] Hydridy jsou malé a u derivátů hliníku vysoké základní, tedy překlenují přednostně před alkyl skupiny.
DIBAL lze připravit zahřátím triisobutylaluminium (sám o sobě dimer) k vyvolání eliminace beta-hydridu:[3]
- (i-Bu3Al)2 → (i-Bu2AlH)2 + 2 (CH3)2C = CH2
Ačkoli lze DIBAL komerčně zakoupit jako bezbarvou kapalinu, běžněji se nakupuje a vydává jako roztok v organickém rozpouštědle, jako je toluen nebo hexan.
Použití v organické syntéze
DIBAL je užitečný v organická syntéza pro různé redukce, včetně převodu karboxylové kyseliny, jejich deriváty a nitrily na aldehydy. DIBAL účinně redukuje a-β nenasycené estery na odpovídající allylalkohol.[4] Naproti tomu LiAlH4 snižuje estery a acylchloridy na primární alkoholy, a nitrily na primární aminy [pomocí postupu zpracování Fieser]. DIBAL reaguje pomalu se sloučeninami chudými na elektrony a rychleji se sloučeninami bohatými na elektrony. Jedná se tedy o elektrofilní redukční činidlo, zatímco LiAlH4 lze považovat za nukleofilní redukční činidlo.
Ačkoli DIBAL spolehlivě redukuje nitrily na aldehydy, je redukce esterů na stejnou funkční skupinu neslavně jemnou reakcí, která vypadá na papíře jako užitečná, ale v praxi často vede ke směsím alkoholu a aldehydu. Tento problém byl vyřešen pečlivým řízením reakčních podmínek pomocí chemie kontinuálního toku.[5]
Bezpečnost
DIBAL, stejně jako většina alkylaluminiových sloučenin, reaguje prudce se vzduchem a vodou, což může vést k požárům.
Reference
- ^ Ziegler, K.; Martin, H .; Krupp, F. (1960). „Metallorganische Verbindungen, XXVII Aluminiumtrialkyle und Dialkyl-Aluminiumhydride aus Aluminiumisobutyl-Verbindungen“. Justus Liebigs Annalen der Chemie. 629 (1): 14–19. doi:10,1002 / jlac.19606290103.
- ^ Self, M. F .; Pennington, W. T .; Robinson, G. H. (1990). „Reakce diisobutylaluminiumhydridu s makrocyklickým tetradentátovým sekundárním aminem. Syntéza a molekulární struktura [Al (iso-Bu)]2[C10H20N4] [Al (iso-Bu)3]2: Důkaz neobvyklého nepoměru (iso-Bu)2AlH ". Anorganica Chimica Acta. 175 (2): 151–153. doi:10.1016 / S0020-1693 (00) 84819-7.
- ^ Eisch, J. J. (1981). Organokovové syntézy. 2. New York: Academic Press. ISBN 0-12-234950-4.
- ^ Galatsis, P. (2001). "Diisobutylaluminium hydrid". Encyklopedie činidel pro organickou syntézu. New York: John Wiley & Sons. doi:10.1002 / 047084289X.rd245. ISBN 0471936235.
- ^ Webb, Damien; Jamison, Timothy F. (2012-01-20). „Redukce hydridů diisobutylaluminia revitalizována: rychlý, robustní a selektivní systém kontinuálního toku pro syntézu aldehydu“. Organické dopisy. 14 (2): 568–571. doi:10.1021 / ol2031872. hdl:1721.1/76286. ISSN 1523-7060. PMID 22206502.
externí odkazy
- Stockman, R. (2001). „Dibalova redukce methylesteru odvozeného od aminokyseliny; Garnerův aldehyd“. ChemSpider Syntetické stránky. doi:10.1039 / SP161. Strana 161.[trvalý mrtvý odkaz ]
- „Oxidační a redukční reakce v organické chemii“. University of Southern Maine, Department of Chemistry. Archivovány od originál dne 11.06.2011.
- „Diisobutyl Aluminium hydride (DIBAL-H) and Other Isobutyl Aluminium Alkyls (DIBAL-BOT, TIBAL) as Speciality Organic Synthesis Reagents“ (PDF). Akzo-Nobel. Archivovány od originál (PDF) dne 8. 4. 2011. Citováno 2011-02-23.
