Hydroxid měďnatý - Copper(II) hydroxide
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Hydroxid měďnatý | |
| Ostatní jména Hydroxid měďnatý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.039.817 |
| KEGG | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Cu (OH)2 | |
| Molární hmotnost | 97,561 g / mol |
| Vzhled | Modrá nebo modrozelená pevná látka |
| Hustota | 3,368 g / cm3, pevný |
| Bod tání | 80 ° C (176 ° F; 353 K) (rozkládá se na CuO ) |
| zanedbatelný | |
Produkt rozpustnosti (K.sp) | 2,20 x 10−20[1] |
| Rozpustnost | nerozpustný v ethanol; rozpustný v NH4ACH |
| +1170.0·10−6 cm3/ mol | |
| Termochemie | |
Std molární entropie (S | 108 J · mol−1· K.−1 |
Std entalpie of formace (ΔFH⦵298) | −450 kJ · mol−1 |
| Nebezpečí | |
| Hlavní nebezpečí | Dráždivý pro kůži, oči a dýchací orgány |
| Bezpečnostní list | http://www.sciencelab.com/xMSDS-Cupric_Hydroxide-9923594 |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | Nehořlavé |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 1000 mg / kg (orálně, potkan) |
| NIOSH (Limity expozice USA pro zdraví): | |
PEL (Dovolený) | TWA 1 mg / m3 (jako Cu)[2] |
REL (Doporučeno) | TWA 1 mg / m3 (jako Cu)[2] |
IDLH (Okamžité nebezpečí) | TWA 100 mg / m3 (jako Cu)[2] |
| Související sloučeniny | |
jiný anionty | Oxid měďnatý Uhličitan měďnatý Síran měďnatý Chlorid měďnatý |
jiný kationty | Hydroxid nikelnatý Hydroxid zinečnatý Hydroxid železitý Hydroxid kobaltu |
Související sloučeniny | Oxid měďnatý Chlorid měďnatý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Hydroxid měďnatý je hydroxid z měď s chemický vzorec Cu (OH)2. Je to světle zeleno-modrá nebo modrozelená pevná látka. Některé formy hydroxidu měďnatého se prodávají jako „stabilizovaný“ hydroxid měďnatý, i když pravděpodobně sestávají ze směsi uhličitan měďnatý a hydroxid. Hydroxid měďnatý je slabá báze.
Výskyt
Hydroxid měďnatý je známý od té doby tavení mědi začala kolem roku 5000 př. n.l. alchymisté byli pravděpodobně první, kdo jej vyrobili smícháním roztoků louh (hydroxid sodný nebo draselný) a modrý vitriol (síran měďnatý).[3] Zdroje obou sloučenin byly dostupné ve starověku.
Byl vyroben v průmyslovém měřítku během 17. a 18. století pro použití v pigmenty jako modrý verditer a Brémy zelené.[4] Tyto pigmenty byly použity v keramika a malování.[5]
Laboratorní syntéza
Hydroxid měďnatý lze připravit přidáním a hydroxid sodný na zředěný roztok síran měďnatý (CuSO4· 5H2Ó).[6] Takto vyrobená sraženina však často obsahuje vodu a znatelné množství nečistot hydroxidu sodného. Čistšího produktu lze dosáhnout, pokud chlorid amonný se do roztoku přidá předem.[7] Alternativně se hydroxid mědi snadno vyrábí elektrolýza vody (obsahuje trochu elektrolyt jako síran sodný nebo Síran hořečnatý ) s mědí anoda.
Minerální
Minerál vzorce Cu (OH)2 je nazýván spertiniit. Hydroxid měďnatý je zřídka nalezen jako nekombinovaný minerální protože pomalu reaguje s oxid uhličitý z atmosféry tvořit a základní uhličitan měďnatý. Měď tedy reakcí pomalu získává matný zelený povlak ve vlhkém vzduchu:
- 2 Cu (OH)2 + CO2 → Cu2CO3(ACH)2 + H2Ó
Zelený materiál je v zásadě 1: 1 molární směs Cu (OH)2 a CuCO3.[8] Tento patina formuláře na bronz a další měď slitina sochy jako Socha svobody.
Struktura
Struktura Cu (OH)2 bylo určeno Rentgenová krystalografie Měděný střed je čtvercový pyramidový. Čtyři vzdálenosti Cu-O v rozsahu rovin jsou 1,96 Å a osová vzdálenost Cu-O je 2,36 Å. Hydroxidové ligandy v rovině jsou buď dvojnásobné přemostění nebo trojnásobné přemostění.[9]
Reakce
Je stabilní do asi 100 ° C.[6]
Hydroxid měďnatý reaguje s roztokem amoniak vytvořit tmavě modré řešení tetrammin měď [Cu (NH3)4]2+ komplexní ion. Katalyzuje oxidaci roztoků amoniaku v přítomnosti dioxygenu, což vede k tvorbě dusičnanů aminů mědi, jako je Cu (NO2)2(NH3)n.[10][11]
Hydroxid měďnatý je mírně amfoterní. Mírně se rozpouští v koncentrované formě alkálie, tvořící [Cu (OH)4]2−.[12][6]
Činidlo pro organickou chemii
Hydroxid měďnatý má v organická syntéza. Často, když se používá pro tento účel, je připraven in situ smícháním rozpustné soli mědi a II hydroxid draselný.
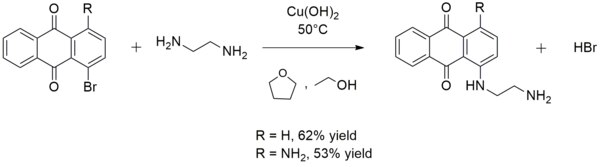
Někdy se používá při syntéze aryl aminy. Například hydroxid měďnatý katalyzuje reakci ethylendiamin s 1-bromanthrachinonem nebo 1-amino-4-bromanthrachinonem za vzniku 1 - ((2-aminoethyl) amino) antrachinonu nebo 1-amino-4 - ((2-aminoethyl) amino) antrachinonu:[13]
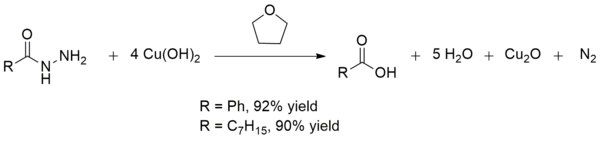
Hydroxid měďnatý také převádí kyselinu hydrazidy na karboxylové kyseliny pokojová teplota. Tato přeměna je užitečná při syntéze karboxylových kyselin v přítomnosti jiných křehkých látek funkční skupiny. Výnosy jsou obecně vynikající, jako je tomu v případě výroby kyselina benzoová a kyselina oktanová:[13]
Použití
Hydroxid měďnatý v roztoku amoniaku, známý jako Schweizerovo činidlo, má zajímavou schopnost rozpouštění celulóza. Tato vlastnost vedla k tomu, že byla použita při výrobě hedvábí, a celulózové vlákno.
To je také široce používán v akvarijním průmyslu pro jeho schopnost ničit vnější parazity v rybách, včetně motolic, mořských ich, potoků a mořských sametů, aniž by ryby zabíjel. Přestože jiné vodorozpustné sloučeniny mědi mohou být v této roli účinné, obvykle vedou k vysoké úmrtnosti ryb.
Hydroxid měďnatý byl použit jako alternativa k Bordeauxská směs, a fungicid a nematicid.[14] Mezi takové produkty patří Kocide 3000, vyráběný společností Kocide L.L.C. Příležitostně se také používá hydroxid měďnatý keramické barvivo.
Hydroxid měďnatý byl kombinován s latexovou barvou, čímž byl získán produkt určený k řízení růstu kořenů v květináčích. Sekundárním a postranním kořenům se daří a rozšiřují, což vede k hustému a zdravému kořenovému systému. To bylo prodáváno pod názvem Spin Out, který byl poprvé představen Griffin L.L.C. Práva nyní vlastní společnost SePRO Corp.[15] Nyní se prodává jako Microkote buď v řešení, které sami aplikujete, nebo jako ošetřené hrnce.
Ostatní hydroxidy měďnaté
Spolu s dalšími složkami je hydroxidů měďnatých mnoho. Několik obsahujících měď minerály obsahují hydroxid. Pozoruhodné příklady zahrnují azurit, malachit, antlerit, a brochantit. Azurit (2 CuCO3· Cu (OH)2) a malachit (CuCO3· Cu (OH)2) jsou hydroxy-uhličitany, zatímco antlerit (CuSO4· 2Cu (OH)2) a brochantit (CuSO4· 3Cu (OH)2) jsou hydroxy-sulfáty.
Bylo zkoumáno mnoho syntetických derivátů hydroxidu měďnatého.[17]
Reference
- ^ Pradyot Patnaik. Handbook of Anorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ A b C NIOSH Kapesní průvodce chemickými nebezpečími. "#0150". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Richard Cowen, Eseje o geologii, historii a lidech, Kapitola 3: „Oheň a kovy: měď“.
- ^ Tony Johansen, Pigmenty historického umělce Archivováno 2009-06-09 na Wayback Machine. PaintMaking.com. 2006.
- ^ Modrý verditer Archivováno 2007-09-27 na Wayback Machine. Přírodní pigmenty. 2007.
- ^ A b C O. Glemser a H. Sauer „Hydroxid měďnatý“ v Handbook of Preparative Anorganic Chemistry, 2. vyd. Edited by G. Brauer, Academic Press, 1963, NY. Sv. 1. str. 1013.
- ^ Y. Cudennec, A. Lecerf (2003). „Transformace Cu (OH) 2 na CuO, znovu navštívena“ (PDF). Solid State Sciences. 5 (11–12): 1471–1474. doi:10.1016 / j.solidstatesciences.2003.09.009.
- ^ Masterson, W. L. a Hurley, C. N. (2004). Chemistry: Principles and Reactions, 5th Ed. Thomson Learning, Inc. (str. 331) "
- ^ H. R. Oswald, A. Reller, H. W. Schmalle, E. Dubler (1990). "Struktura hydroxidu měďnatého, Cu (OH)2". Acta Crystallogr. C46 (12): 2279–2284. doi:10.1107 / S0108270190006230.CS1 maint: používá parametr autoři (odkaz)
- ^ Y. Cudennec; et al. (1995). „Etude cinétique de l'oxydation de l'ammoniac en présence d'ions cuivriques“. Comptes Rendus de l'Académie des Sciences, Série IIB. 320 (6): 309–316.
- ^ Y. Cudennec; et al. (1993). "Syntéza a studium Cu (NO2) 2 (NH3) 4 a Cu (N02) 2 (NH3) 2 ". European Journal of Solid State and Anorganic Chemistry. 30 (1–2): 77–85.
- ^ Pauling, Linus (1970). Obecná chemie. Dover Publications, Inc. (str. 702).
- ^ A b Tsuda, T. (2001). „Hydroxid měďnatý“. Encyklopedie činidel pro organickou syntézu. doi:10.1002 / 047084289X.rc228. ISBN 0471936235.
- ^ Bordeauxská směs. VIDÍŠ IPM online. 2007.
- ^ "SePRO Corporation".
- ^ Zigan, F .; Schuster, H.D. (1972). „Verfeinerung der Struktur von Azurit, Cu3(ACH)2(CO.)3)2, durch Neutronenbeugung ". Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie. 135 (5–6): 416–436. doi:10.1524 / zkri.1972.135.5-6,416.
- ^ Kondinski, A .; Monakhov, K. (2017). „Breaking the Gordian Knot in the Structural Chemistry of Polyoxometalates: Copper (II) –Oxo / Hydroxo Clusters“. Chemistry: A European Journal. 23 (33): 7841–7852. doi:10.1002 / chem.201605876. PMID 28083988.