Diethylaluminiumchlorid - Diethylaluminium chloride - Wikipedia
 | |
| Jména | |
|---|---|
| Název IUPAC Chlorodiethylaluman | |
| Ostatní jména Chlorodiethylaluminium | |
| Identifikátory | |
3D model (JSmol ) | |
| 4123259 | |
| ChemSpider | |
| Informační karta ECHA | 100.002.253 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 3394 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C4H10AlCl | |
| Molární hmotnost | 120.56 g · mol−1 |
| Hustota | 0,961 g cm−3 |
| Bod tání | -50 ° C (-58 ° F; 223 K) |
| Bod varu | 125 až 126 ° C (257 až 259 ° F; 398 až 399 K) při 50 mmHg |
| Tlak páry | 3 mmHg (při 60 ° C) |
| Nebezpečí | |
Klasifikace EU (DSD) (zastaralý) | |
| R-věty (zastaralý) | R14 / 15, R17, R34 |
| S-věty (zastaralý) | S26, S36 / 37/39, S43, S45 |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | -18 ° C (0 ° F; 255 K) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
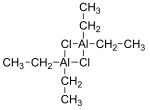
Diethylaluminiumchlorid, zkráceně DEAC, je organohlinitá sloučenina. I když obvykle daný chemický vzorec (C2H5)2AlCl, existuje jako dimer, [(C.2H5)2AlCl]2 Je to předchůdce Katalyzátory Ziegler-Natta zaměstnán na výrobu polyolefiny. Sloučenina je také a Lewisova kyselina, užitečné v organická syntéza. Sloučenina je bezbarvá voskovitá pevná látka, ale obvykle se s ní zachází jako s roztokem v uhlovodíkových rozpouštědlech. Je vysoce reaktivní, dokonce pyroforický.[1]
Struktura
Sloučeniny empirického vzorce AlR2Cl (R = alkyl, aryl ) existují jako dimery se vzorcem (R.2Al)2(μ-Cl)2. Hliník přijímá čtyřbokou geometrii.[2][3]
Výroba
Diethylaluminiumchlorid lze vyrobit z ethylaluminium sesquichlorid, (C.2H5)3Al2Cl3redukcí sodíkem:[4]
- 2 (C.2H5)3Al2Cl3 + 3 Na → 3 (C.2H5)2AlCl + Al + 3 NaCl
Rovněž se získává z reakce triethylaluminium s kyselinou chlorovodíkovou:
- (C2H5)3Al + HCl → (C.2H5)2AlCl + C2H6
Lze také použít reproporcionální reakce:
- 2 (C.2H5)3Al + AlCl3 → 3 (C.2H5)2AlCl
- (C2H5)3Al2Cl3 + (C.2H5)3Al → 3 (C.2H5)2AlCl
Použití
Diethylaluminiumchlorid a další organoaluminiové sloučeniny se používají v kombinaci se sloučeninami přechodných kovů jako Ziegler – Natta katalyzátory pro polymeraci různých alkenů.[5]
Jako Lewisova kyselina má diethylaluminiumchlorid také použití v organické syntéze. Například se používá ke katalýze Diels – Olše a ene reakce. Alternativně může reagovat jako nukleofil nebo lapač protonů.[1]
Bezpečnost
Diethylaluminiumchlorid je nejen hořlavý, ale také samozápalný.
Reference
- Hu, Y. J .; Jiang, H.L .; Wang, H. H., „Příprava vysoce rozvětveného polyethylenu s katalyzátorem chlorid nikelnatý acenaftenimin / diethylaluminiumchlorid jako katalyzátor“. Chinese Journal of Polymer Science 2006, 24 (5), 483–488.
- Yao, Y. M .; Qi, G. Z .; Shen, Q .; Hu, J. Y .; Lin, Y. H., „Reaktivita a strukturní charakterizace dvojmocného aryloxidu samaria s diethylaluminiumchloridem“. Bulletin čínské vědy 2003, 48 (20), 2164–2167.
- ^ A b Snider, Barry B .; Ramazanov, Ilfir R .; Dzhemilev, Usein M. (2009). "Ethylaluminium Dichloride". Encyklopedie činidel pro organickou syntézu. doi:10.1002 / 047084289X.re044.pub2. ISBN 978-0471936237.
- ^ Brendhaugen, Kristen; Haaland, Arne; Novak, David P .; Østvold, Terje; Bjørseth, Alf; Powell, D. L. (1974). „Molekulární struktura dimethylaluminiumchloridového dimeru, [(CH3) 2Al Cl] 8, nově určeno difrakcí elektronů v plynné fázi ". Acta Chemica Scandinavica. 28a: 45–47. doi:10,3891 / acta.chem.scand.28a-0045.
- ^ McMahon, C. Niamh; Francis, Julie A .; Barron, Andrew R. (1997). „Molekulární struktura [(t Bu) 2Al (μ-Cl)] 2 ". Journal of Chemical Crystallography. 27 (3): 191–194. doi:10.1007 / BF02575988. S2CID 195242291.
- ^ Krause, Michael J .; Orlandi, Frank; Saurage, Alfred T .; Zietz, Joseph R. (2000), „Aluminium Compounds, Organic“, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Německo: Wiley-VCH Verlag GmbH & Co. KGaA, str. 592–593, doi:10.1002 / 14356007.a01_543, ISBN 978-3-527-30673-2
- ^ Fisch, A. G. (2000). „Ziegler – Natta Catalysts“. Kirk-Othmer Encyclopedia of Chemical Technology. Wiley. s. 1–22. doi:10.1002 / 0471238961.2609050703050303.a01.pub2. ISBN 978-0-471-48494-3.
externí odkazy
 Média související s Diethylaluminiumchlorid na Wikimedia Commons
Média související s Diethylaluminiumchlorid na Wikimedia Commons

