Octan vápenatý - Calcium acetate - Wikipedia
 | |
 Krystaly octanu vápenatého | |
| Jména | |
|---|---|
| Název IUPAC Octan vápenatý | |
| Ostatní jména Acetát vápna Ethanoát vápenatý Diacetát vápenatý | |
| Identifikátory | |
3D model (JSmol ) | |
| Zkratky | Ca (OAc)2 |
| 3692527 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.000.492 |
| Číslo ES |
|
| Číslo E. | E263 (konzervační látky) |
| 22320 | |
| KEGG | |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C4H6Ca.Ó4 | |
| Molární hmotnost | 158.166 g · mol−1 |
| Vzhled | Bílá pevná látka hygroskopický |
| Zápach | mírný octová kyselina zápach |
| Hustota | 1,509 g / cm3 |
| Bod tání | 160 ° C (320 ° F; 433 K)[1] rozklad na CaCO3 + aceton |
| 37,4 g / 100 ml (0 ° C) 34,7 g / 100 ml (20 ° C) 29,7 g / 100 ml (100 ° C) | |
| Rozpustnost | málo rozpustný v methanolu, hydrazin nerozpustný v aceton, ethanol a benzen |
| Kyselost (strK.A) | ca. 0,7 |
| -70.7·10−6 cm3/ mol | |
Index lomu (nD) | 1.55 |
| Farmakologie | |
| V03AE07 (SZO) | |
| Nebezpečí | |
| NFPA 704 (ohnivý diamant) | |
| 680 až 730 ° C (1256 až 1346 ° F; 953 až 1003 K) | |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 4280 mg / kg (orálně, potkan) |
| Související sloučeniny | |
jiný kationty | Octan hořečnatý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
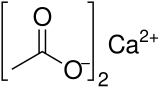
Octan vápenatý je chemická sloučenina což je vápník sůl z octová kyselina. Má vzorec Ca (C2H3Ó2)2. Jeho standardní název je octan vápenatý ethanoát vápenatý je systematické jméno. Starší jméno je octan vápenatý. The bezvodý forma je velmi hygroskopický; proto monohydrát (Ca (CH3VRKAT)2• H2O) je běžná forma.
Výroba
Octan vápenatý lze připravit namočením uhličitan vápenatý (nachází se ve skořápkách vajec nebo v běžných karbonátových horninách, jako je vápenec nebo mramor ) nebo hydratované vápno v octě:
- CaCO3(s) + 2CH3COOH (vodný) → Ca (CH3VRKAT)2(aq) + H2O (l) + CO2(G)
- Ca (OH)2(s) + 2CH3COOH (vodný) → Ca (CH3VRKAT)2(aq) + 2H2O (l)
Jelikož by obě činidla byla k dispozici pre-historicky, byla by chemická látka tehdy pozorovatelná jako krystaly.
Použití
- v nemoc ledvin, hladiny v krvi fosfát může stoupat (tzv hyperfosfatémie ) vedoucí k problémům s kostmi. Octan vápenatý váže fosfát ve stravě na snížení hladiny fosfátů v krvi.[2]
- Octan vápenatý se používá jako a potravinářská přídatná látka, jako stabilizátor, nárazník a sekvestrant, zejména u cukrovinek pod číslem E263.
- Tofu se tradičně získává srážením sójové mléko s síran vápenatý. Bylo zjištěno, že octan vápenatý je lepší alternativou; je rozpustný, vyžaduje méně dovednosti a menší množství.[3]
- Protože je levný, byl octan vápenatý kdysi běžným výchozím materiálem pro syntézu aceton před vývojem kumenový proces:[4][5]
- Ca (CH3VRKAT)2 → CaCO3(s) + (CH3)2CO
- Nasycený roztok octanu vápenatého v alkoholu tvoří polotuhý, hořlavý gel, který je podobný produktům „konzervovaného tepla“, jako jsou Sterno.[6] Učitelé chemie často připravují „kalifornské sněhové koule“, směs roztoku octanu vápenatého a ethanol.[7] Výsledný gel má bělavou barvu a lze jej vytvořit tak, aby připomínal a sněhová koule.
Přirozený výskyt
Čistý octan vápenatý zatím mezi minerály není znám. Kalccit - pentahydrát chloridu octanu vápenatého - je uveden jako známý minerál, ale jeho geneze je pravděpodobně antropogenní a může být brzy zdiskreditována.[8][9]
Reference
- ^ Dale L. Perry (19. května 2011). Příručka anorganických sloučenin (Druhé vydání.). Taylor & Francis. p. 84. ISBN 978-1-4398-1461-1.
- ^ "Octan vápenatý". Klinika Mayo. Citováno 19. listopadu 2019.
- ^ J. Y. Lu, Eloise Carter a R. A. Chung (1980): „Použití vápenatých solí pro přípravu sójového tvarohu“ Journal of Food Science, svazek 45, číslo 1, strany 32–34 doi:10.1111 / j.1365-2621.1980.tb03864.x
- ^ Leo Frank Goodwin; Edward Tyghe Sterne (1920). „Ztráty vzniklé při přípravě acetonu destilací octanu vápenatého“. Průmyslová a inženýrská chemie. 12 (3): 240–243. doi:10.1021 / ie50123a012.
- ^ E. G. R. Ardagh; A. D. Barbour; G. E. McClellan; E. W. McBride (1924). "Destilace octanu vápenatého". Průmyslová a inženýrská chemie. 16 (11): 1133–1139. doi:10.1021 / ie50179a013.
- ^ „Konzervované teplo“ v časopise Journal of Chemical Education „Chemie ožívá!“
- ^ Zdroje pro výuku chemie
- ^ https://www.mindat.org/min-862.html
- ^ https://www.ima-mineralogy.org/Minlist.htm
| AcOH | On | ||||||||||||||||||
| LiOAc | Být (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | Ahoj | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 ALSOL Al (OAc)2ACH Al2TAK4(OAc)4 | Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Jako (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Pozn | Mo (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | Cd (OAc)2 | v | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Ta | Ž | Re | Os | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Bi (OAc)3 | Po | Na | Rn | |||
| Fr. | Ra | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La (OAc)3 | Ce (OAc)X | Pr | Nd | Odpoledne | Sm (OAc)3 | EU (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Ho (OAc)3 | Er | Tm | Yb (OAc)3 | Lu (OAc)3 | |||||
| Ac | Čt | Pa | UO2(OAc)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||

