Teriflunomid - Teriflunomide
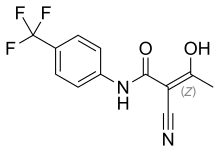 | |
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Aubagio |
| Ostatní jména | A77 1726 |
| AHFS /Drugs.com | Monografie |
| MedlinePlus | a613010 |
| Licenční údaje |
|
| Těhotenství kategorie | |
| Trasy z správa | Pusou |
| ATC kód | |
| Právní status | |
| Právní status | |
| Farmakokinetické data | |
| Vazba na bílkoviny | >99.3% |
| Odstranění poločas rozpadu | 2 týdny |
| Vylučování | Žlučovod /fekální, ledviny |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.170.077 |
| Chemické a fyzikální údaje | |
| Vzorec | C12H9F3N2Ó2 |
| Molární hmotnost | 270.211 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| | |
Teriflunomid, prodávané pod značkou Aubagio, je aktivní metabolit z leflunomid.[2] Teriflunomid byl zkoumán v EU Klinická studie fáze III TEMSO jako lék na roztroušená skleróza (SLEČNA). Studie byla dokončena v červenci 2010.[3] Dvouleté výsledky byly pozitivní.[4] Následná přímá srovnávací studie TENERE však uváděla, že „ačkoli trvalé přerušení [léčby] bylo podstatně méně časté u pacientů s RS, kteří dostávali teriflunomid ve srovnání s interferon beta-1a relapsy byly častější u teriflunomidu. “[5] Lék byl schválen pro použití ve Spojených státech v září 2012[6][7] a pro použití v Evropské unii v srpnu 2013.[8]
Mechanismy působení
Teriflunomid je imunomodulační inhibice léku pyrimidin de novo syntéza blokováním enzymu dihydroorotát dehydrogenáza. Není jisté, zda to vysvětluje jeho účinek na léze MS.[9]
Teriflunomid inhibuje rychle se dělící buňky, včetně aktivovaných T buněk, o nichž se předpokládá, že řídí chorobný proces u MS. Teriflunomid může snížit riziko infekcí ve srovnání s léky podobnými chemoterapii, protože má omezenější účinky na imunitní systém.[10]
Bylo zjištěno, že teriflunomid blokuje transkripční faktor NF-kB. Také to inhibuje tyrosinkináza enzymy, ale pouze ve vysokých dávkách, které se klinicky nepoužívají.[11]
Aktivace leflunomidu na teriflunomid
Hlavní léčivou látkou je značkový lék teriflunomid in vivo metabolit obecně dostupný leflunomid. Po podání leflunomidu se 70% podaného léčiva přemění na teriflunomid. Jediným rozdílem mezi molekulami je otevření izoxazolového kruhu. To je považováno za jednoduchou strukturální modifikaci a technicky jednoduchou syntetickou transformaci v jednom kroku. Po perorálním podání leflunomidu in vivose otevře izoxazolový kruh leflunomidu a vytvoří se teriflunomid.[12]

„Bez ohledu na podávanou látku (leflunomid nebo teriflunomid) je to stejná molekula (teriflunomid) - ta, která působí farmakologicky, imunologicky nebo metabolicky za účelem obnovení, úpravy nebo úpravy fyziologických funkcí a nepředstavuje při klinickém použití , nová chemická entita pro pacienty. “[12] Kvůli tomu, EMA původně nepovažoval teriflunomid za novou účinnou látku.[15]
Viz také
Vidět leflunomid informace o farmakokinetice, vedlejších účincích, kontraindikacích a dalších údajích.
Reference
- ^ A b C „Teriflunomid (Aubagio) užívání během těhotenství“. Drugs.com. 11. září 2019. Citováno 2. března 2020.
- ^ Magne D, Mézin F, Palmer G, Guerne PA (listopad 2006). „Aktivní metabolit leflunomidu, A77 1726, zvyšuje proliferaci lidských synoviálních fibroblastů v přítomnosti IL-lbeta a TNF-alfa.“ Výzkum zánětu. 55 (11): 469–75. doi:10.1007 / s00011-006-5196-x. PMID 17122964. S2CID 47034503.
- ^ ClinicalTrials.gov Fáze III Studie teriflunomidu při snižování frekvence relapsů a akumulace zdravotního postižení u pacientů s roztroušenou sklerózou (TEMSO)
- ^ „Teriflunomid společnosti Sanofi-Aventis dosáhl trumfů ve dvouleté zkoušce MS fáze III“. 15. října 2010.
- ^ Gever J (4. června 2012). „Teriflunomide Modest Help but Safe for MS“. medpage. Společné zasedání Konsorcia center pro roztroušenou sklerózu a Amerického výboru pro léčbu a výzkum roztroušené sklerózy. Citováno 4. června 2012.
- ^ „Balíček pro schválení léků: tablety Aubagio (teriflunomid) NDA # 202992“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 5. listopadu 2012. Citováno 1. března 2020.
- ^ „FDA schvaluje novou léčbu roztroušené sklerózy Aubagio“ (Tisková zpráva). NÁS. Úřad pro kontrolu potravin a léčiv (FDA). Archivovány od originál dne 2012-09-13. Citováno 2012-09-14.
- ^ „Aubagio EPAR“. Evropská agentura pro léčivé přípravky (EMA). 26. února 2020. Citováno 1. března 2020.
- ^ Spreitzer H (13. března 2006). „Neue Wirkstoffe - Teriflunomid“. Österreichische Apothekerzeitung (v němčině) (6/2006).
- ^ Vollmer T (28. května 2009). „MS Therapies in the Pipeline: Teriflunomide“. Zprávy EMS (28. května 2009).
- ^ Breedveld FC, Dayer JM (listopad 2000). „Leflunomid: způsob účinku při léčbě revmatoidní artritidy“. Annals of the Revmatic Diseases. 59 (11): 841–9. doi:10.1136 / ard.59.11.841. PMC 1753034. PMID 11053058.
- ^ A b Melchiorri D, Barbara vZ, Romaldas M, Nela V, Karsten BS, Ian H, Robert H, Harald E, Pierre D. „Zpráva o posouzení. AUBAGIO (mezinárodní nechráněný název: teriflunomid). Postup č. EMEA / H / C / 002514/0000“ (PDF). Evropská agentura pro léčivé přípravky. Evropská agentura pro léčivé přípravky. p. 119. Citováno 5. června 2015.
- ^ Rozman B (2002). "Klinická farmakokinetika leflunomidu". Klinická farmakokinetika. 41 (6): 421–30. doi:10.2165/00003088-200241060-00003. PMID 12074690. S2CID 33745823.
- ^ "Recenze klinické farmakologie / biofarmaceutiky. Produkt: Arava (tablety leflunomidu). Číslo žádosti: NDA 20905" (PDF). NÁS. Úřad pro kontrolu potravin a léčiv (FDA). Citováno 15. dubna 2016.
- ^ „Shrnutí stanoviska (počáteční povolení): Aubagio (teriflunomid)“ (PDF). Evropská agentura pro léčivé přípravky. Citováno 15. dubna 2016.
externí odkazy
- „Teriflunomid“. Informační portál o drogách. Americká národní lékařská knihovna.
