Klastr kubánského typu - Cubane-type cluster

A shluk kubánského typu je uspořádání atomů v molekulární struktuře, které tvoří a krychle. V idealizovaném případě je osm vrcholů ekvivalentních symetrie a druh má Oh symetrie. Takovou strukturu ilustruje uhlovodík kubánský. S chemický vzorec C8H8, kuban má atomy uhlíku v rozích krychle a kovalentní vazby tvořící hrany. Většina kubánů má složitější struktury, obvykle s neekvivalentními vrcholy. Mohou to být jednoduché kovalentní sloučeniny nebo makromolekulární nebo supramolekulární shlukové sloučeniny.
Příklady
Další sloučeniny, které mají v rozích různé prvky, různé atomy nebo skupiny spojené s rohy, jsou součástí této třídy struktur. Anorganické klastry kubánského typu zahrnují chlorid seleničitý, chlorid teluritý, a silox sodný.
Kubánské klastry jsou běžné v celém textu bioanorganická chemie. Ferredoxiny obsahující [Fe4S4] klastry železo-síra jsou všudypřítomné.[1] Čtyři atomy železa a čtyři atomy síry tvoří v rozích střídavé uspořádání. Celý shluk je obvykle ukotven koordinací atomů železa, obvykle s cystein zbytky. Tímto způsobem dosahuje každé Fe centrum čtyřboká koordinační geometrie. Některé [Fe4S4] shluky vznikají dimerizací čtvercového [Fe2S2] předchůdci. Je známo mnoho syntetických analogů, včetně heterometalických derivátů.[2]
- Ilustrativní kubánské klastry

Das cubane, [CoO (OAc) py]4 (OAc = acetát; py = pyridin )[3]
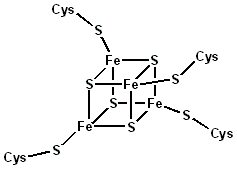
Ferredoxin (4Fe-4S-kuban)
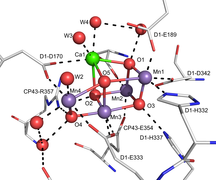
CaMn3Ó4 kubánský dovnitř Photosystem II.[4]

Kubánský, C.8H8
Několik alkyllithium sloučeniny obvykle existují jako shluky v roztoku tetramery, se vzorcem [RLi]4. Mezi příklady patří methyllithium a tert-butyllithium. Jednotlivé molekuly RLi nejsou pozorovány. Čtyři atomy lithia a uhlík z každé k nim vázané alkylové skupiny zaujímají střídavé vrcholy krychle, přičemž další atomy alkylových skupin vyčnívají z příslušných rohů.[5]
Oktaazacuban je hypotetický allotrope z dusík se vzorcem N8; atomy dusíku jsou rohy krychle. Stejně jako u kubanových sloučenin na bázi uhlíku se předpokládá, že je oktaazacuban vysoce nestabilní úhel napětí v rozích a také si to neužije kinetická stabilita vidět pro jeho organické analogy.[6]
Reference
- ^ Perrin, Jr., BS; Ichive, T. (2013). „Identifikace determinantů sekvence redukčních potenciálů metaloproteinů“. Biologická anorganická chemie. 18 (6): 599–608. doi:10.1007 / s00775-013-1004-6. PMC 3723707. PMID 23690205.
- ^ Lee, S. C .; Lo, W .; Holm, R. H., „Vývoj v biomimetické chemii klastrů kubánového typu a klastrů železa a síry s vyšší nukleární energií“, Chem. Rev. 2014, doi:10.1021 / cr4004067
- ^ Chakrabarty, Rajesh; Bora, Sanchay J .; Das, Birinchi K. (2007). "Syntéza, struktura, spektrální a elektrochemické vlastnosti a katalytické použití kobaltových (III) - kubánských klastrů". Anorganická chemie. 46 (22): 9450–9462. doi:10.1021 / ic7011759. PMID 17910439.
- ^ Umena, Yasufumi; Kawakami, Keisuke; Shen, Jian-Ren; Kamiya, Nobuo (2011). „Krystalová struktura fotosystému II vyvíjejícího kyslík v rozlišení 1,9 Å“ (PDF). Příroda. 473 (7345): 55–60. Bibcode:2011Natur.473 ... 55U. doi:10.1038 / nature09913. PMID 21499260. S2CID 205224374.
- ^ Stey, Thomas; Stalke, Dietmar (2009). "Olověné struktury v lithiové organické chemii". Chemie funkčních skupin PATAI'S. John Wiley & Sons, Ltd. doi:10.1002 / 9780470682531.pat0298. ISBN 9780470682531.
- ^ Agrawal, Jai Prakash (2010). Vysokoenergetické materiály: pohonné látky, výbušniny a pyrotechnika. Wiley-VCH. p. 498. ISBN 978-3-527-62880-3.




