Elektrofilní fluorace - Electrophilic fluorination
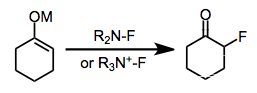
Elektrofilní fluorace je kombinace uhlík-střed nukleofil s elektrofilní zdroj fluor dovolit si organofluorové sloučeniny. Ačkoli lze pro tento účel použít elementární fluor a činidla obsahující vazbu kyslík-fluor, byly do značné míry nahrazeny činidly obsahujícími vazbu dusík-fluor.[1]
Elektrofilní fluorace nabízí alternativu k metodám nukleofilní fluorace využívajícím alkalické nebo amonné fluoridy a metodám používajícím fluoridy síry pro přípravu organofluorových sloučenin. Vývoj elektrofilních fluoračních činidel se vždy zaměřoval na odstraňování elektronové hustoty z atomu připojeného k fluoru; sloučeniny obsahující vazby dusík-fluor se však ukázaly jako nejekonomičtější, nejstabilnější a nejbezpečnější elektrofilní fluorační činidla. Elektrofilní N-F činidla jsou buď neutrální nebo kationtová a mohou obsahovat buď sp2- nebo sp3-hybridizovaný dusík. Ačkoli přesný mechanismus elektrofilní fluorace je v současné době nejasný, vysoce účinný a stereoselektivní byly vyvinuty metody.
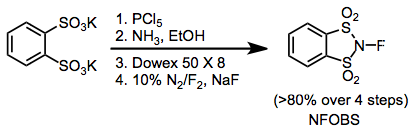
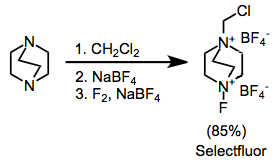
Některá běžná fluorační činidla používaná pro organickou syntézu jsou N-fluoro-Ó-benzendisulfonimid (NFOBS), N-fluorobenzensulfonimid (NFSI) a Selectfluor.[1]
Mechanismus a stereochemie
Převládající mechanismus
Mechanismus elektrofilní fluorace zůstává kontroverzní. Jde o to, zda reakce probíhá prostřednictvím S.N2 nebo přenos jednoho elektronu (SET) proces. Na podporu S.N2 mechanismus, aryl Grignardova činidla a aryllithia poskytnout podobné výnosy fluorobenzen v kombinaci s N-fluoro-Ó-benzendisulfonimid (NFOBS), i když se tendence těchto činidel účastnit se procesů SET podstatně liší.[2] Navíc experimenty s radikální sondou s 5-hexenyl a cyklopropyl enol ethery neposkytly žádné přeskupené produkty.[3] V poslední době kinetické studie elektrofilní fluorace řady 1,3-dikarbonylových derivátů řadou N-F činidel naznačují, že SNMechanismus 2 je pravděpodobnější prostřednictvím Eyring a Hammett studie.[4]
Na druhou stranu se předpokládá, že životnost radikálů v procesu SET bude o čtyři řády kratší než detekční limit i těch nejcitlivějších radikálních sond. Předpokládá se, že po přenosu elektronů dochází k okamžité rekombinaci fluorového radikálu s alkylovým radikálem.[5]
Stereoselektivní varianty
Stereoselektivní fluorace mohou být diastereoselektivní nebo enantioselektivní. Diastereoselektivní metody se zaměřily na použití chirální pomocné látky na nukleofilním substrátu. Pro fluorace karbonylové sloučeniny, chirální oxazolidinony byly úspěšně použity.[6]
K syntéze β-amino α-fluoresterů v chirální neracemické formě bylo použito přidání tandemového konjugátu zahrnujícího chirální nukleofil.
Enantioselektivní metody využívají stechiometrická množství chirálních fluoračních činidel. N-fluoramoniové soli cinchona alkaloidů představují nejmodernější reakce tohoto typu. Kromě toho se z těchto reagencií snadno syntetizuje Selectfluor a mateřské alkaloidy.[7]
Rozsah a omezení
Fluorační činidla
Elektrofilní N-F fluorační činidla obsahují skupiny přitahující elektrony připojené k dusíku, aby se snížila hustota elektronů na fluoru. Ačkoli N-fluorosulfonamidy jsou poměrně slabá fluorační činidla, N-fluorosulfonimides, jako N-fluorbenzensulfonimid (NFSI), jsou velmi účinné a běžně používané. N-fluor-o-benzendisulfonimid (NFOBS) se syntetizuje z disulfonové kyseliny.[2]
Použití solí kationtového dusíku zvyšuje rychlost a výtěžek elektrofilní fluorace, protože kationtový dusík odstraňuje elektronovou hustotu z fluoru. N-fluorpyridiniové ionty a iminiové ionty mohou být také použity jako elektrofilní fluorační činidla. Protiionty těchto solí, i když se přímo nepodílejí na přenosu fluoru na substrát, jemně ovlivňují reaktivitu a lze je upravit pomocí různých metod.[8]
Synteticky nejužitečnější amonné soli jsou substituované ionty DABCO bis (amonné), včetně Selectfluor.[9] Ty lze snadno syntetizovat alkylací následovanou fluorací. Difluorová verze, která by se na první pohled mohla zdát užitečnější, poskytuje pouze jeden atom fluoru.
Specializovanější elektrofilní fluorační činidla, jako jsou neutrální heterocykly obsahující vazby N – F,[10] jsou užitečné pro fluoraci omezeného rozsahu substrátů.
Nukleofilní substráty
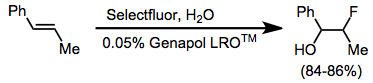
Jednoduché fluorace alkenů často produkují složité směsi produktů. Avšak fluorace v přítomnosti nukleofilu probíhá čistě za vzniku vicinálních alkoxyfluoridů.[11] Alkyny nejsou fluorovány činidly N-F. An aniontová povrchově aktivní látka byl použit k usnadnění kontaktu mezi vodným Selectfluorem a alkenem.
Fluorace aromatických sloučenin bohatých na elektrony poskytuje arylfluoridy. Dva nejběžnější problémy v této třídě reakcí jsou nízké ortho/odst selektivity a dearomatizace (to je zvláště významný problém pro fenoly).[12]
Enol ethery a glykály jsou dostatečně nukleofilní, aby je bylo možné fluorovat Selectfluorem.[13] Podobně jako u jiných alkenů lze kohalogenaci provést buď izolací meziproduktu aduktu a reakcí s nukleofilem nebo přímým vytěsněním DABCO in situ. Enoly mohou být enantioselektivně fluorovány (viz výše) v přítomnosti chirálního fluoračního činidla.
Kovové enoláty jsou kompatibilní s mnoha fluoračními činidly, včetně NFSI, NFOBS a sulfonamidů. Specializované činidlo 2-fluor-3,3-dimethyl-2,3-dihydrobenzo [d] isothiazol 1,1-dioxid trvale poskytuje lepší výtěžky monofluorovaných karbonylových sloučenin při reakcích s lithnými enoláty. Jiné kovové enoláty poskytly velké množství difluorovaných produktů.[14]
Srovnání s jinými metodami
Ačkoli použití molekulárního fluoru jako zdroje elektrofilního fluoru je často nejlevnější a nejpřímější metodou, F2 často tvoří radikály a reaguje s CH vazbami bez selektivity. K potlačení tvorby radikálů jsou zapotřebí zdroje protonu nebo Lewisovy kyseliny, ai když jsou tato činidla přítomna, reagují pouze určité substráty s vysokou selektivitou.[15] Manipulace s plynnými látkami2 vyžaduje extrémně specializované a nákladné vybavení.
Činidla obsahující vazby O-F, jako je CF3OF, mají tendenci být selektivnější pro monofluoraci než činidla N-F.[16] Obtíže spojené s manipulací a jejich extrémní oxidační silou však vedly k jejich nahrazení činidly N-F.
Xenondi-, tetra- a hexafluorid jsou selektivní monofluorační činidla. Díky jejich nestabilitě a vysokým nákladům jsou však méně populární než dusíkatá fluorační činidla.[17]
Experimentální podmínky a postup
Typické podmínky
Ačkoliv fluorace využívající reagenty N-F nepoužívají přímo molekulární fluor, jsou téměř univerzálně připraveny z F2. Správné zacházení s F2 vyžaduje velkou péči a speciální zařízení.[18] Poly (tetrafluorethylen) (PTFE, známé také jako teflon), se reakční nádoby přednostně používají pro nerezavějící ocel nebo sklo pro reakce zahrnující molekulární fluor. F2 mísí se s N2 nebo jsou komerčně dostupné a pomáhají řídit rychlost dodávání fluoru. Aby se zabránilo reakci volných radikálů, je třeba udržovat nízké teploty a pomalý přísun fluoru.
Viz také
Reference
- ^ A b Badoux, J .; Cahard, D. Org. Reagovat. 2007, 69, 347. doi:10.1002 / 0471264180.nebo069.02
- ^ A b Davis, F. A .; Han, W .; Murphy, C. K. J. Org. Chem. 1995, 60, 4730.
- ^ Differding, E .; Rüegg, G. M. Tetrahedron Lett. 1991, 32, 3815.
- ^ Rozatian, Neshat; Ashworth, Ian W .; Sandford, Graham; Hodgson, David R.W. (2018). „Kvantitativní stupnice reaktivity pro elektrofilní fluorační činidla“. Chemická věda. 9 (46): 8692–8702. doi:10.1039 / C8SC03596B.
- ^ Piana, S .; Devillers, I .; Togni, A .; Rothlisberger, U. Angew. Chem. Int. Vyd. Angl. 2002, 41, 979.
- ^ Davis, F. A .; Kasu, P. V. N. Tetrahedron Lett. 1998, 39, 6135.
- ^ Shibata, N .; Suzuki, E .; Asahi, T .; Shiro, M. J. Am. Chem. Soc. 2001, 123, 7001.
- ^ Umemoto, T .; Harasawa, K .; Tomizawa, G .; Kawada, K .; Tomita, K. Býk. Chem. Soc. Jpn. 1991, 64, 1081.
- ^ Stavber, S .; Zupan, M .; Poss, A. J .; Shia, G. A. Tetrahedron Lett. 1995, 36, 6769.
- ^ Laali, K. K .; Tanaka, M .; Forohar, F .; Cheng, M .; Fetzer, J. C. J. Fluorine Chem. 1998, 91, 185.
- ^ Lal, G. S. J. Org. Chem. 1993, 58, 2791.
- ^ Zupan, M .; Iskra, J .; Stavber, S. Býk. Chem. Soc. Jpn. 1995, 68, 1655.
- ^ Albert, M .; Dax, K .; Ortner, J. Čtyřstěn 1998, 54, 4839.
- ^ Differding, E .; Lang, R. W. Helv. Chim. Acta. 1989, 72, 1248.
- ^ Chambers, R. D .; Hutchinson, J .; Sandford, G. J. Fluorine Chem. 1999, 100, 63.
- ^ Rozen, S. Chem. Rev. 1996, 96, 1717.
- ^ Ramsden, C. A .; Smith, R. G. J. Am. Chem. Soc. 1998, 120, 6842.
- ^ Umemoto, T .; Nagayoshi, M. Býk. Chem. Soc. Jpn. 1996, 69, 2287.