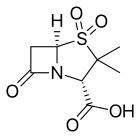
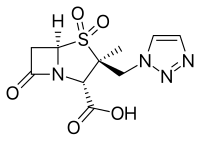
Inhibitor Β-laktamázy - Β-Lactamase inhibitor
Beta-laktamázy jsou rodina enzymy podílí se na bakteriích odpor na beta-laktamová antibiotika. Jednají rozbitím beta-laktam prsten, který umožňuje penicilin - jako antibiotika do práce. Strategie boje proti této formě rezistence zahrnovaly vývoj nových beta-laktamových antibiotik, která jsou odolnější vůči štěpení, a vývoj třídy inhibitory enzymů volala inhibitory beta-laktamázy.[1] Ačkoli mají inhibitory β-laktamázy svou vlastní malou antibiotickou aktivitu,[2] zabraňují bakteriální degradaci beta-laktamových antibiotik a rozšiřují tak rozsah bakterií, proti kterým jsou léky účinné.
Lékařské použití
Nejdůležitější použití inhibitorů beta-laktamázy je při léčbě infekcí, o nichž je známo nebo se předpokládá, že jsou způsobeny gramnegativní bakterie, protože produkce beta-laktamázy významně přispívá k beta-laktamové rezistenci u těchto patogenů. Naproti tomu většina rezistence na beta-laktam v grampozitivní bakterie je kvůli změnám v proteiny vázající penicilin které vedou ke snížené vazbě na beta-laktam.[3][4] Grampozitivní patogen Staphylococcus aureus produkuje beta-laktamázy, ale inhibitory beta-laktamázy hrají při léčbě těchto infekcí menší roli, protože nejodolnější kmeny (rezistentní na meticilin Staphylococcus aureus ) také používají variantní proteiny vázající penicilin.[5][6]
Mechanismus účinku
Amblerův klasifikační systém seskupuje známé beta-laktamázové enzymy do čtyř skupin podle sekvenční homologie a předpokládaných fylogenetických vztahů. Třídy A, C a D štěpí beta-laktamy vícestupňovým mechanismem analogickým mechanismu serinové proteázy. Po navázání vytvoří serinová hydroxylová skupina v aktivním místě beta-laktamázy přechodnou kovalentní vazbu na karbonylovou skupinu beta-laktamového kruhu, přičemž v tomto procesu štěpí beta-laktamový kruh. Ve druhém kroku nukleofilní útok molekuly vody štěpí kovalentní vazbu mezi enzymem a karbonylovou skupinou někdejšího beta-laktamu. To umožňuje degradaci beta-laktamu difundovat a uvolňuje enzym pro zpracování dalších molekul beta-laktamu.
V současné době dostupné inhibitory beta-laktamázy jsou účinné proti beta-laktamázám třídy Ambler A (tazobaktam, klavulanát a sulbaktam) nebo proti třídě Ambler třídy A, C a některým beta-laktamázám třídy D (avibaktam). Stejně jako beta-laktamová antibiotika jsou zpracována beta-laktamázami za vzniku počátečního kovalentního meziproduktu. Na rozdíl od beta-laktamových antibiotik působí inhibitory jako sebevražedné substráty (tazobaktam a sulbaktam), což nakonec vede k degradaci beta-laktamázy.[7] Avibactam na druhé straně neobsahuje beta-laktamový kruh (ne-beta-laktamový inhibitor beta-laktamázy) a místo toho váže reverzibilně.[8][9]
Ambler třídy B beta-laktamázy štěpí beta-laktamy mechanismem podobným tomu z metaloproteázy. Protože se nevytváří žádný kovalentní meziprodukt, není mechanismus účinku prodávaných inhibitorů beta-laktamázy použitelný. Šíření bakteriálních kmenů exprimujících metalo beta-laktamázy, jako je New Delhi metalo-beta-laktamáza 1 vyvolal značné znepokojení.[10]
Běžně používané prostředky
V současnosti prodávané inhibitory β-laktamázy se neprodávají jako jednotlivé léky. Místo toho jsou společně formulovány s β-laktamovým antibiotikem s podobným poločasem v séru. To se provádí nejen pro pohodlí dávkování, ale také pro minimalizaci vývoje rezistence, ke kterému může dojít v důsledku proměnlivé expozice jednomu nebo druhému léčivu. Mezi hlavní třídy β-laktamových antibiotik používaných k léčbě gramnegativních bakteriálních infekcí patří (v přibližném pořadí vnitřní rezistence na štěpení β-laktamázami) peniciliny (zejména aminopeniciliny a ureidopeniciliny), cefalosporiny 3. generace a karbapenemy. Jednotlivé varianty β-laktamázy mohou cílit na jednu nebo mnoho z těchto tříd léčiv a pouze podskupina bude inhibována daným inhibitorem β-laktamázy.[9] Inhibitory β-laktamázy rozšiřují užitečné spektrum těchto β-laktamových antibiotik tím, že inhibují β-laktamázové enzymy produkované bakteriemi, aby je deaktivovaly.[11]
- Inhibitory β-laktamázy s β-laktamovým jádrem:
- Tebipenem je první karbapenem, který se podává orálně ve formě tebipenem-pivoxilu. Strukturální a kinetické studie tebipenemu jsou k dispozici u M. tuberculosis beta-laktamáza (BlaC).[12]
- Kyselina klavulanová nebo klavulanát, obvykle v kombinaci s amoxicilin (Augmentin ) nebo tikarcilin (Timentin )
- Sulbaktam, obvykle v kombinaci s ampicilin (Unasyn ) nebo cefoperazon (Sulperazon )
- Tazobaktam, obvykle v kombinaci s piperacilin (Zosyn a Tazocin )
- Inhibitory β-laktamázy bez β-laktamového jádra:
- Avibactam, schváleno v kombinaci s ceftazidim (Avycaz ), v současné době prochází klinickými zkouškami pro kombinaci s ceftarolin
- Relebactam, použitý v kombinaci s imipenem / cilastatin (Recarbrio ).[13][14]
- Vaborbaktam, použitý v kombinaci s meropenem (Vabomere )[15]
Bakterie produkující beta-laktamázu
Mezi bakterie, které mohou produkovat beta-laktamázy, patří mimo jiné:
- Staphylococcus
- MRSA (Methicilin-rezistentní Staphylococcus aureus)
- Enterobacteriaceae:
- Haemophilus influenzae
- Neisseria gonorrhoeae
- Pseudomonas aeruginosa
- Mycobacterium tuberculosis
Výzkum
Některé bakterie mohou produkovat β-laktamázy s rozšířeným spektrem (ESBL), což ztěžuje léčbu infekce a propůjčuje další odolnost peniciliny, cefalosporiny, a monobaktamy.[16]Kyselina boritá deriváty jsou v současné době předmětem rozsáhlého a rozsáhlého výzkumu jako nových inhibitorů aktivního místa pro beta-laktamázy, protože obsahují místo, které napodobuje přechodový stav, kterým beta-laktamy procházejí, když procházejí hydrolýzou pomocí beta-laktamáz. Bylo zjištěno, že obecně dobře zapadají do aktivního místa mnoha beta-laktamáz a mají výhodnou vlastnost, že nemohou být hydrolyzovány, a proto jsou nepoužitelné. Toto je příznivý design léčiva oproti mnoha klinicky používaným konkurenčním činidlům, protože většina z nich, jako je kyselina klavulanová, se hydrolyzuje, a proto jsou užitečná pouze po omezenou dobu. To obecně způsobuje potřebu vyšší koncentrace kompetitivního inhibitoru, než by bylo nutné u nehydrolyzovatelného inhibitoru. Různé deriváty kyseliny borité mají potenciál být přizpůsobeny mnoha různým izoformám beta-laktamáz, a proto mají potenciál obnovit účinnost beta-laktamových antibiotik.[17]
Reference
- ^ Essack SY (říjen 2001). „Vývoj beta-laktamových antibiotik v reakci na vývoj beta-laktamáz“. Farmaceutický výzkum. 18 (10): 1391–9. doi:10.1023 / a: 1012272403776. PMID 11697463. S2CID 34318096.
- ^ „Inhibitory beta-laktamázy“. Ústav ošetřovatelství Státní univerzita ve Fort Hays Vysoká škola zdravotnictví a biologie. Říjen 2000. Archivovány od originál dne 2007-09-27. Citováno 2007-08-17.
- ^ Georgopapadakou NH (říjen 1993). „Proteiny vázající penicilin a bakteriální rezistence k beta-laktamům“. Antimikrobiální látky a chemoterapie. 37 (10): 2045–53. doi:10.1128 / aac.37.10.2045. PMC 192226. PMID 8257121.
- ^ Zapun A, Contreras-Martel C, Vernet T (březen 2008). „Proteiny vázající penicilin a rezistence na beta-laktam“. Recenze mikrobiologie FEMS. 32 (2): 361–85. doi:10.1111 / j.1574-6976.2007.00095.x. PMID 18248419.
- ^ Curello J, MacDougall C (červenec 2014). „Beyond Susceptible and Resistant, Část II: Léčba infekcí způsobených gramnegativními organismy produkujícími β-laktamázy s rozšířeným spektrem“. The Journal of Pediatric Pharmacology and Therapeutics. 19 (3): 156–64. doi:10.5863/1551-6776-19.3.156. PMC 4187532. PMID 25309145.
- ^ Wolter DJ, Lister PD (2013). "Mechanismy rezistence na β-laktam u Pseudomonas aeruginosa". Současný farmaceutický design. 19 (2): 209–22. doi:10.2174/13816128130203. PMID 22894618.
- ^ Patrick, Graham L. (2017). Úvod do léčivé chemie (6. vydání). Oxford, Velká Británie. ISBN 9780198749691. OCLC 987051883.
- ^ Lahiri SD, Mangani S, Durand-Reville T, Benvenuti M, De Luca F, Sanyal G, Docquier JD (červen 2013). „Strukturální pohled na silnou širokospektrální inhibici s reverzibilním recyklačním mechanismem: avibaktam v komplexu s CT-M-15 a P-laktamázami AmpC Pseudomonas aeruginosa“. Antimikrobiální látky a chemoterapie. 57 (6): 2496–505. doi:10.1128 / AAC.02247-12. PMC 3716117. PMID 23439634.
- ^ A b Drawz SM, Bonomo RA (leden 2010). „Tři desetiletí inhibitorů beta-laktamázy“. Recenze klinické mikrobiologie. 23 (1): 160–201. doi:10.1128 / CMR.00037-09. PMC 2806661. PMID 20065329.
- ^ Biedenbach D, Bouchillon S, Hackel M, Hoban D, Kazmierczak K, Hawser S, Badal R (únor 2015). „Šíření genů NDM metalo-β-laktamázy mezi klinickými izoláty Enterobacteriaceae shromážděnými během studie SMART o globálním dozoru od roku 2008 do roku 2012“. Antimikrobiální látky a chemoterapie. 59 (2): 826–30. doi:10.1128 / AAC.03938-14. PMC 4335866. PMID 25403666.
- ^ Watson ID, Stewart MJ, Platt DJ (září 1988). "Klinická farmakokinetika inhibitorů enzymů v antimikrobiální chemoterapii". Klinická farmakokinetika. 15 (3): 133–64. doi:10.2165/00003088-198815030-00001. PMID 3052984. S2CID 2388750.
- ^ Hazra S, Xu H, Blanchard JS (červen 2014). „Tebipenem, nové karbapenemové antibiotikum, je pomalý substrát, který inhibuje β-laktamázu z Mycobacterium tuberculosis.“. Biochemie. 53 (22): 3671–8. doi:10.1021 / bi500339j. PMC 4053071. PMID 24846409.
- ^ „FDA schvaluje novou léčbu komplikovaných močových cest a komplikovaných nitrobřišních infekcí“. Úřad pro kontrolu potravin a léčiv. 17. července 2019.
- ^ „Cilastatin / imipenem / relebactam - AdisInsight“. Springer International Publishing AG. Citováno 29. dubna 2016.
- ^ „FDA schvaluje nové antibakteriální léčivo“ (Tisková zpráva). Úřad pro kontrolu potravin a léčiv. 29. srpna 2017.
- ^ Livermore DM (říjen 1995). „beta-laktamázy v laboratorní a klinické rezistenci“. Recenze klinické mikrobiologie. 8 (4): 557–84. doi:10,1128 / cmr.8,4,557. PMC 172876. PMID 8665470.
- ^ Leonard DA, Bonomo RA, Powers RA (listopad 2013). „Β-laktamázy třídy D: přehodnocení po pěti desetiletích“. Účty chemického výzkumu. 46 (11): 2407–15. doi:10.1021 / ar300327a. PMC 4018812. PMID 23902256.
externí odkazy
- Xu H, Hazra S, Blanchard JS (červen 2012). „NXL104 nevratně inhibuje β-laktamázu z Mycobacterium tuberculosis“. Biochemie. 51 (22): 4551–7. doi:10.1021 / bi300508r. PMC 3448018. PMID 22587688.
- Kurz SG, Wolff KA, Hazra S, Bethel CR, Hujer AM, Smith KM, Xu Y, Tremblay LW, Blanchard JS, Nguyen L, Bonomo RA (prosinec 2013). „Mohou substituce rezistentní na inhibitory u β-laktamázy BlaC Mycobacterium tuberculosis vést k rezistenci na klavulanáty ?: biochemické zdůvodnění použití kombinací inhibitorů β-laktam-β-laktamázy“. Antimikrobiální látky a chemoterapie. 57 (12): 6085–96. doi:10.1128 / AAC.01253-13. PMC 3837893. PMID 24060876.