Pyrrol - Pyrrole
| |||
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC 1H-Pyrrol | |||
Ostatní jména
| |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 1159 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.003.387 | ||
| Číslo ES |
| ||
| 1705 | |||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 1992, 1993 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C4H5N | |||
| Molární hmotnost | 67.091 g · mol−1 | ||
| Hustota | 0,967 g cm−3 | ||
| Bod tání | −23 ° C (−9 ° F; 250 K) | ||
| Bod varu | 129 až 131 ° C (264 až 268 ° F; 402 až 404 K) | ||
| Tlak páry | 7 mmHg při 23 ° C | ||
| Kyselost (strK.A) | 16,5 (pro N-H proton) | ||
| Zásaditost (strK.b) | 13,6 (pKa 0,4 pro C.A. ) | ||
| -47.6·10−6 cm3/ mol | |||
| Viskozita | 0,001225 Pa s | ||
| Termochemie | |||
Tepelná kapacita (C) | 1,903 J K.−1 mol−1 | ||
Std entalpie of formace (ΔFH⦵298) | 108,2 kJ mol−1 (plyn) | ||
Std entalpie of spalování (ΔCH⦵298) | 2242 kJ mol−1 | ||
| Nebezpečí | |||
| Bezpečnostní list | Údaje o chemické bezpečnosti | ||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | 33,33 ° C (91,99 ° F; 306,48 K) | ||
| 550 ° C (1022 ° F; 823 K) | |||
| Výbušné limity | 3.1–14.8% | ||
| Související sloučeniny | |||
Související sloučeniny | Fosfol, podešev, bismole, stibole | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Pyrrol je heterocyklický aromatický organická sloučenina, pětičlenný prsten s vzorec C4H4N H.[2] Je to bezbarvá těkavá kapalina, která po vystavení vzduchu snadno ztmavne. Substituované deriváty se také nazývají pyrroly, např. N-methylpyrol, C.4H4NCH3. Porfobilinogen, trisubstituovaný pyrrol, je biosyntetickým prekurzorem mnoha přírodních produktů, jako jsou heme.[3]
Pyrroly jsou součástí složitějších makrocyklů, včetně porfyrinogeny a výrobky z nich odvozené, včetně porfyriny z heme, chloriny, bakteriochloriny a chlorofyly.[4]
Vlastnosti
Pyrrol je bezbarvý nestálý kapalina, která po vystavení vzduchu snadno ztmavne a je obvykle čištěna destilace bezprostředně před použitím.[5] Pyrrol má ořechový zápach. Pyrrol je pětičlenný aromatický heterocykl, jako furan a thiofen. Na rozdíl od furanu a thiofenu má dipól, ve kterém pozitivní konec leží na straně heteroatomu, s dipólovým momentem 1,58D. V CDCI3, má chemické posuny na 6,68 (H2, H5) a 6,22 (H3, H4). Pyrrol je slabě bazický, s konjugovanou kyselinou pK.A -3,8. Termodynamicky nejstabilnější kation pyrrolium (C.4H6N+) je tvořen protonací v poloze 2. Substituce pyrrolu alkylovými substituenty poskytuje bazičtější molekulu - například tetramethylpyrol má konjugovanou kyselinu pK.A z +3,7. Pyrrol je také slabě kyselý v poloze N – H, s pK.A 16.5. Jako Lewisova kyselina vázající vodík je klasifikována jako a tvrdá kyselina a ECW model uvádí jeho kyselé parametry jako EA = 1,38 a CA = 0.68.
Dějiny
Pyrrol byl poprvé detekován uživatelem F. F. Runge v roce 1834 jako složka uhelný dehet.[6] V roce 1857 byl izolován z pyrolyzátu kosti. Jeho název pochází z řečtiny pyrrhos (πυρρός, „Načervenalý, ohnivý“), z reakce použité k jeho detekci - červená barva, kterou dodává dřevo, když je navlhčeno kyselina chlorovodíková.[7]
Výskyt v přírodě

Samotný pyrrol se přirozeně nevyskytuje, ale mnoho z jeho derivátů se nachází v řadě kofaktory a přírodní produkty. Mezi běžné přirozeně produkované molekuly obsahující pyrroly patří vitamin B12, žlučové pigmenty jako bilirubin a biliverdin a porfyriny z heme, chlorofyl, chloriny, bakteriochloriny a porfyrinogeny.[4] Další sekundární obsahující pyrrol metabolity zahrnují PQQ, makaluvamin M, ryanodin, rhazinilam, lamellarin, prodigiosin, myrmikarin a sceptrin. Syntézy heminu obsahujícího pyrrol, syntetizované autorem Hans Fischer byl uznán Nobelovou cenou.
Pyrrol je složkou tabákového kouře a může přispívat k jeho toxickým účinkům.[8]
Syntéza
Pyrrol se připravuje průmyslově zpracováním furan s amoniak v přítomnosti pevné kyseliny katalyzátory, jako SiO2 a Al2Ó3.[7]

Pyrrol lze také vytvořit katalytickou dehydrogenací pyrrolidinu.
Laboratorní trasy
Bylo popsáno několik syntéz pyrolového kruhu.[9]
Hantzschova syntéza pyrrolu
Hantzschova pyrrolická syntéza je reakcí β-ketoesterů (1) s amoniakem (nebo primárními aminy) a a-haloketony (2) dát substituované pyrroly (3).[10][11]

Knorrova syntéza pyrrolu
Knorrova syntéza pyrrolu zahrnuje reakci a-aminoketonu nebo a-amino-p-ketoesteru s aktivovanou methylenovou sloučeninou.[12][13][14] Tato metoda zahrnuje reakci α-aminoketon (1) a sloučenina obsahující a methylenová skupina α to (vázaný na další uhlík k) a karbonylová skupina (2).[15]

Paal – Knorrova syntéza pyrrolu
Při syntéze Paal-Knorr pyrrolu reaguje 1,4-dikarbonylová sloučenina s amoniakem nebo primárním aminem za vzniku substituovaného pyrrolu.[16][17]

Van Leusenova reakce
Van Leusenova reakce může být použita k vytvoření pyrrolů reakcí tosylmethylisokyanid (TosMIC) s enone v přítomnosti báze, v a Michael navíc. A 5-endo cyklizací pak vznikne 5-členný kruh, který reaguje za odstranění tosylové skupiny. Posledním krokem je tautomerizace na pyrrol.[Citace je zapotřebí ]
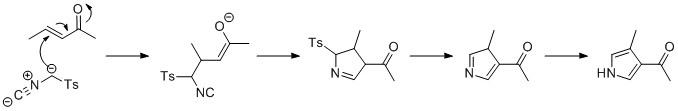
Barton-Zardova syntéza
Barton-Zardova syntéza probíhá podobným způsobem jako Van Leusenova syntéza. Isokyanoacetát reaguje s nitroalkenem v 1,4-adici, následuje 5-endo-kopat cyklizace, eliminace nitroskupina, a tautomerizace.[18]

Piloty – Robinsonova syntéza pyrrolu
Výchozí materiály pro syntézu pyrol-robinson pyrrolu, pojmenované pro Gertruda a Robert Robinson a Oskar Piloty, jsou dva ekvivalenty aldehyd a hydrazin.[19][20] Produktem je pyrrol se substituenty v polohách 3 a 4. Aldehyd reaguje s diaminem na meziprodukt di-já těžím (R – C = N – N = C – R). Ve druhém kroku je [3,3] -sigmatropní přesmyk odehrává se mezi. Přidání kyselina chlorovodíková vede k uzavření kruhu a ztrátě amoniak za vzniku pyrrolu. The mechanismus byl vyvinut Robinsons.
V jedné modifikaci propionaldehyd je nejprve ošetřeno hydrazin a pak s benzoylchlorid při vysokých teplotách a za asistence mikrovlnné záření:[21]
![Piloty – Robinsonova reakce [21]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/bd/Piloty-Robinson_reaction.png/400px-Piloty-Robinson_reaction.png)
Trasy založené na cykloadici
Pyrroly nesoucí více substituentů se získají reakcí sloučeniny vzorce münchnones a alkyny. Mechanismus reakce zahrnuje 1,3-dipolární cykloadice následovaná ztrátou oxid uhličitý retro-Diels – Olše proces. Podobné reakce lze provádět za použití azalaktonů.

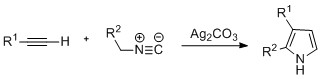
Pyrroly lze připravit pomocí stříbrný -katalyzovaná cyklizace alkynů s izonitrily, kde R2 je skupina odebírající elektrony a R1 je alkan, arylová skupina nebo ester. Ukázalo se také, že příklady disubstituovaných alkynů tvoří požadovaný pyrrol ve značném výtěžku. Navrhuje se, aby reakce probíhala prostřednictvím stříbra acetylid středně pokročilí. Tato metoda je obdobou metody azid-alkyn klikněte na chemii používá se k tvorbě azolů.
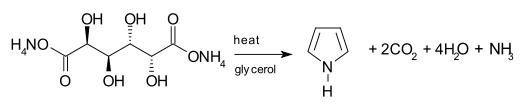
Jiné metody
Jedna syntetická cesta k pyrolu zahrnuje dekarboxylace z amonný muát, amonná sůl kyselina jablečná. Sůl se obvykle zahřívá v a destilace nastavení pomocí glycerol jako solventní.[22]
Biosyntéza pyrrolů
Biosyntéza de novo pyrrolových kruhů začíná kyselina aminolevulinová (ALA), který je syntetizován z glycin a sukcinyl-CoA. ALA dehydratáza katalyzuje kondenzaci dvou molekul ALA prostřednictvím a Knorrův typ kruhová syntéza za vzniku porfobilinogen (PBG). To později reaguje na vytvoření například makrocyklů heme a chlorofyl.[23]
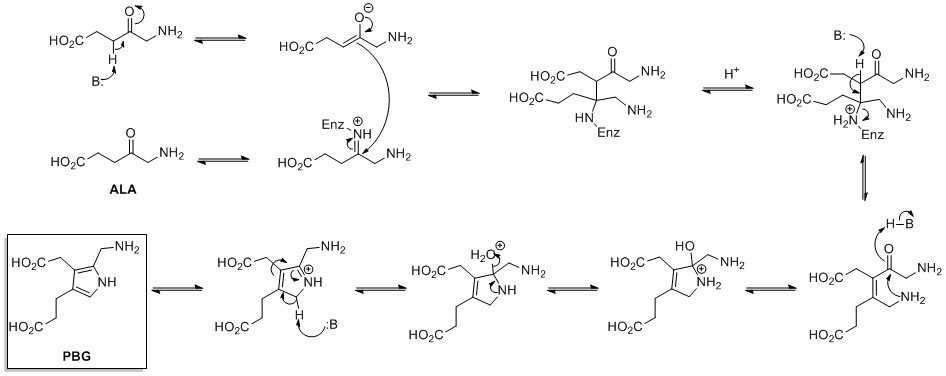
.
Prolin je biosynteticky odvozený od aminokyseliny L-glutamát. Glutamát-5-semialdehyd je nejprve tvořen glutamát 5-kináza (Závislé na ATP) a glutamát-5-semialdehyd dehydrogenáza (což vyžaduje NADH nebo NADPH). To pak může buď spontánně cyklizovat, aby se vytvořilo Kyselina 1-pyrrolin-5-karboxylová, který je redukován na prolin o pyrrolin-5-karboxylát reduktáza (pomocí NADH nebo NADPH), nebo se změnil na ornitin podle ornitinaminotransferáza, následovaná cyklizací pomocí ornithin cyklodeamináza tvořit prolin.[24]

Prolin lze použít jako prekurzor aromatických pyrrolů v druhotných přírodních produktech, jako v prodigiosinech.

Biosyntéza prodigiosinu[25][26] zahrnuje konvergentní kopulaci tří kruhů pyrrolového typu (na obrázku 1 označených A, B a C) z L-prolinu, L-Serinu, L-methioninu, pyruvátu a 2-oktenalu.
Kruh A je syntetizován z L-prolinu cestou nerribozomální peptidové syntázy (NRPS) (obrázek 2), přičemž pyrrolidinový kruh prolin je dvakrát oxidován prostřednictvím FAD + za vzniku pyrolového kruhu A.
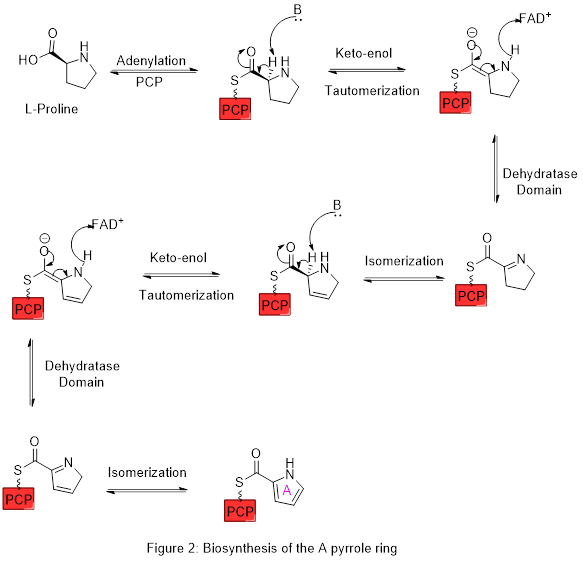
Kruh A je poté expandován polyketidovou syntázovou cestou k začlenění L-serinu do kruhu B (obrázek 3). Fragment kruhu A je přenesen z peptidylového nosného proteinu (PCP) na protein Acyl Carrier Protein (ACP) doménou KS, následovaný přenosem na malonyl-ACP dekarboxylační Claisenovou kondenzací. Tento fragment je poté schopen reagovat s maskovaným karbaniontem vytvořeným z PLP zprostředkované dekarboxylace L-serinu, který cyklizuje v dehydratační reakci za vzniku druhého pyrrolového kruhu. Tento meziprodukt je poté modifikován methylací (která inkorporuje methylovou skupinu z L-methioninu na alkohol v poloze 6) a oxidací primárního alkoholu na aldehyd za vzniku jádrových kruhových struktur A-B.

Reakce a reaktivita
Kvůli jeho aromatický charakter, pyrol je obtížné hydrogenovat, nereaguje snadno jako a dien v Diels – Olše reakce a nepodléhá obvyklému olefin reakce. Jeho reaktivita je podobná reaktivitě benzen a anilin, v tom, že je snadné alkylovat a acylovat. V kyselých podmínkách pyrroly polymerovat snadno, a tedy mnoho elektrofilní činidla, která se používají v chemii benzenu, se na pyrroly nevztahují. Naproti tomu substituované pyrroly (včetně chráněný pyrroly) byly použity v široké škále transformací.[9]
Reakce pyrrolu s elektrofily
Pyrroly obecně reagují s elektrofily v poloze α (C2 nebo C5), kvůli nejvyššímu stupni stability protonovaného meziproduktu.

Pyrroly snadno reagují nitrační (např. HNO3 /Ac2Ó ), sulfonovat (Py · SO3 ), a halogenační (např. NCS, NBS, Br2, TAK2Cl2, a KI /H2Ó2 ) agenti. Halogenace obecně poskytuje polyhalogenované pyrroly, ale lze provést monohalogenaci. Jak je typické pro elektrofilní adice na pyrroly, halogenace obvykle probíhá v 2-poloze, ale může také nastat v 3-poloze silací dusíku. Toto je užitečná metoda pro další funkcionalizaci obecně méně reaktivní 3 polohy.[Citace je zapotřebí ]
Acylace
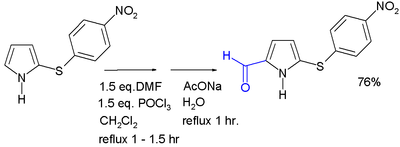
Acylace obvykle se vyskytuje v poloze 2 pomocí různých metod. Acylace s anhydridy kyselin a chloridy kyselin může nastat bez katalyzátoru; alternativně, a Lewisova kyselina může být použit. 2-Acylpyrroly se také získávají reakcí s nitrily působením Houben – Hoeschova reakce. Pyrrolové aldehydy mohou být tvořeny a Vilsmeier-Haackova reakce. N-Acylace jednoduchého pyrrolu neprobíhá.[Citace je zapotřebí ]
Alkylace
Elektrofilní alkylace jednoduchého pyrolu je neobvyklá. Byla pozorována alkylace za vzniku enonů na C2.[Citace je zapotřebí ]
Reakce deprotonovaného pyrrolu
NH proton v pyrrolech je středně kyselý s a strK.A ze dne 16.5. Pyrrol může být deprotonován silnými bázemi, jako je butyllithium a hydrid sodný. Výsledný alkalický pyrrolid je nukleofilní. Ošetření této konjugované báze elektrofilem, jako je jodmethan dává N-methylpyrol. N-Metalovaný pyrrol může reagovat s elektrofily v poloze N nebo C, v závislosti na koordinačním kovu. K tomu vede více iontových vazeb dusík-kov (například s Li, Na a K) a více solvatujících rozpouštědel N-alkylace. Nitrofilní kovy, jako je MgX, vedou k alkylaci na C (hlavně C2), kvůli vyššímu stupni koordinace s atomem dusíku. V případech N-substituované pyrroly, metalizace uhlíku je snadnější. Alkylové skupiny mohou být zavedeny jako elektrofily nebo křížovými vazebnými reakcemi.[Citace je zapotřebí ]
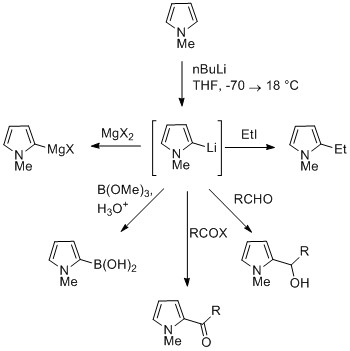
Substituce v C3 může být dosažena použitím N-substituovaný 3-brompyrol, který lze syntetizovat bromací N-silylpyrol s NBS.[Citace je zapotřebí ]
Snížení
Pyrroly mohou podstoupit redukci na pyrrolidiny a do pyrroliny. Například, Snížení břízy pyrrolesterů a amidů produkovalo pyrroliny, s regioselektivitou v závislosti na poloze skupiny odebírající elektrony.[Citace je zapotřebí ]
Cyklizační reakce
Pyrroly s N-střídání může podstoupit cykloadice reakce jako [4 + 2] -, [2 + 2] - a [2 + 1] -cyklizace. Diels-Alderovy cyklizace mohou nastat, když pyrrol působí jako dien, zejména v přítomnosti skupiny přitahující elektrony na dusíku. Vinylpyrroly mohou také působit jako dieny.[Citace je zapotřebí ]
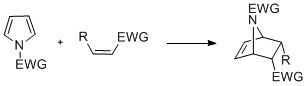
Pyrroly mohou reagovat s karbeny, jako dichlorkarbenu, v [2 + 1] -cykloadici. S dichlorkarbenu, vzniká dichlorcyklopropanový meziprodukt, který se štěpí za vzniku 3-chlorpyridin (Ciamician – Dennstedt přesmyk).[27][28][29]
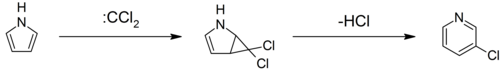
Komerční použití
Polypyrol má určitou komerční hodnotu. N-Metylpyrol je předchůdcem N-methylpyrrolkarboxylová kyselina, stavební kámen ve farmaceutické chemii.[7] Pyrroly se také nacházejí v několika drogách, včetně atorvastatin, ketorolac, a sunitinib. Pyrroly se používají jako světle stálé červené, šarlatové a karmínové pigmenty.[30][31]
Analogy a deriváty
Strukturní analogy pyrrolu zahrnují:
- Pyrrolin, částečně nasycený analog s jednou dvojnou vazbou
- Pyrrolidin, nasycený hydrogenovaný analog
Mezi deriváty pyrrolu patří indol, derivát s fúzovaným benzen prsten.
Viz také
Reference
- ^ William M. Haynes (2016). CRC Handbook of Chemistry and Physics (97. vydání). Boca Raton: CRC Press. s. 3–478. ISBN 978-1-4987-5429-3.
- ^ Loudon, Marc G. (2002). "Chemie naftalenu a aromatických heterocyklů". Organická chemie (4. vydání). New York: Oxford University Press. str. 1135–1136. ISBN 978-0-19-511999-2.
- ^ Cox, Michael; Lehninger, Albert L .; Nelson, David R. (2000). Lehningerovy principy biochemie. New York: Worth Publishers. ISBN 978-1-57259-153-0.
- ^ A b Jusélius, Jonas; Sundholm, Dage (2000). „Aromatické cesty porfinů, chlorů a bakteriochlorinů“ (PDF). Phys. Chem. Chem. Phys. 2 (10): 2145–2151. doi:10,1039 / b000260g.

- ^ Armarego, Wilfred L. F .; Chai, Christina L. L. (2003). Čištění laboratorních chemikálií (5. vydání). Elsevier. str. 346.
- ^ Runge, F. F. (1834). „Ueber einige Produkte der Steinkohlendestillation“ [U některých produktů z destilace uhlí]. Annalen der Physik und Chemie. 31: 65–78.
 Viz zejména stránky 67–68, kde Runge pojmenuje sloučeninu Pyrrol (požární olej) nebo Rothöl (červený olej).
Viz zejména stránky 67–68, kde Runge pojmenuje sloučeninu Pyrrol (požární olej) nebo Rothöl (červený olej). - ^ A b C Harreus, Albrecht Ludwig. „Pyrrol“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a22_453.
- ^ Fowles, Jefferson; Bates, Michael; Noiton, Dominique (březen 2000). „Chemické složky v cigaretách a cigaretovém kouři: priority pro snižování škod“ (PDF). Porirua, Nový Zéland: Ministerstvo zdravotnictví Nového Zélandu. 20, 49–65. Citováno 2012-09-23.
- ^ A b Lubell, W .; Saint-Cyr, D .; Dufour-Gallant, J .; Hopewell, R .; Boutard, N .; Kassem, T .; Dörr, A .; Zelli, R. (2013). "1H-Pyrroles (aktualizace 2013) ". Science of Synthesis. 2013 (1): 157–388.
- ^ Hantzsch, A. (1890). „Neue Bildungsweise von Pyrrolderivaten“ [Nové metody tvorby derivátů pyrrolu]. Berichte der Deutschen Chemischen Gesellschaft. 23: 1474–1476. doi:10.1002 / cber.189002301243.

- ^ Feist, Franz (1902). „Studien in der Furan- und Pyrrol-Gruppe“ [Studie ve skupinách furan a pyrrol]. Berichte der Deutschen Chemischen Gesellschaft. 35 (2): 1537–1544. doi:10,1002 / cber.19020350263.

- ^ Knorr, Ludwig (1884). "Synthese von Pyrrolderivaten" [Syntéza pyrrolových derivátů]. Berichte der Deutschen Chemischen Gesellschaft. 17 (2): 1635–1642. doi:10,1002 / cber.18840170220.

- ^ Knorr, L. (1886). „Synthetische Versuche mit dem Acetessigester“ [Syntetické experimenty s [ethyl] esterem kyseliny acetoctové]. Annalen der Chemie. 236 (3): 290–332. doi:10,1002 / jlac.18862360303.

- ^ Knorr, L .; Lange, H. (1902). „Ueber die Bildung von Pyrrolderivaten aus Isonitrosoketonen“ [O tvorbě derivátů pyrrolu z isonitrosketonů]. Berichte der Deutschen Chemischen Gesellschaft. 35 (3): 2998–3008. doi:10,1002 / cber.19020350392.

- ^ Corwin, Alsoph Henry (1950). „Kapitola 6: Chemie pyrrolu a jeho deriváty“. V Elderfield, Robert Cooley (ed.). Heterocyklické sloučeniny. 1. New York, NY: Wiley. str. 287.
- ^ Paal, C. (1884), „Ueber die Derivate des Acetophenonacetessigesters und des Acetonylacetessigesters“, Berichte der Deutschen Chemischen Gesellschaft, 17 (2): 2756–2767, doi:10,1002 / cber.188401702228

- ^ Knorr, Ludwig (1884), „Synthese von Furfuranderivaten aus dem Diacetbernsteinsäureester“ [Syntéza derivátů furanu z [diethyl] esteru kyseliny 2,3-diacetyljantarové], Berichte der Deutschen Chemischen Gesellschaft, 17 (2): 2863–2870, doi:10,1002 / cber.188401702254

- ^ Li, Jie Jack (2013). Heterocyklická chemie v objevu drog. New York: Wiley. ISBN 9781118354421.
- ^ Piloty, Oskare (1910). "Synthese von Pyrrolderivaten: Pyrrole aus Succinylobernsteinsäureester, Pyrrole aus Azinen" [Syntéza pyrrolových derivátů: pyrrol z diethyl sukcinyl sukcinátu, pyrrol z azinů]. Berichte der Deutschen Chemischen Gesellschaft. 43 (1): 489–498. doi:10,1002 / cber.19100430182.

- ^ Robinson, Gertrude Maud; Robinson, Robert (1918). „LIV. — Nová syntéza tetrafenylpyrrolu“. J. Chem. Soc. 113: 639–645. doi:10.1039 / CT9181300639.
- ^ A b Milgram, Benjamin C .; Eskildsen, Katrine; Richter, Steven M .; Scheidt, W. Robert; Scheidt, Karl A. (2007). „Piloty podporované mikrovlnami - Robinsonova syntéza 3,4-disubstituovaných pyrrol“ (Poznámka). J. Org. Chem. 72 (10): 3941–3944. doi:10.1021 / jo070389 +. PMC 1939979. PMID 17432915.
- ^ Vogel (1956). Praktická organická chemie (PDF). str. 837.
- ^ Walsh, Christopher T .; Garneau-Tsodikova, Sylvie; Howard-Jones, Annaleise R. (2006). „Biologická tvorba pyrrolů: logika přírody a enzymatický aparát“. Zprávy o přírodních produktech. 23 (4): 517. doi:10,1039 / b605245m.
- ^ Lehninger, Albert L .; Nelson, David L .; Cox, Michael M. (2000). Principy biochemie (3. vyd.). New York: W. H. Freeman. ISBN 1-57259-153-6..
- ^ Walsh, C. T .; Garneau-Tsodikova, S .; Howard-Jones, A. R. (2006). „Biologická tvorba pyrrolů: logika přírody a enzymatický aparát“. Nat. Prod. Rep. 23: 517–531. doi:10,1039 / b605245m.
- ^ Hu, Dennis X. (2016). „Struktura, chemická syntéza a biosyntéza přírodních produktů prodigininu“. Chemické recenze. 116: 7818–7853. doi:10.1021 / acs.chemrev.6b00024. PMC 5555159. PMID 27314508.
- ^ Ciamician, G. L .; Dennstedt, M. (1881). „Ueber die Einwirkung des Chloroforms auf die Kaliumverbindung Pyrrols“ [O reakci chloroformu s draselnou sloučeninou pyrrolu]. Berichte der Deutschen Chemischen Gesellschaft. 14: 1153–1162. doi:10.1002 / cber.188101401240.
- ^ Corwin, Alsoph Henry (1950). Elderfield, Robert Cooley (ed.). Heterocyklické sloučeniny. 1. New York, NY: Wiley. str. 309.
- ^ Mosher, H. S. (1950). Elderfield, Robert Cooley (ed.). Heterocyklické sloučeniny. 1. New York, NY: Wiley. str. 475.
- ^ „DPP pigmenty, pigmenty diketopyrrolopyrrolu, velkoobchodník s pigmenty DPP, dodavatelé diketopyrrolopyrrolových pigmentů“. barviva-pigmenty.standardcon.com.
- ^ Kaur, Matinder; Choi, Dong Hoon (2015). „Diketopyrrolopyrrol: fluorescenční sondy na bázi brilantně červeného pigmentového barviva a jejich aplikace“. Recenze chemické společnosti. 44: 58–77. doi:10.1039 / C4CS00248B.
Další čtení
- Jones, R. Jones, ed. (1990). Pyrroly. Část I. Syntéza a fyzikální a chemické aspekty pyrolového kruhu. Recueil des Travaux Chimiques des Pays-Bas. The Chemistry of Heterocyclic Compounds. 48. Chichester: John Wiley & Sons. str. 351. doi:10.1002 / recl.19911100712. ISBN 978-0-471-62753-1.
- Jolicoeur, Benoit; Chapman, Erin E .; Thompson, Alison; Lubell, William D. (2006). "Ochrana pyrrolu". Čtyřstěn. 62 (50): 11531–11563. doi:10.1016 / j.tet.2006.08.071.