Tegafur - Tegafur
 | |
 | |
| Klinické údaje | |
|---|---|
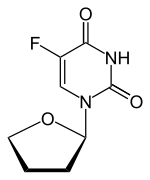
| Ostatní jména | 5-fluor-l- (oxolan-2-yl) pyrimidin-2,4-dion |
| AHFS /Drugs.com | Mezinárodní názvy drog |
| Licenční údaje | |
| Těhotenství kategorie |
|
| Trasy z správa | Ústní |
| ATC kód | |
| Právní status | |
| Právní status | |
| Farmakokinetické data | |
| Odstranění poločas rozpadu | 3,9-11 hodin |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.038.027 |
| Chemické a fyzikální údaje | |
| Vzorec | C8H9FN2Ó3 |
| Molární hmotnost | 200.169 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| | |
Tegafur je chemoterapeutické proléčivo z 5-fluorouracil (5-FU) používaný při léčbě rakoviny. Je součástí kombinovaného léku tegafur / uracil. Při metabolizaci se stává 5-FU.[1]
To bylo patentováno v roce 1967 a schváleno pro lékařské použití v roce 1972.[2]
Lékařské použití
Jako proléčivo 5-FU se používá při léčbě následujících druhů rakoviny:[3]
- Žaludek (v kombinaci s gimeracil a oteracil )
- Prsa (s uracilem)
- Žlučník
- Plíce (konkrétně adenokarcinom, obvykle s uracilem)
- Kolorektální (obvykle v kombinaci s gimeracilem a oteracilem)
- Hlava a krk
- Játra (s uracilem)[4]
- Slinivka
Často se podává v kombinaci s léky, které mění jeho biologickou dostupnost a toxicitu, jako je gimeracil, oteracil nebo uracil.[3] Tato činidla toho dosahují inhibicí enzymu dihydropyrimidin dehydrogenáza (uracil / gimeracil) nebo orotát fosforibosyltransferáza (oteracil).[3]
Nepříznivé účinky
Hlavní vedlejší účinky tegafuru jsou podobné fluorouracilu a zahrnují myelosupresi, centrální neurotoxicitu a gastrointestinální toxicitu (zejména průjem).[3] Gastrointestinální toxicita je vedlejším účinkem tegafuru omezujícím dávku.[3] Centrální neurotoxicita je častější u tegafuru než u fluorouracilu.[3]
Farmakogenetika
The dihydropyrimidin dehydrogenáza Enzym (DPD) je zodpovědný za detoxikační metabolismus fluoropyrimidinů, což je třída léků, která zahrnuje 5-fluorouracil, kapecitabin a tegafur.[5] Genetické variace v genu DPD (DPYD) může vést ke snížení nebo absenci aktivity DPD a jednotlivcům, kteří jsou heterozygotní nebo homozygotní pro tyto varianty mohou být částečné nebo úplné Nedostatek DPD; odhaduje se, že 0,2% jednotlivců má úplnou Nedostatek DPD.[5][6] Pacienti s částečným nebo úplným nedostatkem DPD mají při léčbě fluoropyrimidiny významně zvýšené riziko závažné nebo dokonce smrtelné toxicity léčiva; příklady toxicit zahrnují myelosuprese, neurotoxicita a syndrom ruka-noha.[5][6]
Mechanismus účinku
Jedná se o proléčivo 5-FU, což je thymidylát syntáza inhibitor.[3]
Farmakokinetika
Metabolizuje se na 5-FU CYP2A6.[7][8]
Interaktivní mapa cest
Kliknutím na geny, proteiny a metabolity níže můžete odkazovat na příslušné články.[§ 1]
- ^ Interaktivní mapu cest lze upravit na WikiPathways: „FluoropyrimidinActivity_WP1601“.
Viz také
Reference
- ^ El Sayed, YM; Sadée, W (1983). "Metabolická aktivace R, S-l- (tetrahydro-2-furanyl) -5-fluoruracilu (ftorafur) na 5-fluoruracil rozpustnými enzymy". Výzkum rakoviny. 43 (9): 4039–44. PMID 6409396.
- ^ Fischer, Jnos; Ganellin, C. Robin (2006). Analogový objev drog. John Wiley & Sons. p. 511. ISBN 9783527607495.
- ^ A b C d E F G Sweetman, S, ed. (14. listopadu 2011). „Martindale: The Complete Drug Reference“. Pharmaceutical Press. Citováno 12. února 2014.
- ^ Ishikawa, T (14. května 2008). "Chemoterapie s enterosolventním tegafurem / uracilem pro pokročilý hepatocelulární karcinom". World Journal of Gastroenterology. 14 (18): 2797–2801. doi:10,3748 / wjg.14.2797. PMC 2710718. PMID 18473401.
- ^ A b C Caudle, KE; Thorn, CF; Klein, TE; Swen, JJ; McLeod, HL; Diasio, RB; Schwab, M (prosinec 2013). „Pokyny pro konsorcium pro klinickou farmakogenetiku pro dávkování genotypu dihydropyrimidin dehydrogenázy a dávkování fluoropyrimidinu“. Klinická farmakologie a terapeutika. 94 (6): 640–5. doi:10.1038 / clpt.2013.172. PMC 3831181. PMID 23988873.
- ^ A b Amstutz, U; Froehlich, TK; Largiadèr, ČR (září 2011). „Gen dihydropyrimidin dehydrogenázy jako hlavní prediktor závažné toxicity 5-fluorouracilu“. Farmakogenomika. 12 (9): 1321–36. doi:10,2217 / str. 11,72. PMID 21919607.
- ^ Nakayama, T; Noguchi, S (leden 2010). „Terapeutická užitečnost pooperační adjuvantní chemoterapie přípravkem Tegafur-Uracil (UFT) u pacientů s rakovinou prsu: zaměření na výsledky klinických studií v Japonsku“. Onkolog. 15 (1): 26–36. doi:10.1634 / theoncologist.2009-0255. PMC 3227888. PMID 20080863.
- ^ Matt P, van Zwieten-Boot B, Calvo Rojas G, Ter Hofstede H, Garcia-Carbonero R, Camarero J, Abadie E, Pignatti F (říjen 2011). „Revize Evropské agentury pro léčivé přípravky týkající se přípravku Tegafur / Gimeracil / Oteracil (Teysuno ™) pro léčbu pokročilého karcinomu žaludku, pokud se podává v kombinaci s cisplatinou: souhrn vědeckého hodnocení Výboru pro humánní léčivé přípravky (CHMP)“. Onkolog. 16 (10): 1451–1457. doi:10.1634 / theoncologist.2011-0224. PMC 3228070. PMID 21963999.

