Hyponitrit sodný - Sodium hyponitrite
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) |
|
| ChemSpider | |
PubChem CID | |
| |
| |
| Vlastnosti | |
| Na2N2Ó2 | |
| Molární hmotnost | 105,99 g / mol |
| Vzhled | bezbarvé krystaly |
| Hustota | 2,466 g / cm3 |
| Bod tání | 100 ° C (212 ° F; 373 K) |
| Bod varu | 335 ° C (635 ° F; 608 K) se rozkládá |
| rozpustný | |
| Rozpustnost | nerozpustný v ethanol |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
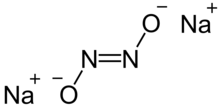
Hyponitrit sodný je pevná látka iontová sloučenina se vzorcem Na
2N
2Ó
2 nebo (Na+
)2[ZAPNUTO = NE]2−.[1]
Existují cis a trans formy hyponitrit ion N
2Ó2−
2. The trans forma je častější, ale cis lze získat také formu a je reaktivnější než trans formulář.[1][2]
Trans izomer
The trans isomer je bezbarvý a rozpustný ve vodě a nerozpustný v ethanol a éter.[3][4]
Příprava
Hyponitrit sodný (trans) běžně připravuje snížení z dusitan sodný s amalgám sodný.[5][6][7]
- 2 NaNO2 + 4 Na (Hg) + 2 H2O → Na2N2Ó2 + 4 NaOH + 4 Hg
Hyponitrit sodný (trans) připravil v roce 1927 A. W. Scott reakcí alkyl dusitany, hydroxylamoniumchlorid, a ethoxid sodný[4][8]
- RONO + NH2OH + 2 EtONa → Na2N2Ó2 + ROH + 2 EtOH
Dřívější metoda, publikoval D. Mendenhall v roce 1974 reagoval plynně oxid dusnatý (NE) s sodík kov dovnitř 1,2-dimethoxyethan, toluen, a benzofenon. Sůl byla poté extrahována vodou.[9] Metoda byla později upravena pro použití pyridin[Citace je zapotřebí ].
Zahrnuty i další metody oxidace koncentrovaného roztoku hydroxylamin s dusitanem sodným v alkalickém prostředí[Citace je zapotřebí ]; nebo elektrolýza dusitanu sodného.[10]
Hydráty
Různé hydratuje Na
2N
2Ó
2(H
2Ó)X z trans byly hlášeny isomery s X včetně 2, 3,5, 4, 5, 6, 7, 8 a 9;[11][3][12] ale existuje nějaký spor.[13]
Hydratační voda se zdá být spíše zachycena v krystalové mřížce, než koordinována s ionty.[13] Bezvodou látku lze získat sušením hydrátů oxid fosforečný a poté je zahřát na 120 ° C.[13]
Reakce
Hyponitrit sodný (trans) v roztoku se rozloží oxid uhličitý CO
2 ze vzduchu do formy uhličitan sodný.[14]
Kapalný N2Ó4 oxiduje hyponitrit sodný (trans), čímž se získá sodík peroxohyponitrit Na2+
2[ON = NOO]2−).[15][1]
Cis izomer
The cis izomer hyponitritu sodného je bílá krystalická pevná látka, nerozpustná v aprotický rozpouštědla a (na rozdíl od trans izomer) rozložený vodou a jinými protický rozpouštědla.[2]
Příprava
The cis isomer z lze připravit průchodem oxid dusnatý (NE) prostřednictvím řešení sodík kov v kapalině amoniak při -50 ° C.[1]
The cis izomer také získal v roce 1996 C. Feldmann a M. Jansen ohřevem oxid sodný Na
2Ó s 77 kPa z oxid dusičitý N
2Ó (smějící se plyn) v uzavřené zkumavce při 360 ° C po dobu 2 hodin. Tato dvě činidla se spojila, čímž se získala sloučenina cis hyponitrit kvantitativně jako bílé mikrokrystaly.[8][2]
Vlastnosti a reakce
Bezvodý cis sůl je stabilní až do 325 ° C, pokud je nepřiměřená dusík a sodná sůl ortonitritu:[2]
- 3 Na
2N
2Ó
2 → 2 Na
3Ó(NE
2) + 2 N
2
Je obecně reaktivnější než trans izomer.[1]
Viz také
Reference
- ^ A b C d E Egon Wiberg, Arnold Frederick Holleman (2001) Anorganická chemie, Elsevier ISBN 0-12-352651-5
- ^ A b C d Claus Feldmann, Martin Jansen (1996), "cis-Sodium Hyponitrite - New Preparative Route and a Crystal Structure Analysis. “Angewandte Chemie International Edition v angličtině, svazek 35, číslo 15, strany 1728–1730. doi:10.1002 / anie.199617281
- ^ A b Trambaklal Mohanlal Oza, Rajnikant Hariprasad Thaker (1955), „Tepelný rozklad stříbrného hyponitritu“. Journal of the American Chemical Society, svazek 77, číslo 19, strany 4976–4980. doi:10.1021 / ja01624a007
- ^ A b A. W. Scott (1927), „Hyponitrit sodný“. J. Am. Chem. Soc., ročník = 49, číslo 4, stránky = 986–987. doi:10.1021 / ja01403a502
- ^ Addison, C. C .; Gamlen G. A .; Thompson, R. (1952). „70. Ultrafialové absorpční spektrum hyponitritu sodného a α-oxyhyponitritu sodného: analýza směsí s dusitanem a dusičnanem sodným.“. J. Chem. Soc.: 338. doi:10.1039 / jr9520000338.
- ^ Neumann, R. C., Jr. Bussey, R. J. (1970). "Vysokotlaké studie. V. Aktivační objemy pro kombinaci a difúzi geminátových terc-butoxy radikálů". J. Am. Chem. Soc. 92 (8): 2440. doi:10.1021 / ja00711a039.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ A b Catherine E. Housecroft; Alan G. Sharpe (2008). "Kapitola 15: Skupina 15 prvků". Anorganická chemie (3. vyd.). Pearson. p. 468. ISBN 978-0-13-175553-6.
- ^ G. David Mendenhall (1974), „Pohodlná syntéza hyponitritu stříbra“. Journal of the American Chemical Society, svazek 96, číslo 15, strana 5000. doi:10.1021 / ja00822a054
- ^ Polydoropoulos, C. N. Chem. Ind. (London) 1963, 1686 a tam uvedené odkazy.
- ^ James Riddick Partington a Chandulal Chhotalal Shah (1931), „Vyšetřování hyponitritů. Část I. Hyponitrit sodný: příprava a vlastnosti“. Journal of the Chemical Society (Resumed), paper CCLXXXII, strany 2071-2080. doi:10.1039 / JR9310002071
- ^ C.N. Polydoropoulos, S.D. Voliotis (1967), „hexahydrát hyponitritu sodného“. Journal of Anorganic and Nuclear Chemistry, svazek 29, číslo 12, strany 2899–2901. doi:10.1016/0022-1902(67)80121-0
- ^ A b C Gary L. Stucky, Jack L. Lambert, R. Dean Dragsdorf (1969), „Hydráty hyponitritu sodného“. Journal of Anorganic and Nuclear Chemistry, svazek 31, číslo 1, strany 29–32 doi:10.1016/0022-1902(69)80050-3
- ^ Charlotte N. Conner, Caroline E. Donald, Martin N. Hughes, Christina Sami (1989), „Molární absorpce hyponitritu sodného“. Mnohostěn, svazek 8, číslo 21, strany 2621-2622. doi:10.1016 / S0277-5387 (00) 81166-3
- ^ M. N. Hughes a H. G. Nicklin (1969), „Působení oxidu dusného na hyponitrit sodný“. Journal of the Chemical Society D: Chemical Communications, svazek 1969, číslo 2, strana 80a. doi:10.1039 / C2969000080A
