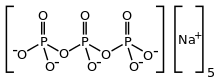
Trifosforečnan sodný - Sodium triphosphate
 | |
| Jména | |
|---|---|
| Název IUPAC Trifosforečnan sodný | |
| Ostatní jména tripolyfosforečnan sodný, polygon, STPP | |
| Identifikátory | |
| Informační karta ECHA | 100.028.944 |
| Číslo E. | E451 (zahušťovadla, ...) |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| Vlastnosti | |
| Na5P3Ó10 | |
| Molární hmotnost | 367,864 g / mol |
| Vzhled | bílý prášek |
| Hustota | 2,52 g / cm3 |
| Bod tání | 622 ° C (1152 ° F; 895 K) |
| 14,5 g / 100 ml (25 ° C) | |
| Nebezpečí | |
| Bezpečnostní list | ICSC 1469 |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | Nehořlavé |
| Související sloučeniny | |
jiný anionty | Fosforečnan sodný Pyrofosforečnan sodný Hexametafosforečnan sodný |
jiný kationty | Pentafraselný trifosfát |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Trifosforečnan sodný (STP) tripolyfosforečnan sodný (STPP) nebo tripolyfosfát (TPP),[1]) je anorganická sloučenina se vzorcem Na5P3Ó10. To je sodík sůl polyfosfát penta-anion, což je konjugovaná báze kyselina trifosforečná. Vyrábí se ve velkém měřítku jako součást mnoha domácích a průmyslových výrobků, zejména detergentů. Problémy životního prostředí spojené s eutrofizace jsou přičítány jeho širokému použití.[2]
Příprava a vlastnosti
Tripolyfosforečnan sodný se vyrábí zahříváním stechiometrické směsi fosforečnan sodný, Na2HPO4, a fosforečnan sodný, NaH2PO4za pečlivě kontrolovaných podmínek.[2]
- 2 Na2HPO4 + NaH2PO4 → Na5P3Ó10 + 2 H2Ó
Tímto způsobem se ročně vyrobí přibližně 2 miliony tun.[3]
STPP je bezbarvá sůl, která existuje jak v bezvodý formě a jako hexahydrát. Anion lze popsat jako pentaniontový řetězec [O.3POP (O)2OPO3]5−.[4][5] Je známo mnoho příbuzných di-, tri- a polyfosforečnanů, včetně cyklického trifosfátu P3Ó93−. Silně se váže na kovové kationty, protože a bidentate a trojzubec chelatační činidlo.

Použití
V pracích prostředcích
Většina STPP se spotřebovává jako součást reklamy čistící prostředky. Slouží jako „stavitel“, průmyslový žargon pro změkčovač vody. V tvrdé vodě (voda, která obsahuje vysoké koncentrace Mg2+ a Ca2+), prací prostředky jsou deaktivovány. Být vysoce nabitý chelatační činidlo, TPP5− váže na dikace pevně a brání jim v interferenci se sulfonátovým detergentem.[3]
Potravinářské aplikace
STPP je konzervační pro mořské plody, maso, drůbež a krmiva pro zvířata.[3] Ve výrobě potravin je to běžné jako Číslo E. E451. V potravinách se STPP používá jako emulgátor a udržovat vlhkost. Mnoho vlád reguluje povolené množství v potravinách, protože to může výrazně zvýšit zejména prodejní váhu mořských plodů. Spojené státy Úřad pro kontrolu potravin a léčiv uvádí STPP jako "obecně uznáván jako bezpečný."[Citace je zapotřebí ]
Jiná použití
Mezi další použití (stovky tisíc tun / rok) patří keramika (snížit viskozitu glazur do určité meze), vyčinění kůže (jako maskovací prostředek a syntetické činidlo - SYNTAN), protispékavé látky, nastavení retardérů, retardéry hoření, papír, antikorozní pigmenty, textil, guma výroba, kvašení, nemrznoucí směs."[3] TPP se používá jako polyanionové síťovadlo na bázi polysacharidů dodávka léků.[6] Zubní pasta.[7][8][9][10][11][12][13]
Zdravé efekty
Vysoká koncentrace fosfátů v séru byla identifikována jako prediktor kardiovaskulárních příhod a úmrtnosti. Zatímco fosfát je přítomen v těle a potravě v organických formách, anorganické formy fosfátu, jako je trifosforečnan sodný, jsou snadno adsorbovány a mohou vést ke zvýšeným hladinám fosfátů v séru.[14] Soli polyfosfátových aniontů jsou mírně dráždivé pro pokožku a sliznice, protože jsou mírně zásadité.[1]
Účinky na životní prostředí
Protože je to velmi rozpustné ve vodě, STPP není významně odstraněn čištění odpadních vod. STPP hydrolyzuje na fosfát, který je asimilován do přirozeného fosforový cyklus. Čisticí prostředky obsahující fosfor přispívají k eutrofizace mnoha sladkých vod.[1]

Viz také
- Trimetafosforečnan sodný cyklický trifosfát.
Viz také
Reference
- ^ A b C Komplexotvorné látky, Environmentální a zdravotní hodnocení látek v detergentech pro domácnost a kosmetických detergentech, Dánská agentura pro ochranu životního prostředí, Zpřístupněno 15. 7. 2008
- ^ A b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ A b C d Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). "Kyselina fosforečná a fosfáty". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.a19_465.pub3. ISBN 978-3527306732.
- ^ Corbridge, D. E. C. (1. března 1960). „Krystalová struktura trifosforečnanu sodného, Na5P3Ó10, fáze I ". Acta Crystallographica. 13 (3): 263–269. doi:10.1107 / S0365110X60000583.
- ^ Davies, D. R.; Corbridge, D. E. C. (1. května 1958). „Krystalová struktura trifosforečnanu sodného, Na5P3Ó10, fáze II “. Acta Crystallographica. 11 (5): 315–319. doi:10.1107 / S0365110X58000876.
- ^ Calvo, P .; Remuñán ‐ López, C .; Vila-Jato, J.L .; Alonso, M. J. (3. ledna 1997). "Nové hydrofilní chitosan-polyethylenoxidové nanočástice jako nosiče proteinů". Journal of Applied Polymer Science. 63 (1): 125–132. doi:10.1002 / (SICI) 1097-4628 (19970103) 63: 1 <125 :: AID-APP13> 3.0.CO; 2-4.
- ^ Saxton, C. A .; Ouderaa, F. J. G. (leden 1989). "Účinek prostředku na čištění zubů obsahující citrát zinečnatý a triclosan na rozvoj zánětu dásní". Journal of Periodontal Research. 24 (1): 75–80. doi:10.1111 / j.1600-0765.1989.tb00860.x. PMID 2524573.
- ^ Lobene, RR; Weatherford, T; Ross, NM; Lamm, RA; Menaker, L (1986). "Upravený gingivální index pro použití v klinických studiích". Klinické preventivní zubní lékařství. 8 (1): 3–6. PMID 3485495.
- ^ Lobene, RR; Soparkar, PM; Newman, MB (1982). „Použití zubní nitě. Účinek na zubní plak a zánět dásní“. Klinické preventivní zubní lékařství. 4 (1): 5–8. PMID 6980082.
- ^ Mankodi, Suru; Bartizek, Robert D .; Leslie Winston, J .; Biesbrock, Aaron R .; McClanahan, Stephen F .; On, Tao (leden 2005). "Účinnost anti-gingivitidy stabilizovaného 0,454% fluoridu cínatého / hexametafosforečnanu sodného na zuby. Kontrolovaná šestiměsíční klinická studie". Journal of Clinical Periodontology. 32 (1): 75–80. doi:10.1111 / j.1600-051X.2004.00639.x. PMID 15642062.
- ^ Mankodi, S; Petrone, DM; Battista, G; Petrone, ME; Chaknis, P; DeVizio, W; Volpe, AR; Proskin, HM (1997). „Klinická účinnost optimalizované zubní pasty na bázi fluoridu cínatého, část 2: Šestiměsíční klinická studie plaku / gingivitidy, severovýchod USA“. Kompendium dalšího vzdělávání ve stomatologii. 18 Spec No: 10–5. PMID 12206029.
- ^ Mallatt, Mark; Mankodi, Suru; Bauroth, Karen; Bsoul, Samer A .; Bartizek, Robert D .; On, Tao (září 2007). „Kontrolovaná šestiměsíční klinická studie ke studiu účinků zubního pasty s obsahem fluoridu cínatého na gingivitidu“. Journal of Clinical Periodontology. 34 (9): 762–767. doi:10.1111 / j.1600-051X.2007.01109.x. PMID 17645550.
- ^ Lang, Niklaus P. (1990). "Epidemiologie periodontálního onemocnění". Archivy orální biologie. 35: S9 – S14. doi:10.1016 / 0003-9969 (90) 90125-t. PMID 2088238.
- ^ Ritz, Eberhard; Hahn, Kai; Ketteler, Markus; Kuhlmann, Martin K; Mann, Johannes (2012). „Fosfátové přísady v potravinách - zdravotní riziko“. Deutsches Ärzteblatt International. 109 (4): 49–55. doi:10.3238 / arztebl.2012.0049. PMC 3278747. PMID 22334826.

