Fosfid sodný - Sodium phosphide
 | |
| Jména | |
|---|---|
| Ostatní jména fosfid sodný, běžný trisodiofosfin | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.031.834 |
| Číslo ES |
|
PubChem CID | |
| |
| |
| Vlastnosti | |
| Na3P | |
| Molární hmotnost | 99,943 g / mol |
| Vzhled | červené krystaly |
| Hustota | 1,74 g / cm3 |
| Bod tání | 650 ° C (1202 ° F; 923 K) |
| hydrolýza | |
| Rozpustnost | nerozpustný v kapalném CO2 |
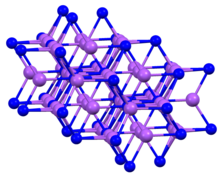
| Struktura | |
| šestihranný a = 4,9512 Å c = 8,7874 Á | |
| kolem P 5 v blízkosti sousedů, trigonální bipyramid [1] | |
| Související sloučeniny | |
jiný anionty | chlorid sodný nitrid sodný |
jiný kationty | fosfid hlinitý fosfid lithný fosfid draselný |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Fosfid sodný je anorganická sloučenina se vzorcem Na3P. Je to černá pevná látka. To je často popisováno jako Na+ sůl P3− anion.[2] Na3P je zdrojem vysoce reaktivního fosfidového aniontu. To by nemělo být zaměňováno s fosforečnan sodný, Na3PO4.
Kromě Na3P, pět dalších binárních složení sodíku a fosforu je známo: NaP, Na3P7, Na3P11, NaP7a NaP15.[3]
Struktura a vlastnosti
Sloučenina krystalizuje do šestiúhelníkového motivu, často nazývaného arsenid sodný struktura.[4] Jako K.3P, pevný Na3P obsahuje pentacoordinate P center.[1]
Příprava
První příprava Na3P byl poprvé zaznamenán v polovině 19. století. Francouzský výzkumník, Alexandre Baudrimont připravený fosfid sodný zpracováním roztaveného sodíku s chlorid fosforečný.[5]
Mnoho různých cest do Na3P byly popsány. Na základě své hořlavosti a toxicity Na3P (a související soli) se často připravuje a používá in situ. Bílý fosfor je redukován slitinou sodíku a draslíku:[6]
- P4 + 12 Na → 4 Na3P
Fosfor reaguje se sodíkem v autoklávu při 150 ° C po dobu 5 hodin za vzniku Na3P.[7]
Alternativně může být reakce provedena za normálních tlaků, ale za použití teplotního gradientu pro vytvoření netěkavého NaXP fáze (x <3), které pak dále reagují se sodíkem.[8] V některých případech je prostředek pro přenos elektronů, jako je například naftalen, se používá. V takových aplikacích tvoří naftalen rozpustný naftalenid sodný, což snižuje fosfor.[9]
Použití
Fosfid sodný je zdrojem vysoce reaktivního fosfidového aniontu. Materiál je nerozpustný ve všech rozpouštědlech, ale reaguje jako suspenze s kyselinami a souvisejícími elektrofily za vzniku derivátů typu PM3:[6]
- Na3P + 3 E+ → E3P (E = H, Me3Si)
The trimethylsilylový derivát je těkavý (teplota varu 30-35 ° C @ 0,001 mm Hg) a rozpustný. Slouží jako rozpustný ekvivalent „P3−".
Fosfid india, polovodič vznikne zpracováním in situ generovaný "fosfid sodný" s chlorid indný v horku N, N ‘-dimethylformamid jako rozpouštědlo. V tomto procesu je fosfidové činidlo generováno z kovového sodíku a bílého fosforu, načež okamžitě reaguje s indiovou solí:[10]
- Na3P + InCl3 → InP + 3NaCl
Fosfid sodný se také komerčně používá jako a katalyzátor ve spojení s fosfidem zinečnatým a fosfid hlinitý pro polymer Výroba. Když Na3P se odstraní z ternárního katalyzátoru polymerizace z propylen a 4-methyl-l-penten není účinný.[11][Citace je zapotřebí ]

Opatření
Fosfid sodný je vysoce nebezpečný a uvolňuje toxický fosfin při hydrolýze je proces tak exotermický, že vznikají požáry. The USDOT zakázal přepravu Na3P na osobních letadlech, nákladních letadlech a vlacích kvůli možnému požáru a toxickým rizikům.[12]
Reference
- ^ A b Dong, Y; Disalvo, F.J (2005). „Znovuzkoumání Na3P na základě monokrystalických dat ". Acta Crystallographica oddíl E. 61 (11): i223 – i224. doi:10.1107 / S1600536805031168.
- ^ Yunle, G; Ventilátor, G; Yiate, Q; Huagui, Z; Ziping, Y (2002). "Solvotermální syntéza ultrajemného fosfidu železa". Bulletin materiálového výzkumu. 37 (6): 1101–1106. doi:10.1016 / S0025-5408 (02) 00749-3.
- ^ Anorganická chemie, Egon Wiberg, Arnold Frederick Holleman Elsevier 2001 ISBN 0-12-352651-5
- ^ Beister, H.J .; Syassen, K .; Klein, J. "Fázový přechod Na3Jako pod tlakem " Zeitschrift für Naturforschung B: Chemical Sciences 1990, svazek 45, str. 1388-str. 1392. doi:10.1515 / znb-1990-1007
- ^ Baudrimont (1864). Annales de chimie et de physique. 2: 13. Chybějící nebo prázdný
| název =(Pomoc) - ^ A b Becker, Gerd; Schmidt, Helmut; Uhl, Gudrun (1990). Tris (trimethylsilyl) fosfin a lithium bis (trimethylsilyl) fosfid. Bis- (tetrahydrofuran). Anorganické syntézy. 27. 243–249. doi:10.1002 / 9780470132586.ch48. ISBN 9780470132586.
- ^ Xie, Y; Su, H; Li, B; Qian, Y (2000). "Solvotermální příprava nanorodů fosfidu cínu". Bulletin materiálového výzkumu. 35 (5): 675–680. doi:10.1016 / S0025-5408 (00) 00263-4.
- ^ Jarvis, R. F .; Jacubinas, R. M .; Kaner, R. B. (2000). „Samorozmnožovací metathesové cesty k metabolizovatelným fosfidům skupiny 4“. Anorganická chemie. 39 (15): 3243–3246. doi:10,1021 / ic000057m. PMID 11196860.
- ^ Peterson, D. J. 1967. US patent č. 3 397 039.
- ^ Khanna, P.K; Eum, M.-S; Jun, K.-W; Baeg, J.-0; Seok, S. I (2003). "Nová syntéza nanočástic fosfidu india". Materiály Dopisy. 57 (30): 4617–4621. doi:10.1016 / S0167-577X (03) 00371-9.
- ^ Atarashi, Y .; Fukumoto, O. Japonský patent č. JP 42 006 269.
- ^ Kenneth L. Barbalace. „Fosfid sodný“. Chemická databáze.
