Metaboritan sodný - Sodium metaborate
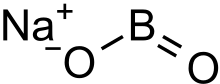 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
| Informační karta ECHA | 100.028.992 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| NaBO2 | |
| Molární hmotnost | 65,80 g / mol |
| Vzhled | bezbarvé krystaly |
| Zápach | bez zápachu |
| Hustota | 2,464 g / ml (bezvodý)[1] |
| Bod tání | 966 ° C (1771 ° F; 1239 K) |
| Bod varu | 1,434[2] ° C (2613 ° F; 1707 K) |
| 16,4 g / 100 ml (0 ° C) 28,2 g / 100 ml (25 ° C) 125,2 g / 100 ml (100 ° C) | |
| Rozpustnost | nerozpustný v éter, ethanol |
| Struktura | |
| trigonální | |
| Termochemie | |
Tepelná kapacita (C) | 65,94 J / mol K. |
Std molární entropie (S | 73,39 J / mol K. |
Std entalpie of formace (ΔFH⦵298) | -1059 kJ / mol |
| Nebezpečí | |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 2330 mg / kg (potkan, orální) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Metaboritan sodný je bezbarvá pevná látka chemická sloučenina z sodík, bór, a kyslík s vzorec NaBO
2.[3] Vzorec lze zapsat také jako Na
2Ó·B
2Ó
3 zvýraznit vztah k hlavnímu oxidy sodíku a boru.[2]
Struktura
V hexagonální krystalizuje pevný bezvodý metaboritan sodný vesmírná skupina. Ve skutečnosti obsahuje trimerní anion [B
3Ó
6]3−
.[1] Šest kyslík atomy jsou rovnoměrně rozděleny do dvou odlišných strukturních míst s různými B – O délky vazby (asi 128 a 143 odpoledne ).[4]
Hydráty a rozpustnost
Následující hydratuje krystalizovat z roztoků správného složení v různých teplotních rozsazích:[5]
- tetrahydrát NaBO
2·4H
2Ó od -6 do 53,6 ° C - dihydrát NaBO
2·2H
2Ó od 53,6 ° C do 105 ° C - hemihydrát NaBO
2·0.5H
2Ó od 105 ° C do bodu varu.
První zprávy o monohydrátu NaBO
2·H
2Ó nebyly potvrzeny.[5]
Bezvodou sůl lze připravit z tetraboritanu zahřátím na 270 ° C ve vakuu.[6]
Příprava
Metaboritan sodný se připravuje fúzí uhličitan sodný a oxid boritý B
2Ó
3[1] nebo borax Na
2B
4Ó
7. Dalším způsobem, jak sloučeninu vytvořit, je fúze borax s hydroxid sodný při 700 ° C:
- B
2Ó
3 + 2 NaOH → 2 NaBO
2 + 2 H
2Ó
Teplota varu metaboritanu sodného (1434 ° C) je nižší než teplota varu oxidu boritého (1860 ° C) a boraxu (1575 ° C). Ve skutečnosti, zatímco metaboritan vaří beze změny složení, borax vydává páru metaboritanu sodného s malým přebytkem oxidu sodného Na
2Ó.[2]
Reakce
Elektrochemická přeměna na borax
Elektrolýza koncentrovaného roztoku 20% NaBO
2·4H
2Ó s anexová membrána a inertní anoda (např zlato, palladium nebo bórem dopovaný diamant ) převádí anion metaborátu na tetraboritan B
4Ó2−
7a sodná sůl pozdější (borax ) se vysráží jako bílý prášek.[7]
- BO2−
2 + 2HO−
→ B
4Ó2−
7 + H
2Ó + 4 e−
Redukce na borohydrid sodný
Metaboritan sodný je také vedlejším produktem hydrolýzy borohydrid sodný NaBH
4, navrhováno vodík skladovací materiál pro vozidla na vodíkový pohon to je bezpečnější (stabilní na suchém vzduchu) a efektivnější z hlediska hmotnosti než většina ostatních alternativ.[7][8] Reakce je
- NaBH
4 + 2 H
2Ó → NaBO
2 + 4 H
2
a vyžaduje katalyzátor.
Aby byl ekonomický, vyžadoval by tento přístup levný a efektivní způsob recyklace metaboritanu na borohydrid. Bylo studováno několik metod, například reakce s různými snižování prostředky při vysokých teplotách a tlaku,[7] nebo s hydrid hořečnatý MgH
2 podle kulové frézování při teplotě místnosti, následovaná extrakcí NaBH
4 s isopropylamin.[8][6]
- NaBO
2 + 2 MgH
2 → NaBH
4 + 2 MgO
Další alternativou, která byla zvažována, je elektrolytická redukce koncentrovaného roztoku metaboritanu sodného,[6] a to
- BO2−
2 + 6 H
2Ó + 8 e− → BH−
4 + 8 HO−
Tato metoda však není efektivní, protože soutěží se snížením hydroxid, 4 HO−
→ 2 H
2Ó + Ó
2 + 4 e−
Konverze na alkoxidy sodné
Bezvodý metaboritan sodný refluxované s methanolu poskytuje odpovídající sodík methoxyborát:[9]
- Na+
[BO
2]−
+ 4 CH
3ACH → Na+
[B (OCH
3)
4]−
+ 2 H
2Ó
Analogická reakce s ethanol výnosy ethoxyborát.[9]
Použití
Metaboritan sodný se používá při výrobě borosilikátové brýle. Je také součástí herbicidy a nemrznoucí směs produkty.
Viz také
Reference
- ^ A b C Ssu-Mien Fang (1938): „Krystalová struktura metaboritanu sodného Na
3(B
3Ó
6)". Zeitschrift für Kristallographie - Crystalline Materials, svazek 99, číslo 1-6, stránky 1-8, doi:10.1524 / zkri.1938.99.1.1 - ^ A b C Sandford S. Cole a Nelson W. Taylor, „Systém Na
2Ó-B
2Ó
3„IV: Tlak par oxidu boritého, metaboritanu sodného a hydrogenuhličitanu sodného mezi 1150 ° C a 1400 ° C“. Journal of the American Ceramic Society, svazek 18, číslo 1-12, strany 82-85 doi:10.1111 / j.1151-2916.1935.tb19358.x - ^ Metaboritan sodný v Chemisteru
- ^ M. Marezio, H. A. Plettinger a W. H. Zachariasen (1963): „Délky vazeb ve struktuře metaboritanu sodného“, Acta Crystallographica, svazek 16, strany 594-595. doi:10.1107 / S0365110X63001596
- ^ A b Nelson P. Nies a Richard W. Hulbert (1967): "Izotermy rozpustnosti v systému oxid sodný - oxid boritý - voda. Revidované křivky teploty a rozpustnosti kyseliny borité, boraxu, pentaborátu sodného a metaborátu sodného". Journal of Chemical and Engineering Data, svazek 12, číslo 3, strany 303-313. doi:10.1021 / je60034a005
- ^ A b C Lingyan Kong, Xinyu Cui, Huazi Jin, Jie Wu, Hao Du a Tianying Xiong (2009): „Mechanochemická syntéza borohydridu sodného recyklací metaborátu sodného“. Energetická paliva, svazek 23, číslo 10, strany 5049-5054. doi:10.1021 / ef900619y
- ^ A b C Eun Hee Park, Seong Uk Jeong, Un Ho Jung, Sung Hyun Kim, Jaeyoung Lee, Suk Woo Nam, Tae Hoon Lim, Young Jun Park, Yong Ho Yuc (2007): „Recyklace metaboritanu sodného na borax“. International Journal of Hydrogen Energy, svazek 32, číslo 14, strany 2982-2987. doi:10.1016 / j.ijhydene.2007.03.029
- ^ A b Z. P. Li, B. H. Liu. K. Arai, N. Morigazaki, S. Suda (2003): „Chraňte sloučeniny v systémech skladování vodíku“. Journal of Alloys and Compounds, svazky 356–357, strany 469-474. doi:10.1016 / S0925-8388 (02) 01241-0
- ^ A b T. Kemmitt a G. J. Gainsford (2009): „Regenerace borohydridu sodného z metaborátu sodného a izolace meziproduktů“ International Journal of Hydrogen Energy, svazek 34, číslo 14, strany 5726-5731. doi:10.1016 / j.ijhydene.2009.05.108
| Tento anorganické sloučenina –Příbuzný článek je a pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |

