Sulfid fosforečný - Phosphorus pentasulfide
 | |
 | |
| Jména | |
|---|---|
| Ostatní jména sulfid fosforitý fosfid síry persulfid fosforitý difosforečnan pentasulfid tetraposforečný dekasulfid dekasulfid fosforečný | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.013.858 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| P2S5 nebo dimer P4S10 | |
| Molární hmotnost | 222,27 g mol |
| Vzhled | zelenošedá až žlutá pevná látka[1] |
| Zápach | shnilá vejce[1] |
| Hustota | 2,09 g / cm3 |
| Bod tání | 288 ° C (550 ° F; 561 K) |
| Bod varu | 514 ° C (957 ° F; 787 K) |
| hydrolyzuje | |
| Rozpustnost v jiných rozpouštědlech | 0,222 g / 100 g CS2 (při 17 ° C) Nerozpustný v C6H6 Nerozpustný v horkém xylenu Nerozpustný v horkém stavu anisol. |
| Tlak páry | 1 mmHg (300 ° C)[1] |
| Struktura | |
| triclinic, aP28 | |
| P-1, č. 2 | |
| Td | |
| Nebezpečí | |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 389 mg / kg (orálně, potkan)[2] |
| NIOSH (Limity expozice USA zdraví): | |
PEL (Dovolený) | TWA 1 mg / m3[1] |
REL (Doporučeno) | TWA 1 mg / m3 ST 3 mg / m3[1] |
IDLH (Okamžité nebezpečí) | 250 mg / m3[1] |
| Související sloučeniny | |
Související sloučeniny | P4S3 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Sulfid fosforečný je anorganická sloučenina se vzorcem P2S5 nebo dimer P4S10. Tato žlutá pevná látka je jednou ze dvou sulfidy fosforu obchodní hodnoty. Vzorky často vypadají zelenavě šedě kvůli nečistotám. Je rozpustný v sirouhlíku, ale reaguje s mnoha dalšími rozpouštědly, jako jsou alkoholy, DMSO a DMF.[3]
Struktura a syntéza
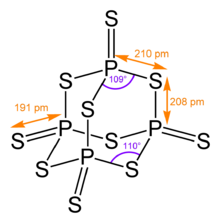
Své čtyřboká molekulární struktura je podobná struktuře adamantan a téměř totožná se strukturou oxid fosforečný.[4]
Sulfid fosforečný se získá reakcí kapaliny bílý fosfor (Str4) s síra nad 300 ° C. První syntéza P4S10 podle Berzelius v roce 1843 [5][6] bylo touto metodou. Alternativně P4S10 mohou být vytvořeny reakcí elementární síry nebo pyrit, FeS2, s ferofosfor, surová forma Fe2P (vedlejší produkt P4 výroba od fosfátová hornina ):
- 4 Fe2P + 18 S → P4S10 + 8 FeS
- 4 Fe2P + 18 FeS2 + teplo → P4S10 + 26 FeS
Aplikace
Přibližně 150 000 tun P.4S10 jsou vyráběny ročně. Sloučenina se převádí hlavně na jiné deriváty pro použití jako mazací přísady, jako je dithiofosfáty zinečnaté. Je široce používán při výrobě dithiofosforečnan sodný pro aplikace jako flotační činidlo v koncentraci molybdenitových minerálů. Používá se také při výrobě pesticidů, jako jsou Parathion a Malathion.[7] Je to také složka nějaké amorfní pevné látky elektrolyty (např. Li2S-P2S5) pro některé typy lithiové baterie.
Sulfid fosforečný je a dvojí použití materiál, pro výrobu časných insekticidů, jako je Amiton, a také pro výrobu souvisejících VX nervové látky.
Reaktivita
V důsledku hydrolýzy vzdušnou vlhkostí, P4S10 se vyvíjí H2S, tedy P4S10 je spojena se zápachem shnilého vejce. Kromě H2S, hydrolýza z P.4S10 nakonec dá kyselina fosforečná:
- P4S10 + 16 hodin2O → 4 H3PO4 + 10 hodin2S
Jiné mírné nukleofily reagovat s P4S10, počítaje v to alkoholy a aminy. Aromatické sloučeniny, jako je anisol, ferrocen a 1-methoxynaftalen reagovat na formu 1,3,2,4-dithiadifosfethan 2,4-disulfidy jako Lawessonovo činidlo.
P4S10 se používá jako thionace činidlo. Reakce tohoto typu vyžadují refluxní rozpouštědla, jako je například benzen, dioxan nebo acetonitril s P.4S10 disociační do P2S5. Některé ketony, estery a imidy se převádějí na odpovídající thiokarbonyly. Amidové dát thioamid. S 1,4-diketony se tvoří činidlo thiofeny. Používá se také k deoxygenaci sulfoxidů. Použití P4S10 byl přemístěn Lawessonovo činidlo P4S10s.[8]
P2S5 reaguje s pyridin za vzniku komplexu P2S5(pyridin)2.[9]
Reference
- ^ A b C d E F NIOSH Kapesní průvodce chemickými nebezpečími. "#0510". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ „Sulfid fosforečný“. Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Scott D. Edmondson, Mousumi Sannigrahi „Fosfor (V) sulfid“ Encyklopedie činidel pro organickou syntézu 2004 John Wiley & Sons. doi:10.1002 / 047084289X.rp166s.pub2
- ^ Corbridge, D. E. C. (1995). Fosfor: Nástin jeho chemie, biochemie a technologie (5. vydání). Amsterdam: Elsevier. ISBN 0-444-89307-5.
- ^ Berzelius, J. (1843). „Ueber die Verbindungen des Phosphors mit Schwefel“. Annalen der Chemie und Pharmacie. 46 (2): 129–154. doi:10,1002 / jlac.18430460202.
- ^ Berzelius, J. (1843). „Ueber die Verbindungen des Phosphors mit Schwefel“. Annalen der Chemie und Pharmacie. 46 (3): 251–281. doi:10,1002 / jlac.18430460303. (pokračování str. 154 stejného svazku)
- ^ Bettermann, G .; Krause, W .; Riess, G .; Hofmann, T. (2002). "Sloučeniny fosforu, anorganické". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a19_527. ISBN 3527306730.
- ^ Ozturk, T .; Ertas, E .; Mert, O. (2010). „Berzeliusovo činidlo, dekasulfid fosforitý (str4S10), v Organických syntézách “. Chemické recenze. 110 (6): 3419–3478. doi:10.1021 / cr900243d. PMID 20429553.
- ^ Bergman, Jan; Pettersson, Birgitta; Hasimbegovic, Vedran; Svensson, Per H. (2011). „Thionations using a P4S10-Pyridine Complex in Solvents such as Acetonitril and Dimethyl Sulfone“. The Journal of Organic Chemistry. 76 (6): 1546–1553. doi:10.1021 / jo101865y. PMID 21341727.
