Hydroxid nikelnatý - Nickel oxide hydroxide
 | |
 | |
| Jména | |
|---|---|
| Ostatní jména Oxidhydroxid nikelnatý | |
| Identifikátory | |
3D model (JSmol ) | |
PubChem CID | |
| |
| |
| Vlastnosti | |
| Ni (O) (OH) | |
| Molární hmotnost | 91,699 g / mol |
| Vzhled | černá pevná látka |
| Bod tání | 230 ° C (446 ° F; 503 K) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Hydroxid nikelnatý je anorganická sloučenina s chemickým vzorcem NiO (OH). Je to černá pevná látka, která je nerozpustná ve všech rozpouštědlech, ale je napadena bází a kyselinou. Je to součást nikl-metal hydridová baterie a nikl-železná baterie.
Související materiály
Oxidy niklu (III) jsou často špatně charakterizovány a předpokládá se, že jsou nestechiometrické sloučeniny. Oxid nikelnatý (Ni2Ó3) nebyl krystalograficky ověřen. Pro aplikace v organické chemii se oxidy nebo peroxidy niklu generují in situ a postrádají krystalografickou charakterizaci. Například „peroxid niklu“ (CAS # 12035-36-8) také úzce souvisí nebo dokonce je totožný s NiO (OH).[1]
Syntéza a struktura
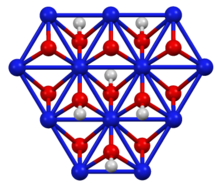
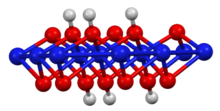
Jeho vrstvená struktura se podobá struktuře brucit polymorf z hydroxid nikelnatý, ale s polovičním počtem vodíků. Oxidační stav niklu je 3+.[2] Může být připraven reakcí hydroxidu nikelnatého s vodným hydroxid draselný a bróm jako oxidant:[3]
- 2 Ni (OH)2 + 2 KOH + Br2 → 2 KBr + 2 H2O + 2 NiOOH
Použití v organické chemii
Oxidy niklu (III) katalyzovat oxidace benzylalkohol na kyselina benzoová pomocí bělidla:[4]
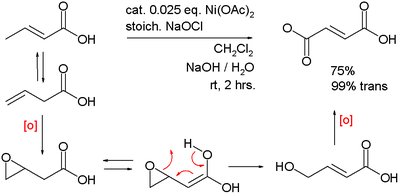
Podobně katalyzuje dvojitou oxidaci kyseliny 3-butenové na kyselina fumarová:
Reference
- ^ Gary W. Morrow "Nikl (II) Peroxid" Encyklopedie činidel pro organickou syntézu, 2001 John Wiley & Sons. doi:10.1002 / 047084289X.rn017
- ^ Casas-Cabanas, M .; Canales-Vazquez, J .; Rodriguez Carvajal, J .; Palacin, M. R. „Charakterizující niklové bateriové materiály: krystalová struktura beta- (NiOOH)“ Propozice společnosti Research Research Society Symposia (2009) 1126, str.
- ^ O. Glemser „Hydroxid β-niklu (III)“ v Handbook of Preparative Anorganic Chemistry, 2. vyd. Edited by G. Brauer, Academic Press, 1963, NY. Sv. 1. str. 1549.
- ^ Efektivní a praktický systém pro katalytickou oxidaci alkoholů, aldehydů a nenasycených karboxylových kyselin Joseph M. Grill, James W. Ogle a Stephen A. Miller J. Org. Chem.; 2006; 71 (25), str. 9291 - 9296; (Článek) doi:10.1021 / jo0612574