Sulfid nikelnatý - Nickel sulfide - Wikipedia
 | |
| Jména | |
|---|---|
| Název IUPAC Sulfid nikelnatý | |
| Ostatní jména sulfid nikelnatý, monosulfid nikelnatý, sulfid nikelnatý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.037.113 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti | |
| NiS | |
| Molární hmotnost | 90,7584 g mol−1 |
| Vzhled | černá pevná látka |
| Zápach | Bez zápachu |
| Hustota | 5,87 g / cm3 |
| Bod tání | 797 ° C (1467 ° F; 1070 K) |
| Bod varu | 1388 ° C (2530 ° F; 1661 K) |
| nerozpustný | |
| Rozpustnost | rozpustný v kyselina dusičná |
| +190.0·10−6 cm3/ mol | |
| Struktura | |
| šestihranný | |
| Nebezpečí | |
| Hlavní nebezpečí | může způsobit rakovinu při vdechování |
| Piktogramy GHS |  |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Sulfid nikelnatý je anorganická sloučenina se vzorcem NiS. Je to černá pevná látka, která se vyrábí zpracováním nikl (II) soli s sirovodík. Je známo mnoho sulfidů niklu, včetně minerálu millerit, který má také vzorec NiS. Kromě toho, že jsou užitečné rudy, jsou sulfidy niklu produkty odsiřovacích reakcí a někdy se používají jako katalyzátory. Nestechiometrické formy sulfidu niklu jsou známy, např. Ni9S8 a Ni3S2.
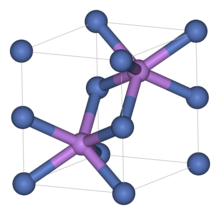
Struktura
Stejně jako mnoho jiných souvisejících materiálů i sulfid nikelnatý přijímá arzenid niklu motiv. V této struktuře je nikl oktaedrický a sulfidová centra jsou v trigonálních prizmatických místech.[1]
Sulfid nikelnatý má dva polymorfy. Α-fáze má hexagonální jednotkovou buňku, zatímco β-fáze má romboedrickou buňku. Α-fáze je stabilní při teplotách nad 379 ° C (714 ° F) a při nižších teplotách se převádí na β-fázi. Že fázový přechod způsobí zvýšení objemu o 2-4%.[2][3][4]
Syntéza
Vysrážení pevného černého sulfidu niklu je základem tradičního kvalitativní anorganická analýza schémata, která začíná oddělením kovů na základě rozpustnosti jejich sulfidů. Takové reakce jsou psány:[5]
- Ni2+ (aq) + H2S (aq) → NiS (s) + 2 H+ (aq)
Bylo vyvinuto mnoho dalších více kontrolovaných metod, včetně Solid State Metathesis reakce (z NiCl2 a Na2S) a vysokoteplotní reakce prvků.[6]
Výskyt
Přírodní
Minerál millerit je také sulfid niklu s molekulárním vzorcem NiS, i když se jeho struktura liší od syntetického stechiometrického NiS kvůli podmínkám, za kterých se tvoří. Vyskytuje se přirozeně v nízkoteplotních hydrotermálních systémech, v dutinách uhličitanových hornin a jako vedlejší produkt jiných minerálů niklu.[7]

Ve výrobě skla
Plavené sklo obsahuje malé množství sulfidu niklu, vytvořeného ze síry v čeřidle Na
2TAK
4 a nikl obsažený v kontaminujících látkách z kovové slitiny.[8]
Inkluze sirníku niklu jsou problémem tvrzené sklo aplikace. Po procesu temperování jsou inkluze sulfidu niklu v metastabilní alfa fázi. Vměstky se nakonec přemění na beta fázi (stabilní při nízké teplotě), zvětší se objem a způsobí praskliny ve skle. Uprostřed tvrzeného skla je materiál pod napětí, který způsobuje šíření trhlin a vede k spontánnímu rozbití skla.[9] K této spontánní zlomenině dochází roky nebo desetiletí po výrobě skla.[8]
Reference
- ^ Wells, A.F. (1984) Structural Anorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ^ Bishop, D.W .; Thomas, P.S .; Ray, A.S. (1998). "Ramanova spektra sulfidu niklu (II)". Bulletin materiálového výzkumu. 33 (9): 1303. doi:10.1016 / S0025-5408 (98) 00121-4.
- ^ „NiS a spontánní poškození“. Sklo na webu. Listopad 2012. Archivovány od originál dne 12. 6. 2013.
- ^ Bonati, Antonio; Pisano, Gabriele; Royer Carfagni, Gianni (12. října 2018). "Statistický model pro poruchu skleněných desek v důsledku inkluzí sirníku niklu". Journal of the American Ceramic Society. doi:10.1111 / jace.16106.
- ^ O.Glemser "Sulfid nikelnatý" v Handbook of Preparative Anorganic Chemistry, 2. vyd. Edited by G. Brauer, Academic Press, 1963, NY. Sv. 2. str. 1551.
- ^ hlavní reference lze najít v: Shabnam Virji, Richard B. Kaner, Bruce H. Weiller „Přímé elektrické měření přeměny acetátů kovů na sulfidy kovů sirovodíkem“ Inorg. Chem., 2006, 45 (26), str. 10467–10471.doi:10.1021 / ic0607585
- ^ Gamsjager H. C., Bugajski J., Gajda T., Lemire R. J., Preis W. (2005) Chemical Thermodynamics of Nickel, Amsterdam, Elsevier B.V.
- ^ A b Karlsson, Stefan (30. dubna 2017). „Spontánní zlomenina v tepelně zpevněném skle - přehled a výhled“. Keramika - Silikaty: 188–201. doi:10.13168 / cs.2017.0016. Citováno 16. srpna 2019.
- ^ Barry, John (12. ledna 2006). „Achillova pata nádherného materiálu: tvrzené sklo“. Sklo na webu. Citováno 16. srpna 2019.
