Hexafluoroniklát draselný (IV) - Potassium hexafluoronickelate(IV)
 | |
| Jména | |
|---|---|
| Název IUPAC hexafluoroniklát draselný (IV) | |
| Identifikátory | |
| |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.153.655 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| K.2NiF6 | |
| Molární hmotnost | 250.880 |
| Nebezpečí | |
| Bezpečnostní list | Externí BL |
| Piktogramy GHS |    [1] [1] |
| Signální slovo GHS | Nebezpečí[1] |
| H302, H312, H317, H331, H350[1] | |
| P201, P261, P280, P304 + 340, P405, P501[1] | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Hexafluoroniklát draselný (IV) je anorganická sloučenina s chemickým vzorcem K.
2NiF
6. Může být vyroben reakcí fluorid draselný, chlorid nikelnatý, a fluor.
Reaguje prudce s vodou a uvolňuje kyslík. Rozpouští se v bezvodém stavu fluorovodík k vytvoření světle červeného roztoku. Hexafluoroniklát draselný (IV) se rozkládá při 350 ° C a vytváří hexafluoroniklát draselný (III), nikl (II) fluorid, a fluor:[2][je zapotřebí lepší zdroj ]
Hexafluoroniklát draselný je silné oxidační činidlo. Může se to otočit chlorpentafluorid a pentafluorid bromitý do ClF+
6 a BrF+
6, respektive:[3]
- (X = Cl nebo Br, -60 ° C, aHF = bezvodý fluorovodík).
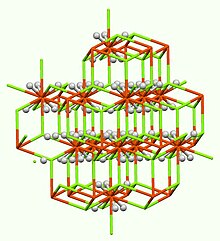
Přijímá strukturu viděnou pro K.2PtCl6.[4]
Reference
- ^ A b C d „Hexafluoronickelát draselný (IV)“. Americké prvky. Citováno 19. prosince 2018.
- ^ (v čínštině)张青莲. 《无机 化学 丛书》 第九卷 : 锰 分 族 、 铁 系 、 铂 系.北京: 科学 出版社. str. P333. ISBN 7-03-002238-6.
- ^ Schroer, Thorsten; Christe, Karl O. (2001). "Nová syntéza ClF6+ a BrF6+ Soli “. Anorganická chemie. 40 (10): 2415–9. doi:10.1021 / ic001024. PMID 11327921.
- ^ Taylor, J. C. "Srovnání profilového rozkladu a Rietveldových metod pro zjemnění strukturou s daty práškové difrakce" Zeitschrift für Kristallographie 1987, svazek 181, str. 151-160.
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |


