Kyselina benzoová - Benzoic acid - Wikipedia
| |||
 | |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Kyselina benzoová[1] | |||
| Systematický název IUPAC Kyselina benzenkarboxylová | |||
Ostatní jména
| |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 3DMet | |||
| 636131 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Informační karta ECHA | 100.000.562 | ||
| Číslo ES |
| ||
| Číslo E. | E210 (konzervační látky) | ||
| 2946 | |||
| KEGG | |||
| Pletivo | benzoová + kyselina | ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C7H6Ó2 | |||
| Molární hmotnost | 122.123 g · mol−1 | ||
| Vzhled | Bezbarvá krystalická pevná látka | ||
| Zápach | Slabý, příjemný zápach | ||
| Hustota | 1,2659 g / cm3 (15 ° C) 1,0749 g / cm3 (130 ° C)[2] | ||
| Bod tání | 122 ° C (252 ° F; 395 K)[7] | ||
| Bod varu | 250 ° C (482 ° F; 523 K)[7] | ||
| 1,7 g / l (0 ° C) 2,7 g / l (18 ° C) 3,44 g / l (25 ° C) 5,51 g / l (40 ° C) 21,45 g / l (75 ° C) 56,31 g / l (100 ° C)[2][3] | |||
| Rozpustnost | rozpustný v aceton, benzen, CCl4, CHCI3, alkohol, ethylether, hexan, fenyly, kapalný amoniak, acetáty | ||
| Rozpustnost v methanolu | 30 g / 100 g (-18 ° C) 32,1 g / 100 g (-13 ° C) 71,5 g / 100 g (23 ° C)[2] | ||
| Rozpustnost v ethanol | 25,4 g / 100 g (-18 ° C) 47,1 g / 100 g (15 ° C) 52,4 g / 100 g (19,2 ° C) 55,9 g / 100 g (23 ° C)[2] | ||
| Rozpustnost v aceton | 54,2 g / 100 g (20 ° C)[2] | ||
| Rozpustnost v olivový olej | 4,22 g / 100 g (25 ° C)[2] | ||
| Rozpustnost v 1,4-dioxan | 55,3 g / 100 g (25 ° C)[2] | ||
| log P | 1.87 | ||
| Tlak páry | 0,16 Pa (25 ° C) 0,19 kPa (100 ° C) 22,6 kPa (200 ° C)[4] | ||
| Kyselost (strK.A) | |||
| -70.28·10−6 cm3/ mol | |||
Index lomu (nD) | 1,5397 (20 ° C) 1,504 (132 ° C)[2] | ||
| Viskozita | 1,26 mPa (130 ° C) | ||
| Struktura | |||
| Monoklinický | |||
| rovinný | |||
| 1.72 D v dioxan | |||
| Termochemie | |||
Tepelná kapacita (C) | 146,7 J / mol · K.[4] | ||
Std molární entropie (S | 167,6 J / mol · K.[2] | ||
Std entalpie of formace (ΔFH⦵298) | -385,2 kJ / mol[2] | ||
Std entalpie of spalování (ΔCH⦵298) | -3228 kJ / mol[4] | ||
| Nebezpečí | |||
| Hlavní nebezpečí | Dráždivý | ||
| Bezpečnostní list | JT Baker | ||
| Piktogramy GHS |   [8] [8] | ||
| Signální slovo GHS | Nebezpečí | ||
| H318, H335[8] | |||
| P261, P280, P305 + 351 + 338[8] | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | 121,5 ° C (250,7 ° F; 394,6 K)[7] | ||
| 571 ° C (1060 ° F; 844 K)[7] | |||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LD50 (střední dávka ) | 1700 mg / kg (potkan, orálně) | ||
| Související sloučeniny | |||
Příbuzný karboxylové kyseliny | Kyseliny hydroxybenzoové Aminobenzoové kyseliny, Kyseliny nitrobenzoové, Kyselina fenyloctová | ||
Související sloučeniny | Benzaldehyd, Benzylalkohol, Benzoylchlorid, Benzylamin, Benzamid | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Kyselina benzoová /bɛnˈzoʊ.ɪk/ je bílá (nebo bezbarvá) pevná látka vzorce C6H5CO2H. Je to nejjednodušší aromatický karboxylová kyselina. Název je odvozen od guma benzoin, který byl po dlouhou dobu jeho jediným zdrojem. Kyselina benzoová se přirozeně vyskytuje v mnoha rostlinách[9] a slouží jako meziprodukt v biosyntéze mnoha lidí sekundární metabolity. Solí kyseliny benzoové se používají jako konzervační látky v potravinách. Kyselina benzoová je důležitým předchůdcem průmyslové syntézy mnoha dalších organických látek. Soli a estery kyseliny benzoové jsou známé jako benzoany /ˈbɛnzoʊ.eɪt/.
Dějiny
Kyselina benzoová byla objevena v šestnáctém století. The suchá destilace z guma benzoin byl poprvé popsán uživatelem Nostradamus (1556), a poté Alexius Pedemontanus (1560) a Blaise de Vigenère (1596).[10]
Justus von Liebig a Friedrich Wöhler stanovilo složení kyseliny benzoové.[11] Tito také zkoumali, jak kyselina hippurová souvisí s kyselinou benzoovou.
V roce 1875 Salkowski objevil protiplísňový schopnosti kyseliny benzoové, která se dlouho používala při konzervaci benzoátu obsahujícího plody morušky.[12]
Je to také jedna z chemických sloučenin nacházejících se v castoreum. Tato sloučenina je získána z kolečkové vaky z Bobr severoamerický.
Výroba
Průmyslové přípravky
Kyselinu benzoovou komerčně vyrábí částečná oxidace z toluen s kyslík. Proces je katalyzován kobalt nebo mangan naftenáty. Tento proces využívá hojné materiály a probíhá ve vysokém výtěžku.[13]
První průmyslový proces zahrnoval reakci benzotrichlorid (trichlormethylbenzen) s hydroxid vápenatý ve vodě, za použití žehlička nebo soli železa jako katalyzátor. Výsledný benzoát vápenatý se převádí na kyselinu benzoovou pomocí kyselina chlorovodíková. Výrobek obsahuje významné množství derivátů chlorované kyseliny benzoové. Z tohoto důvodu byla kyselina benzoová pro lidskou spotřebu získána suchou destilací benzoinu z gumy. Potravinová kyselina benzoová se nyní vyrábí synteticky.
Laboratorní syntéza
Kyselina benzoová je levná a snadno dostupná, proto se laboratorní syntéza kyseliny benzoové praktikuje hlavně pro její pedagogickou hodnotu. Je to běžná vysokoškolská příprava.
Kyselinu benzoovou lze čistit pomocí rekrystalizace z vody kvůli jeho vysoké rozpustnosti v horké vodě a špatné rozpustnosti ve studené vodě. Díky vyloučení organických rozpouštědel pro rekrystalizaci je tento experiment obzvláště bezpečný. Tento proces obvykle poskytuje výtěžek kolem 65% [14]
Hydrolýzou
Jako ostatní nitrily a amidy, benzonitril a benzamid mohou být hydrolyzovány na kyselinu benzoovou nebo její konjugovanou bázi v kyselých nebo bazických podmínkách.
Z Grignardova činidla
Bromobenzen lze převést na kyselinu benzoovou „karboxylací“ meziproduktu fenylmagnesiumbromid.[15] Tato syntéza nabízí studentům pohodlné cvičení k provádění a Grignardova reakce, důležitá třída vazba uhlík-uhlík formovací reakce v organické chemii.[16][17][18][19][20]
Oxidace benzylových sloučenin
Benzylalkohol[21][22] a benzylchlorid a prakticky všechny benzylové deriváty jsou snadno oxidovány na kyselinu benzoovou.
Použití
Kyselina benzoová se spotřebovává hlavně při výrobě fenol oxidační dekarboxylace při 300−400 ° C:[23]
- C6H5CO2H + 1/2 Ó2 → C.6H5OH + CO2
Požadovanou teplotu lze snížit na 200 ° C přidáním katalytického množství solí mědi (II). Fenol lze převést na cyklohexanol, což je výchozí materiál pro nylon syntéza.
Předchůdce změkčovadel
Benzoát změkčovadla, jako jsou glykol-, diethylenglykol- a triethylenglykolestery, se získají transesterifikace z methylbenzoát s odpovídajícím diol. Alternativně tyto druhy vznikají zpracováním benzoylchloridu s diolem. Tato změkčovadla se používají podobně jako změkčovadla kyselina tereftalová ester.
Kyselina benzoová a její soli se používají jako potravina konzervační látky, zastoupená E čísla E210, E211, E212, a E213. Kyselina benzoová inhibuje růst plíseň, droždí[24] a nějaký bakterie. Je buď přidán přímo, nebo vytvořen z reakcí s ním sodík, draslík nebo vápník sůl. Mechanismus začíná absorpcí kyseliny benzoové do buňky. Pokud je intracelulární pH změní na 5 nebo nižší, anaerobní fermentace z glukóza přes fosfofruktokináza se sníží o 95%. Účinnost kyseliny benzoové a benzoátu tedy závisí na pH potraviny.[25] Kyselé potraviny a nápoje podobné ovocný džus (kyselina citronová ), šumivé nápoje (oxid uhličitý ), nealkoholické nápoje (kyselina fosforečná ), kyselé okurky (ocet ) nebo jiné okyselené potraviny jsou konzervovány kyselinou benzoovou a benzoáty.
Typické úrovně použití kyseliny benzoové jako konzervační látky v potravinách jsou mezi 0,05–0,1%. Potraviny, ve kterých lze použít kyselinu benzoovou, a maximální limity pro její aplikaci jsou kontrolovány místními zákony o potravinách.[26][27]
Byla vyjádřena obava, že s kyselinou benzoovou a jejími solemi může reagovat kyselina askorbová (vitamin C) v některých nealkoholických nápojích, které tvoří malé množství karcinogenních benzen.[28]
Léčivý
Kyselina benzoová je složkou Whitfieldova mast který se používá k léčbě plísňových kožních onemocnění, jako je tinea, kožní onemocnění, a atletovo chodidlo.[29][30] Jako hlavní složka guma benzoin, kyselina benzoová je také hlavní složkou v obou tinktura benzoinu a Friarův balzám. Takové produkty mají dlouhou historii použití jako aktuální antiseptika a inhalační dekongestanty.
Kyselina benzoová byla použita jako expektorans, analgetikum, a antiseptický na počátku 20. století.[31]
Laboratorní vyšetřování [32] stejně jako velmi nedávná teoretická práce[33][34] zdůraznili, že deriváty kyseliny benzoové jsou slibné pro inhibici koronavirus (SARS-CoV ).
Benzoylchlorid
Kyselina benzoová je předchůdcem benzoylchlorid, C.6H5C (O) Cl působením thionylchlorid, fosgen nebo jeden z chloridy fosforu. Benzoylchlorid je důležitým výchozím materiálem pro několik derivátů kyseliny benzoové benzylbenzoát, který se používá v umělé příchutě a repelenty proti hmyzu.
Nika a laboratorní použití
Ve výukových laboratořích je kyselina benzoová běžným standardem pro kalibraci a bombový kalorimetr.[35]
Biologie a účinky na zdraví
Kyselina benzoová se přirozeně vyskytuje stejně jako její estery u mnoha druhů rostlin a zvířat. Skvělá množství se nacházejí ve většině bobulí (kolem 0,05%). Zralé plody několika Vaccinium druhy (např. brusinka, V. vitis macrocarpon; borůvka, V. myrtillus) obsahují až 0,03–0,13% volné kyseliny benzoové. Kyselina benzoová se také tvoří v jablka po infekci houbami Nectria galligena. U zvířat byla kyselina benzoová identifikována primárně u všežravých nebo fytofágních druhů, např. Ve vnitřnostech a svalech rock ptarmigan (Lagopus muta) a také v sekrecích žláz u mužů Pižma (Ovibos moschatus) nebo asijské býčí slony (Elephas maximus ).[36] Gum benzoin obsahuje až 20% kyseliny benzoové a 40% esterů kyseliny benzoové.[37]
Z hlediska biosyntézy se benzoát vyrábí v rostlinách z kyseliny skořicové.[38] Cesta byla identifikována z fenol přes 4-hydroxybenzoát.[39]
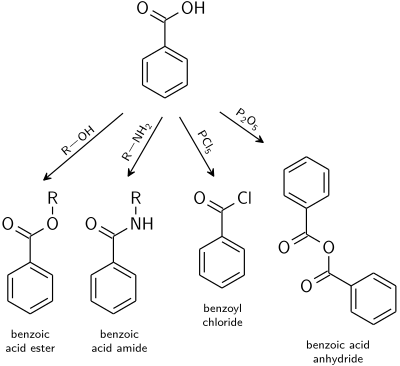
Reakce
Reakce kyseliny benzoové mohou probíhat buď na aromatický kruh nebo na karboxylová skupina:
Aromatický prsten
Elektrofilní aromatická substituce reakce bude probíhat hlavně ve 3-poloze kvůli výběr elektronů karboxylová skupina; tj. kyselina benzoová je meta režie.[40]
Karboxylová skupina
Reakce typické pro karboxylové kyseliny platí také pro kyselinu benzoovou.
- Benzoát estery jsou produktem reakce katalyzované kyselinou s alkoholy.
- Kyselina benzoová amidy jsou obvykle připraveny z benzoylchlorid.
- Dehydratace na anhydrid kyseliny benzoové je indukován s anhydrid kyseliny octové nebo oxid fosforečný.
- Vysoce reaktivní deriváty kyselin, jako jsou halogenidy kyselin se snadno získají smícháním s halogenace agenti jako chloridy fosforu nebo thionylchlorid.
- Orthoestery lze získat reakcí alkoholů za kyselých podmínek bez obsahu vody s benzonitril.
- Snížení na benzaldehyd a benzylalkohol je možné použít DIBAL-H, LiAlH4 nebo borohydrid sodný.
- Dekarboxylace na benzen může být ovlivněn zahřátím na chinolin v přítomnosti solí mědi. Hunsdieckerova dekarboxylace lze dosáhnout zahřátím soli stříbra.
Bezpečnost a metabolismus savců
Vylučuje se jako kyselina hippurová.[41] Kyselina benzoová je metabolizována butyrát-CoA ligáza do meziproduktu, benzoyl-CoA,[42] který je poté metabolizován glycin N-acyltransferáza na kyselinu hippurovou.[43] Lidé metabolizují toluen a kyselina benzoová, která se vylučuje jako kyselina hippurová.[44]
Pro lidi je Světová zdravotnická organizace je Mezinárodní program chemické bezpečnosti (IPCS) naznačuje, že prozatímní tolerovatelný příjem by byl 5 mg / kg tělesné hmotnosti denně.[36] Kočky mají výrazně nižší toleranci vůči kyselině benzoové a její soli než krysy a myši. Smrtelná dávka pro kočky může být až 300 mg / kg tělesné hmotnosti.[45] Ústní LD50 u potkanů je to 3040 mg / kg, u myší je to 1940–2263 mg / kg.[36]
v Taipei „Tchaj-wan, průzkum městského zdraví v roce 2010 zjistil, že 30% sušených a nakládaných potravinářských výrobků obsahovalo kyselinu benzoovou.[46]
Reference
- ^ Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. s. 745. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ A b C d E F G h i j "kyselina benzoová". chemister.ru. Citováno 24. října 2018.
- ^ Seidell, Atherton; Linke, William F. (1952). Rozpustnosti anorganických a organických sloučenin. Van Nostrand. Citováno 29. května 2014.
- ^ A b C Kyselina benzoová v Linstrom, Peter J .; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, Národní institut pro standardy a technologii, Gaithersburg (MD), http://webbook.nist.gov (vyvoláno 2014-05-23)
- ^ Harris, Daniel (2010). Kvantitativní chemická analýza (8 ed.). New York: W. H. Freeman and Company. str. AP12. ISBN 9781429254366.
- ^ Olmstead, William N .; Bordwell, Frederick G. (1980). "Konstanty asociace iontových párů v dimethylsulfoxidu". The Journal of Organic Chemistry. 45 (16): 3299–3305. doi:10.1021 / jo01304a033.
- ^ A b C d Záznam v databázi látek GESTIS Institut pro bezpečnost a ochranu zdraví při práci
- ^ A b C Sigma-Aldrich Co., Kyselina benzoová. Citováno 2014-05-23.
- ^ „Vědci odhalili poslední kroky pro tvorbu kyseliny benzoové v rostlinách“. Purdue Agriculture News.
- ^ Neumüller O-A (1988). Römpps Chemie-Lexikon (6. vyd.). Stuttgart: Frankh'sche Verlagshandlung. ISBN 978-3-440-04516-9. OCLC 50969944.
- ^ Liebig J.; Wöhler F (1832). „Untersuchungen über das Radikal der Benzoesäure“. Annalen der Chemie. 3 (3): 249–282. doi:10.1002 / jlac.18320030302. hdl:2027 / hvd.hxdg3f.
- ^ Salkowski E (1875). Berl Klin Wochenschr. 12: 297–298. Chybějící nebo prázdný
| název =(Pomoc) - ^ Wade, Leroy G. (2014). Organická chemie (Pearson nové mezinárodní vydání). Harlow: Pearson Education Limited. p. 985. ISBN 978-1-292-02165-2.
- ^ D. D. Perrin; W. L. F. Armarego (1988). Čištění laboratorních chemikálií (3. vyd.). Pergamon Press. str.94. ISBN 978-0-08-034715-8.
- ^ Donald L. Pavia (2004). Úvod do technik organické laboratoře: přístup v malém měřítku. Thomson Brooks / Cole. 312–314. ISBN 978-0-534-40833-6.
- ^ Shirley, D. A. (1954). "Syntéza ketonů z halogenidů kyselin a organokovových sloučenin hořčíku, zinku a kadmia". Org. Reagovat. 8: 28–58.
- ^ Huryn, D. M. (1991). „Carbanions of Alkali and Alkaline Earth Cation: (ii) Selektivita karbonylových adičních reakcí“. v Trost, B. M.; Fleming, I. (eds.). Komplexní organická syntéza, svazek 1: Přírůstky k C — X π-vazbám, část 1. Elsevierova věda. str. 49–75. doi:10.1016 / B978-0-08-052349-1.00002-0. ISBN 978-0-08-052349-1.
- ^ „Grignardova reakce. Příprava kyseliny benzoové“ (PDF). Portland Community College. Archivovány od originál (PDF) dne 26. února 2015. Citováno 12. března 2015.>
- ^ „Pokus 9: Syntéza kyseliny benzoové karbonylací Grignardova činidla“ (PDF). University of Wisconsin-Madison. Archivovány od originál (PDF) dne 23. září 2015. Citováno 12. března 2015.
- ^ „Pokus 3: Příprava kyseliny benzoové“ (PDF). Towson University. Archivovány od originál (PDF) dne 13. dubna 2015. Citováno 12. března 2015.>
- ^ Amakawa, Kazuhiko; Kolen'Ko, Yury V .; Villa, Alberto; Schuster, Manfred E /; Csepei, Lénárd-István; Weinberg, Gisela; Wrabetz, Sabine; Naumann d'Alnoncourt, Raoul; Girgsdies, Frank; Prati, Laura; Schlögl, Robert; Trunschke, Annette (2013). „Multifunkčnost krystalických MoV (TeNb) M1 oxidových katalyzátorů při selektivní oxidaci propanu a benzylalkoholu“. ACS katalýza. 3 (6): 1103–1113. doi:10.1021 / cs400010q.
- ^ Santonastaso, Marco; Freakley, Simon J .; Miedziak, Peter J .; Brett, Gemma L .; Edwards, Jennifer K .; Hutchings, Graham J. (21. listopadu 2014). "Oxidace benzylalkoholu za použití peroxidu vodíku generovaného v situaci". Výzkum a vývoj organických procesů. 18 (11): 1455–1460. doi:10.1021 / op500195e. ISSN 1083-6160.
- ^ Maki, Takao; Takeda, Kazuo (2000). "Kyselina benzoová a deriváty". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.a03_555. ISBN 978-3527306732..
- ^ D Warth (1. prosince 1991). „Mechanismus působení kyseliny benzoové na Zygosaccharomyces bailii: účinky na hladiny glykolytických metabolitů, produkci energie a intracelulární pH“. Appl Environ Microbiol. 57 (12): 3410–4. doi:10.1128 / AEM.57.12.3410-3414.1991. PMC 183988. PMID 1785916.
- ^ Pastrorova I, de Koster CG, Boom JJ (1997). „Analytická studie volných a esterově vázaných benzoových a skořicových kyselin pryskyřičných benzoinových pryskyřic pomocí GC-MS HPLC-frit FAB-MS“. Phytochem Anal. 8 (2): 63–73. doi:10.1002 / (SICI) 1099-1565 (199703) 8: 2 <63 :: AID-PCA337> 3.0.CO; 2-Y.
- ^ GSFA Online Food Additive Group Details: Benzoates (2006) Archivováno 26 září 2007 na Wayback Machine
- ^ SMĚRNICE EVROPSKÉHO PARLAMENTU A RADY č. 95/2 / ES ze dne 20. února 1995 o potravinářských přídatných látkách jiných než barviva a sladidla (verze Consleg neobsahují poslední změny zákona) Archivováno 19. Dubna 2003 v Wayback Machine
- ^ Článek BfR Indikace možné tvorby benzenu z kyseliny benzoové v potravinách, Odborné stanovisko BfR č. 013/2006, 1. prosince 2005
- ^ "Whitfield mast". Archivovány od originál dne 9. října 2007. Citováno 15. října 2007.
- ^ Charles Owens Wilson; Ole Gisvold; John H. Block (2004). Učebnice Wilsona a Gisvolda o organických léčivých a farmaceutických přípravcích. Lippincott Williams & Wilkins. str.234. ISBN 978-0-7817-3481-3.
- ^ Lillard, Benjamin (1919). „Troches of Benzoic Acid“. Praktický farmaceutický a farmaceutický přehled recenzí.
- ^ „Strukturální pohled na inaktivaci hlavní proteinázy koronaviru SARS benzotriazolovými estery“. Chemie a biologie. 15 (6): 597–606. 23. června 2008. doi:https://doi.org/10.1016/j.chembiol.2008.04.011 Šek
| doi =hodnota (Pomoc). - ^ Bray, William (2020). „Návrh léku Covid-19 pomocí kvantových mechanických principů vede k nové antivirové kandidátní látce 2-fosfonobenzoové kyseliny Corona-SARS“. doi:10.13140 / RG.2.2.17515.28962 / 2. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Stefaniu, Amalia; Pirvu, Lucia; Albu, Bujor; Pintilie, Lucia (NaN). „Molekulární dokovací studie několika derivátů kyseliny benzoové proti SARS-CoV-2“. Molekuly. 25 (24): 5828. doi:10,3390 / molekuly25245828. Zkontrolujte hodnoty data v:
| datum =(Pomoc) - ^ Experiment 2: Použití bombové kalorimetrie ke stanovení rezonanční energie benzenu Archivováno 9. března 2012 v Wayback Machine
- ^ A b C „Stručný dokument o mezinárodním chemickém hodnocení 26: KYSELINA BENZOOVÁ A BENZOÁT SODNÝ“.
- ^ Tomokuni K, Ogata M (1972). "Přímé kolorimetrické stanovení kyseliny hippurové v moči". Clin Chem. 18 (4): 349–351. doi:10.1093 / clinchem / 18.4.349. PMID 5012256.
- ^ Vogt, T. (2010). „Biosyntéza fenylpropanoidů“. Molekulární rostlina. 3: 2–20. doi:10,1093 / mp / ssp106. PMID 20035037.
- ^ Juteau, Pierre; Valérie Côté; Marie-France Duckett; Réjean Beaudet; François Lépine; Richard Villemur; Jean-Guy Bisaillon (leden 2005). „Cryptanaerobacter phenolicus gen. Nov., Sp. Nov., Anaerob, který transformuje fenol na benzoát prostřednictvím 4-hydroxybenzoátu“. International Journal of Systematic and Evolutionary Microbiology. 55 (1): 245–250. doi:10.1099 / ijs.0.02914-0. PMID 15653882.
- ^ Brewster, R. Q .; Williams, B .; Phillips, R. (1955). „Kyselina 3,5-dinitrobenzoová“. Organické syntézy.; Kolektivní objem, 3, str. 337
- ^ Panel odborníků na kontrolu kosmetických přísad Bindu Nair (2001). „Závěrečná zpráva o posouzení bezpečnosti benzylalkoholu, kyseliny benzoové a benzoanu sodného“. Int J Tox. 20 (Příloha 3): 23–50. doi:10.1080/10915810152630729. PMID 11766131. S2CID 13639993.
- ^ "butyrát-CoA ligáza". BRENDA. Technische Universität Braunschweig. Citováno 7. května 2014. Substrát / produkt
- ^ "glycin N-acyltransferáza". BRENDA. Technische Universität Braunschweig. Citováno 7. května 2014. Substrát / produkt
- ^ Krebs HA, Wiggins D, Stubbs M (1983). „Studie mechanismu antifungálního účinku benzoátu“. Biochem J.. 214 (3): 657–663. doi:10.1042 / bj2140657. PMC 1152300. PMID 6226283.
- ^ Bedford PG, Clarke EG (1972). "Experimentální otrava kyselinou benzoovou u kočky". Vet Rec. 90 (3): 53–58. doi:10.1136 / vr.90.3.53. PMID 4672555. S2CID 2553612.
- ^ Chen, Jian; Y.L. Kao (18. ledna 2010). „Téměř 30% sušených, nakládaných potravin nevyhovuje bezpečnostním kontrolám“. The China Post.