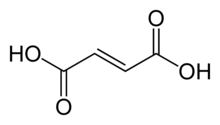
Kyselina fumarová - Fumaric acid
 | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC (2E) -But-2-enedioová kyselina | |
Ostatní jména
| |
| Identifikátory | |
3D model (JSmol ) | |
| 605763 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.003.404 |
| Číslo ES |
|
| Číslo E. | E297 (konzervační látky) |
| 49855 | |
| KEGG | |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 9126 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C4H4Ó4 | |
| Molární hmotnost | 116.072 g · mol−1 |
| Vzhled | Bílá pevná látka |
| Hustota | 1.635 g / cm3 |
| Bod tání | 287 ° C (549 ° F; 560 K) (rozkládá se)[2] |
| 4.9 g / l při 20 ° C[1] | |
| Kyselost (strK.A) | pka1 = 3.03, pka2 = 4.44 (15 ° C, cis izomer) |
| −49.11·10−6 cm3/ mol | |
| nenulová | |
| Farmakologie | |
| D05AX01 (SZO) | |
| Nebezpečí | |
| Piktogramy GHS |  |
| Signální slovo GHS | Varování |
| H319 | |
| P264, P280, P305 + 351 + 338, P313 | |
| NFPA 704 (ohnivý diamant) | |
| 375 ° C (707 ° F; 648 K) | |
| Související sloučeniny | |
Příbuzný karboxylové kyseliny | |
Související sloučeniny |
|
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Kyselina fumarová je organická sloučenina se vzorcem HO2CCH = CHCO2H. Bílá pevná kyselina fumarová se v přírodě vyskytuje široce. Má to ovoce -jako chuť a byl používán jako přísada do potravin. Své Číslo E. je E297.[3] The soli a estery jsou známé jako fumaráty. Fumarát může také odkazovat na C
4H
2Ó2−
4 iont (v roztoku). The trans izomer má dipólový moment.
Biosyntéza a výskyt
Vyrábí se v eukaryotický organismy z sukcinát v komplexu 2 elektronového transportního řetězce přes enzym sukcinát dehydrogenáza. Je to jeden ze dvou izomerní nenasycené dikarboxylové kyseliny, druhá bytost kyselina maleinová. V kyselině fumarové jsou karboxylové skupiny trans (E) a v kyselině maleinové jsou cis (Z).
Kyselina fumarová se nachází v fumitory (Fumaria officinalis), bolete houby (konkrétně Boletus fomentarius var. pseudo-igniarius), lišejník, a Islandský mech.
Fumarát je středně pokročilí v cyklus kyseliny citronové používá buňky vyrábět energii ve formě adenosintrifosfát (ATP) z jídlo. Je tvořen oxidace z sukcinát enzymem sukcinát dehydrogenáza. Fumarát je poté přeměněn enzymem fumaráza na malát.
Lidská kůže při vystavení přirozeně produkuje kyselinu fumarovou sluneční světlo.[4][5]
Fumarát je také produktem močovinový cyklus.
Kliknutím na geny, proteiny a metabolity níže můžete odkazovat na příslušné články. [§ 1]
- ^ Interaktivní mapu cest lze upravit na WikiPathways: „TCACycle_WP78“.
Použití
Jídlo
Kyselina fumarová se používá jako okyselující látka v potravinách od roku 1946. Je schválena pro použití jako potravinářská přídatná látka v EU,[6] USA[7] a Austrálii a na Novém Zélandu.[8] Jako potravinářská přídatná látka, používá se jako regulátor kyselosti a lze je označit Číslo E. E297. Obvykle se používá v nápojích a prášky do pečiva pro které jsou kladeny požadavky na čistotu. Kyselina fumarová se používá při výrobě pšeničné tortilly jako konzervant potravin a jako kyselina při kynutí.[9] Obvykle se používá jako náhrada za kyselina vinná a příležitostně místo kyselina citronová v množství 1 g kyseliny fumarové na každých ~ 1,5 g kyseliny citronové, aby se přidalo kyselost, podobně jako cesta kyselina jablečná se používá. Kromě toho, že je součástí některých umělých octových příchutí, jako jsou bramborové lupínky s příchutí soli a octa,[10] používá se také jako koagulant v pudinkové směsi.
Vědecký výbor Evropské komise pro výživu zvířat, součást GŘ pro zdraví, zjištěno v roce 2014, že kyselina fumarová je „prakticky netoxická“, ale vysoké dávky jsou pravděpodobně nefrotoxický po dlouhodobém užívání.[11]
Lék
Kyselina fumarová byla vyvinuta jako léčivo k léčbě autoimunitního stavu psoriáza v 50. letech v Německu jako tableta obsahující 3 estery, především dimethylfumarát, a prodáván jako Fumaderm společností Biogen Idec v Evropě. Biogen by později pokračoval ve vývoji hlavního esteru, dimethylfumarátu, jako léčby roztroušená skleróza.
U pacientů s relaps-remitující roztroušenou sklerózou ester dimethylfumarát (BG-12, Biogen) významně snížil relaps a progresi postižení ve studii fáze 3. Aktivuje Nrf2 cesta antioxidační odpovědi, primární buněčná obrana proti cytotoxickým účinkům oxidačního stresu.[12]
Jiná použití
Kyselina fumarová se používá při výrobě polyester pryskyřice a vícesytné alkoholy a jako mořidlo pro barviva.
Když se do jejich krmiva přidá kyselina fumarová, jehňata produkují během trávení až o 70% méně methanu.[13]
Bezpečnost
Je „prakticky netoxický“, ale vysoké dávky pravděpodobně jsou nefrotoxický po dlouhodobém užívání.[11]
Syntéza a reakce
Kyselina fumarová byla nejprve připravena z kyselina jantarová.[14] Tradiční syntéza zahrnuje oxidaci furfural (ze zpracování kukuřice ) použitím chlorát v přítomnosti a vanadium -na základě katalyzátor.[15]V současné době je průmyslová syntéza kyseliny fumarové většinou založena na katalytické izomerizace z kyselina maleinová ve vodných roztocích při nízké pH. Kyselina maleinová je dostupná ve velkých objemech jako a hydrolýza produkt anhydridu kyseliny maleinové vyrobený katalytickou oxidací benzen nebo butan.[3]
Chemické vlastnosti kyseliny fumarové lze předpokládat z její složky funkční skupiny. Tato slabá kyselina tvoří diester, prochází přidáním přes dvojná vazba, a je vynikající dienophile.
Kyselina fumarová nespaluje v a bombový kalorimetr za podmínek, kdy kyselina maleinová hladce deflagruje. Pro výukové experimenty určené k měření rozdílu energie mezi cis- a trans-isomery lze naměřené množství uhlíku rozemlít s předmětnou sloučeninou a entalpii spalování vypočítat z rozdílu.
Viz také
- Cyklus kyseliny citronové (TCA cyklus)
- Dermatologie
- Fotosyntéza
- Kyselina maleinová, cis-izomer kyseliny fumarové
Reference
- ^ Záznam v databázi látek GESTIS Institut pro bezpečnost a ochranu zdraví při práci
- ^ Pubchem. "Kyselina fumarová". pubchem.ncbi.nlm.nih.gov.
- ^ A b Lohbeck, Kurt; Haferkorn, Herbert; Fuhrmann, Werner; Fedtke, Norbert (2000). "Kyseliny maleinová a fumarová". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.a16_053. ISBN 3527306730.
- ^ Aktivní složky používané v kosmetice: průzkum bezpečnosti, Evropská rada. Výbor expertů na kosmetické výrobky
- ^ „Potraviny s kyselinou fumarovou“. Citováno 2018-04-22.
- ^ Britská agentura pro potravinové standardy: „Současné přísady schválené EU a jejich čísla E“. Citováno 2011-10-27.
- ^ US Food and Drug Administration: „Výpis stavu doplňkových látek v potravinách, část II“. Citováno 2011-10-27.
- ^ Kodex potravinových norem pro Austrálii a Nový Zéland„Standard 1.2.4 - Označování přísad“. Citováno 2011-10-27.
- ^ „Kyselina fumarová - chemická společnost“. Chemická společnost. Citováno 2018-04-22.
- ^ Jíst, vážně. „Věda o solených a octových chipsech“. www.seriouseats.com.
- ^ A b Evropská komise: „Zpráva Evropské komise Vědeckého výboru pro výživu zvířat o bezpečnosti kyseliny fumarové“ (PDF). Citováno 2014-03-07.
- ^ Gold R .; Kappos L .; Arnold D.L .; et al. (20. září 2012). „Placebem kontrolovaná studie fáze 3 orálního BG-12 pro recidivující roztroušenou sklerózu“. N Engl J Med. 367 (12): 1098–1107. doi:10.1056 / NEJMoa1114287. PMID 22992073. S2CID 6614191.
- ^ „Vědci se snaží snížit nadýmání krav“. phys.org. 21. března 2008.
- ^ Volhard, J. „Darstellung von Maleïnsäureanhydrid“ Justnal Liebig, Annalen der Chemie 1892, svazek 268, strana 255-6. doi:10,1002 / jlac.18922680108
- ^ Milas, N. A. "Kyselina fumarová" Organická syntéza 1943, Collective Volume 2, strana 302. Online verze
externí odkazy
| + H 2Ó | |||
| NADH + H+ + CO 2 | |||
| CoA | NAD+ | ||
| |||||||||||||||||