Ferrát draselný - Potassium ferrate - Wikipedia
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Ferrát draselný (VI) | |
| Ostatní jména Ferrát draselný Železičnan draselný | |
| Identifikátory | |
| Vlastnosti | |
| K.2FeO4 | |
| Molární hmotnost | 198,0392 g / mol |
| Vzhled | Tmavě fialová pevná látka |
| Hustota | 2,829 g / cm3, pevný |
| Bod tání | > 198 ° C (teplota rozkladu) |
| rozpustný v 1M KOH | |
| Rozpustnost v jiných rozpouštědlech | reaguje s většinou rozpouštědel |
| Struktura | |
| K.2TAK4 motiv | |
| Čtyřboká | |
| 0 D | |
| Nebezpečí | |
| Hlavní nebezpečí | Oxidační činidlo |
| Bezpečnostní list | Externí BL |
| Piktogramy GHS |  [1] [1] |
| Signální slovo GHS | Nebezpečí[1] |
| H272[1] | |
| P210, P220, P221, P280, P370 + 378, P501[1] | |
| Bod vzplanutí | nehořlavý |
| Související sloučeniny | |
jiný anionty | K.2MnO4 K.2CrO4 K.2RuO4 |
jiný kationty | BaFeO4 Na2FeO4 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Ferrát draselný je chemická sloučenina s vzorec K.2FeO4. Tato fialová sůl je paramagnetické, a je vzácným příkladem žehlička (VI) sloučenina. Ve většině svých sloučenin má železo oxidační stav +2 nebo +3 (Fe2+ nebo Fe3+). Odráží svůj vysoce oxidační stav, FeO42− je mocný oxidační činidlo.
Syntéza a struktura

Georg Ernst Stahl (1660 - 1734) nejprve zjistili, že zbytek se vytvořil zapálením směsi dusičnan draselný (ledek) a žehlička prášek rozpuštěný ve vodě za vzniku fialového roztoku. Edmond Frémy (1814 - 1894) později zjistil, že fúze hydroxid draselný a oxid železitý ve vzduchu vytvořil sloučeninu rozpustnou ve vodě:
- 4KOH + Fe2Ó3 + 3O → 2K2FeO4 + 2 hodiny2Ó
Složení odpovídalo složení manganistan draselný. V laboratoři K.2FeO4 se připravuje oxidací an zásaditý roztok soli železa (III) s koncentrovaným chlorové bělidlo.[2]:
- 3ClO- + 3 Fe (OH)3(H2Ó)3 + 4K+ + 4OH- → 3Cl- + 2 tis2FeO4 + 11 hodin2Ó
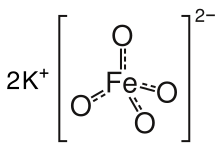
Sůl je isostrukturní s K.2MnO4, K.2TAK4, a K.2CrO4. Těleso se skládá z K.+ a čtyřboký FeO42− anion, se vzdálenostmi Fe-O 1,66 Å.[3] Špatně rozpustná sůl barya, BaFeO4, je také známý.
Vlastnosti a aplikace
Hlavní potíže s používáním K.2FeO4 je to, že je často příliš reaktivní, což naznačuje skutečnost, že se rozkládá při kontaktu s vodou, zejména v kyselé vodě:[4]
- 4 K.2FeO4 + 4 H2O → 3 O2 + 2 Fe2Ó3 + 8 KOH
Vysoko pH, vodné roztoky jsou stabilní. Tmavě fialové roztoky mají podobný vzhled manganistan draselný (KMnO
4). Je to silnější oxidační činidlo než druhé. Jako suchá pevná látka, K.2FeO4 je stabilní.
Protože vedlejšími produkty jeho redoxních reakcí jsou oxidy železa podobné rzi, K.2FeO4 byl popsán jako „zelený oxidant "Bylo zaměstnáno v čištění odpadních vod jako oxidant pro organické kontaminanty a jako biocid. Výhodně je výsledným reakčním produktem oxyhydroxid železitý, vynikající flokulant. v organická syntéza, K.2FeO4 oxiduje hlavní alkoholy.[5] Naproti tomu příbuzné oxidanty, jako je chromát jsou považovány za nebezpečné pro životní prostředí
K.2FeO4 přitáhla pozornost také jako potenciál katoda materiál v „super železná baterie."
Byly navrženy stabilizované formy železitanu draselného pro odstranění transuranových látek, jak rozpuštěných, tak suspendovaných, z vodných roztoků. Bylo navrženo množství tonáže na pomoc při nápravě následků černobylské katastrofy v Bělorusku. Tato nová technika byla úspěšně použita při odstraňování široké škály těžkých kovů.[Citace je zapotřebí ]
Práce na použití srážení železitanu draselného z transuranových a těžkých kovů byly prováděny v Laboratories of IC Technologies Inc. ve spolupráci s ADC Laboratories, v letech 1987 až 1992. Odstranění transuranových druhů bylo provedeno na vzorcích z různých oddělení. energetických jaderných stránek v USA.[Citace je zapotřebí ]
Bylo navrženo jako krvácející zátka pro čerstvé rány.[6][7]
Reference
- ^ A b C d "Ferrát draselný". Americké prvky. Citováno 13. června 2019.
- ^ Schreyer, J. M .; Thompson, G. W .; Ockerman, L. T. „Ferrate draselný (VI)“ Anorganic Syntheses, 1953, svazek IV, strany 164-168.
- ^ Hoppe, M. L .; Schlemper, E.O .; Murmann, R. K. „Struktura ferosforečnanu draselného (VI)“ Acta Crystallographica 1982, svazek B38, str. 2237-2239. doi:10.1107 / S0567740882008395.
- ^ Holleman, A. F .; Wiberg, E. "Anorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Green, J. R. „Ferrate draselný“ Encyclopedia of Reagents for Organic Synthesis 2001, John Wiley. doi:10.1002 / 047084289X.rp212.
- ^ „Jak WoundSeal funguje“. WoundSeal. 2016.
- ^ WO přihláška 2014153566, John Hen; Talmadge Kelly Keene a Mark Travi, „Hemostatické zařízení a metoda“, publikováno 25. září 2014
