Tetrakarbonylferát disodný - Disodium tetracarbonylferrate
 | |
| Jména | |
|---|---|
| Název IUPAC tetrakarbonylferát disodný | |
| Systematický název IUPAC tetrakarbonylferát disodný | |
| Ostatní jména dvojsodno-tetrakarbonyl, Collmanovo činidlo | |
| Identifikátory | |
3D model (JSmol ) | |
| Informační karta ECHA | 100.035.395 |
| Číslo ES |
|
PubChem CID | |
| |
| |
| Vlastnosti | |
| C4FeNa2Ó4 | |
| Molární hmotnost | 213.87 |
| Vzhled | Bezbarvá pevná látka |
| Hustota | 2,16 g / cm3, pevný |
| Rozkládá se | |
| Rozpustnost | tetrahydrofuran, dimethylformamid, dioxan |
| Struktura | |
| Zkreslený čtyřstěn | |
| Čtyřboká | |
| Nebezpečí | |
| Hlavní nebezpečí | Samozápalný |
| Související sloučeniny | |
Související sloučeniny | Železo pentakarbonyl |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
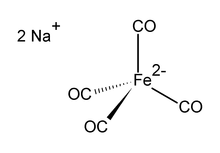
Tetrakarbonylferát disodný je sloučenina organického železa se vzorcem Na2[Fe (CO)4]. Vždy se používá jako solvát, např. S tetrahydrofuran nebo dimethoxyethan, které se váží na sodíkový kation.[1] An kyslík -citlivá bezbarvá pevná látka, je to činidlo v organokovovém a organickém chemickém výzkumu. Sodná sůl solvatovaná na dioxan je známá jako Collmanovo činidlo, jako uznání James P. Collman časný popularizátor jeho použití.[2]
Struktura
Dianion [Fe (CO)4]2− je izoelektronický s Ni (CO)4.[3][4] Železné centrum je čtyřboké s Na+--- Interakce OCFe. To se běžně používá s dioxan v komplexu s sodným kationtem.
Syntéza
The činidlo byl původně generován in situ redukcí pentakarbonyl železa s amalgámem sodným.[5] Použití moderní syntézy naftenid sodný nebo sodné soli benzofenonu jako redukční činidla:[1][6]
- Fe (CO)5 + 2 Na → Na2[Fe (CO)4] + CO
Pokud se použije nedostatek sodíku, redukcí se získá tmavě žlutý oktakarbonyl diferrát:[1]
- 2 Fe (CO)5 + 2 Na → Na2[Fe2(CO)8] + 2 CO
Některé specializované metody nezačínají karbonylem železa.[7]
Reakce
Používá se k syntéze aldehydy z alkylhalogenidů.[8]Činidlo bylo původně popsáno pro konverzi primárních alkylbromidů na odpovídající aldehydy ve dvoustupňové reakci „v jedné nádobě“:[5]
- Na2[Fe (CO)4] + RBr → Na [RFe (CO)4] + NaBr
Na toto řešení se poté postupně působí PPh3 a pak octová kyselina za vzniku aldehydu RCHO.
K převodu lze použít tetrakarbonylferát disodný chloridy kyselin na aldehydy. Tato reakce probíhá prostřednictvím intermediátu železa acyl komplex.
- Na2[Fe (CO)4] + RCOCl → Na [RC (O) Fe (CO)4] + NaCl
- Na [RC (O) Fe (CO)4] + HCl → RCHO + "Fe (CO)4"+ NaCl
Tetrakarbonylferát disodný reaguje s alkylhalogenidy (RX) k výrobě alkylových komplexů:
- Na2[Fe (CO)4] + RX → Na [RFe (CO)4] + NaX
Tyto alkyly železa lze převést na odpovídající karboxylová kyselina a halogenidy kyselin:
- Na [RFe (CO)4] + Ó2, H+ → → RCO2H + Fe ...
- Na [RFe (CO)4] + 2 X2 → RC (O) X + FeX2 + 3 CO + NaX
Reference
- ^ A b C Strong, H .; Krusic, P. J .; San Filippo, J. (1990). „Karbonyl feráty sodný, Na2[Fe (CO)4], Na2[Fe2(CO)8] a Na2[Fe3(CO)11]. Bis [μ-Nitrido-Bis (trifenylfosfor)1+] Undeka-karbonyltriferát2−, [(Ph3P)2N]2[Fe3(CO)11]". Anorganické syntézy. 28: 203–207. doi:10.1002 / 9780470132593.ch52. ISBN 0-471-52619-3.
- ^ Miessler, G. L .; Tarr, D. A. (2004). Anorganická chemie. Upper Saddle River, NJ: Pearson.
- ^ Chin, H. B .; Bau, R. (1976). „Krystalová struktura tetrakarbonylferátu disodného. Zkreslení tetrakarbonylferátu2− Anion v pevném stavu ". Journal of the American Chemical Society. 98 (9): 2434–2439. doi:10.1021 / ja00425a009.
- ^ Teller, R. G .; Finke, R. G .; Collman, J. P .; Chin, H. B .; Bau, R. (1977). „Závislost geometrie tetrakarbonylferátu (2-) na protiiontu: krystalová struktura tetrakarbonylferátu dvojdraselného a bis (sodné krypty) tetrakarbonylferátu [krypt = N (CH2CH2OCH2CH2OCH2CH2)3N] ". Journal of the American Chemical Society. 99: 1104–1111. doi:10.1021 / ja00446a022.CS1 maint: používá parametr autoři (odkaz)
- ^ A b Cooke, M. P. (1970). "Snadná přeměna alkylbromidů na aldehydy za použití tetrakarbonylferátu sodného (-II)". Journal of the American Chemical Society. 92 (20): 6080–6082. doi:10.1021 / ja00723a056.
- ^ Richard G. Finke, Thomas N. Sorrell (1979). „Nucleophilic Acylation with Disodium Tetracarbonylferrate: Methyl 7-Oxoheptanoate and Methyl 7-Oxoöctanoate“. Organické syntézy. 59: 102. doi:10.15227 / orgsyn.059.0102.
- ^ Scholsser, M. (2013). Organometallics in Syntéza, třetí manuál. Chicester, Anglie: Wiley.
- ^ Pike, R. D. (2001). "Tetrakarbonylferát disodný (-II)". Encyklopedie činidel pro organickou syntézu. doi:10.1002 / 047084289X.rd465.
Další čtení
- Collman, J. P. (1975). "Tetrakarbonylferát disodný, analog přechodného kovu Grignardova činidla". Účty chemického výzkumu. 8 (10): 342–347. doi:10.1021 / ar50094a004.
- Ungurenasu, C .; Cotzur, C. (1982). „Tetrakarbonylferát disodný: Činidlo pro kyselinovou funkcionalitu halogenovaných polymerů“. Bulletin polymerů. 6 (5–6): 299–303. doi:10.1007 / BF00255401.
- Hieber, V. W .; Braun, G. (1959). „Notizen:„ Rheniumcarbonylwasserstoff “und Methylpentacarbonylrhenium“. Zeitschrift für Naturforschung B. 14 (2): 132–133. doi:10.1515 / znb-1959-0214.
