Tris (acetylacetonato) železo (III) - Tris(acetylacetonato)iron(III)
 | |
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Tris (acetylacetonato) Železo (III) | |
| Ostatní jména Železo (III) acetylacetonát, Železo (III) tris (2,4-pentandionato), Fe (acac)3 | |
| Identifikátory | |
3D model (JSmol ) | |
| Informační karta ECHA | 100.034.398 |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti | |
| Fe (C.5H7Ó2)3 | |
| Molární hmotnost | 353,17 g / mol |
| Vzhled | Červená pevná látka |
| Hustota | 1,348 g / cm3 |
| Bod tání | 180 až 181 ° C (356 až 358 ° F; 453 až 454 K) |
| Bod varu | rozkládá se |
| 2 g / l | |
| Nebezpečí | |
| R-věty (zastaralý) | R22, R36 |
| S-věty (zastaralý) | S26 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |

Tris (acetylacetonato) železo (III), často zkráceně Fe (acac)3, je železitý koordinační komplex představovat acetylacetonát (acac) ligandy, což z něj činí jednu rodinu acetylacetonáty kovů. Je to červená na vzduchu stabilní pevná látka, která se rozpouští v nepolárních organických rozpouštědlech.
Příprava
Fe (acac)3 se připravuje zpracováním čerstvě vysráženého Fe (OH)3 s acetylaceton.[1]
- Fe (OH)3 + 3 HC5H7Ó2 → Fe (C.5H7Ó2)3 + 3 H2Ó
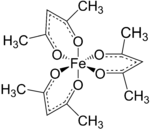
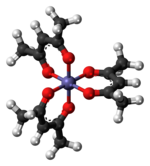
Struktura a vlastnosti
Fe (acac)3 je oktaedrický komplex se šesti ekvivalentními vazbami Fe-O se vzdálenostmi vazeb asi 2,00 Å. Pravidelná geometrie je v souladu s a vysoká rotace Fe3+ jádro. Jelikož jsou kovové orbity rovnoměrně obsazeny, komplex nepodléhá Jahn-Tellerovy zkreslení a tak přijímá D.3 molekulární symetrie. Naproti tomu související kovový acetylacetonát Mn (acac)3 přijímá zkreslenější oktaedrickou strukturu.[2] 5 nepárových d-elektrony také vedou k tomu, že komplex je paramagnetické, s magnetický moment 5,90 μB.
Fe (acac)3 má spirálová chirality. Δ- a Λ-enantiomery pomalu převádět prostřednictvím Bailar a Ray-Dutt se zvrtne. Rychlost interkonverze je dostatečně pomalá, aby umožnila částečné rozlišení jejích enantiomerů.[3]
Reakce
Fe (acac)3 byl zkoumán jako prekatalyzátor a činidlo v organické chemii, i když aktivní druhy obsahující železo jsou v těchto procesech obvykle neznámé. V jednom případě Fe (acac)3 Bylo prokázáno, že podporuje křížovou vazbu dien do olefin.[4] Fe (acac)3 katalyzuje dimerizaci isopren na směs 1,5-dimethyl-1,5-cyklooktadienu a 2,5-dimethyl-1,5-cyklooktadienu.[5]
Fe (acac)3 také katalyzuje polymeraci 1,3-benzoxazinu otevírající kruh.[6] Za oblastí polymerace, Fe (acac)3 Bylo zjištěno, že katalyzuje reakci N-sulfonyl oxaziridiny s olefiny za vzniku 1,3-oxazolidinových produktů.[7]
Reference
- ^ US patent 2004127690, Chaudhari, Mihir Kanti a kol., „Proces výroby kovových acetylacetonátů“, vydáno 1. 7. 2004
- ^ Lawson, K.E. (1961). "Infračervená absorpční spektra kovových acetylacetonátů". Spectrochimica Acta. 17 (3): 248–258. doi:10.1016/0371-1951(61)80071-4.
- ^ Anders Lennartson „Optické rozlišení a racemizace [Fe (acac)3] "Inorganica Chimica Acta 2011, roč. 365, str. 451–453. doi:10.1016 / j.ica.2010.07.066
- ^ Takacs, J. A., L .; Madhavan, G.V .; Creswell, M .; Seely, F .; Devroy, W. (1986). „Aminohydroxylace olefinů katalyzovaná železem“. Organometallics. 5 (11): 2395–2398. doi:10.1021 / om00142a044.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Misono, A. (1966). "Oligomerizace izoprenu katalyzátory na bázi kobaltu nebo železa". Bulletin of the Chemical Society of Japan. 39 (11): 2425–2429. doi:10,1246 / bcsj.39.2425.
- ^ Sudo, A .; Hirayama, Shoji; Endo, Takeshi (2010). „Vysoce účinné komplexy katalyzátorů-acetylacetonátových přechodových kovů ve 4. období pro polymeraci 1,3-benzoxazinu otevírající kruh“. Journal of Polymer Science Part A: Polymer Chemistry. 48 (2): 479. doi:10,1002 / pola.23810.
- ^ Williamson, K. T .; Yoon, T. (2010). „Aminohydroxylace olefinů katalyzovaná železem“. J. Am. Chem. Soc. 132 (13): 4570–4571. doi:10.1021 / ja1013536. PMC 2857537. PMID 20232850.


