Ferricyanid draselný - Potassium ferricyanide
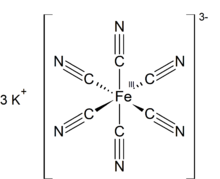 | |
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Hexakyanoferát draselný (III) | |
| Ostatní jména Red Prussiate of Potash, Pruská červená, Ferricyanid draselný | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.033.916 |
| Číslo ES |
|
| 21683 | |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
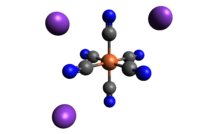
| K.3[Fe (CN)6] | |
| Molární hmotnost | 329,24 g / mol |
| Vzhled | tmavě červené krystaly, někdy malé pelety, oranžový až tmavě červený prášek |
| Hustota | 1,89 g / cm3, pevný |
| Bod tání | 300 ° C (572 ° F; 573 K) |
| Bod varu | rozkládá se |
| 330 g / l („studená voda“) 464 g / L (20 ° C) 775 g / L („horká voda“)[1] | |
| Rozpustnost | málo rozpustný v alkohol rozpustný v kyselina rozpustný ve vodě |
| +2290.0·10−6 cm3/ mol | |
| Struktura | |
| monoklinický | |
| osmistěn ve Fe | |
| Nebezpečí | |
| Bezpečnostní list | BL |
| Piktogramy GHS |  |
| Signální slovo GHS | Varování |
| H302, H315, H319, H332, H335 | |
| P261, P264, P270, P271, P280, P301 + 312, P302 + 352, P304 + 312, P304 + 340, P305 + 351 + 338, P312, P321, P330, P332 + 313, P337 + 313, P362, P403 + 233, P405, P501 | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | Nehořlavé |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 2970 mg / kg (myš, orální) |
| Související sloučeniny | |
jiný anionty | Ferokyanid draselný |
jiný kationty | pruská modř |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Ferricyanid draselný je chemická sloučenina se vzorcem K.3[Fe (CN)6]. Tato jasně červená sůl obsahuje osmistěnně koordinovaný [Fe (CN)6]3− ion.[2] Je rozpustný ve vodě a jeho roztok vykazuje určitou zelenožlutou barvu fluorescence. To bylo objeveno v roce 1822 Leopold Gmelin,[3][4] a původně se používal při výrobě ultramarínových barviv.
Příprava
Ferricyanid draselný se vyrábí průchodem chlór přes a řešení z ferokyanid draselný. Z roztoku se oddělí ferikyanid draselný:
- 2 K.4[Fe (CN)6] + Cl2 → 2 K.3[Fe (CN)6] + 2 KCl
Struktura
Stejně jako ostatní kyanidy kovů má pevný ferikyanid draselný komplikovanou polymerní strukturu. Polymer se skládá z oktaedru [Fe (CN)6]3− centra zesítěná s K.+ ionty, které jsou vázány na CN ligandy.[5] K+--- Spojení NCFe se rozbijí, když je pevná látka rozpuštěna ve vodě.
Aplikace
Sloučenina má široké použití v modrotisk kreslení a dovnitř fotografování (Kyanotyp proces). Několik tónování fotografického tisku procesy zahrnují použití ferikyanidu draselného. Ferricyanid draselný byl použit jako oxidační činidlo odebrat stříbrný z barevných negativů a pozitiv během zpracování, proces zvaný bělení. Vzhledem k tomu, že bělidla na bázi ferikyanidu draselného jsou ekologicky neškodná, krátkodobá a schopná uvolňovat plynný kyanovodík, pokud jsou smíchána s kyselinou, bělidla používající železitý EDTA se používají při zpracování barev od zavedení Kodaku v roce 1972 Proces C-41. v barevná litografie, ferikyanid draselný se používá ke zmenšení velikosti barevných teček bez snížení jejich počtu, jako druh ruční barevné korekce zvané leptání teček. Používá se také v černobílé fotografii s thiosíran sodný (hypo) ke snížení hustoty a negativní nebo želatinový stříbrný potisk kde je směs známá jako Farmářův reduktor; to může pomoci vyrovnat problémy z přeexponování negativu nebo zesvětlit zvýraznění v tisku.[6]
Sloučenina je také zvyklá ztvrdnout žehlička a ocel, v galvanické pokovování, barvení vlna, jako laboratoř činidlo a jako mírný oxidační činidlo v organická chemie.
Ferricyanid draselný je také jednou ze dvou sloučenin přítomných v roztok indikátoru ferroxylu (spolu s fenolftalein ), která se změní na modrou (pruská modř ) v přítomnosti Fe2+ ionty, a které lze proto použít k detekci oxidace kovů, která povede k rzi. Je možné vypočítat počet molů Fe2+ ionty pomocí a kolorimetr, kvůli velmi intenzivní barvě pruská modř Fe4[Fe (CN)6]3.
Ferricyanid draselný se často používá ve fyziologických experimentech jako prostředek ke zvýšení množství roztoku redox potenciál (E ° ~ 436 mV při pH 7). Jako takový může oxidovat redukovaný cytochrom c (E ° ~ 247 mV při pH 7) v neporušených izolovaných mitochondriích. Dithioničitan sodný se v takových experimentech obvykle používá jako redukční chemikálie (E ° ~ 420 mV při pH 7).
Ferricyanid draselný se používá ke stanovení potenciálu redukce výkonu železem vzorku (extrakt, chemická sloučenina atd.).[7] Takové měření se používá k určení antioxidant vlastnost vzorku.
Ferricyanid draselný se používá v mnoha ampérometrech biosenzory jako elektronový přenos prostředek nahrazující přirozený prostředek pro přenos elektronů enzymu, jako je kyslík jako u enzym glukózooxidáza. Používá se jako tato složka v mnoha komerčně dostupných krevech glukometry pro použití diabetici.
Ferikyanid draselný se kombinuje s hydroxid draselný (nebo hydroxid sodný jako náhrada) a vodu k formulaci Murakamiho leptadla. Toto leptadlo používají metalografové k zajištění kontrastu mezi fázemi pojiva a karbidu v slinutých karbidech.
pruská modř
pruská modř, tmavě modrý pigment v modrém tisku, je generován reakcí K.3[Fe (CN)6] se železem (Fe2+) ionty stejně jako K.4[Fe (CN)6] s železitými solemi.[8]
v histologie, ferikyanid draselný se používá k detekci železnatého železa v biologické tkáni. Ferricyanid draselný reaguje s železným železem v kyselém roztoku za vzniku nerozpustného modrého pigmentu, běžně označovaného jako Turnbullova modrá nebo pruská modř. Pro detekci železitého (Fe3+) železo, draslík ferokyanid místo toho se používá v Perlsova pruská modrá metoda barvení.[9] Materiál vytvořený v Turnbullově modré reakci a sloučenina vytvořená v pruské modré reakci jsou stejné.[10][11]
Bezpečnost
Ferricyanid draselný má nízkou toxicitu, jeho hlavním rizikem je, že mírně dráždí oči a pokožku. Za velmi silně kyselých podmínek však vysoce toxický kyanovodík plyn se vyvíjí podle rovnice:
- 6 H+ + [Fe (CN)6]3− → 6 HCN + Fe3+[12]
Reakce s kyselina chlorovodíková je následující:
- 6 HCl + K.3[Fe (CN)6] → 6 HCN + FeCl3 + 3 KCl
Viz také
Reference
- ^ Kwong, H.-L. (2004). „Ferricyanid draselný“. V Paquette, L. (ed.). Encyklopedie činidel pro organickou syntézu. New York: J. Wiley & Sons. doi:10.1002 / 047084289X.
- ^ Sharpe, A. G. (1976). Chemie kyanokomplexů přechodných kovů. London: Academic Press.
- ^ Gmelin, Leopold (1822). „Ueber ein besonderes Cyaneisenkalium a über eine neue Reihe von blausauren Eisensalzen“ [Na konkrétním kyanátu železnatém draselném a na nové sérii solí železa s kyselinou kyanovou]. Journal für Chemie und Physik (v němčině). 34: 325–346.
- ^ Ihde, A.J. (1984). Vývoj moderní chemie (2. vyd.). New York: Dover Publications. str. 153.
- ^ Figgis, B.N .; Gerloch, M .; Mason, R. „Krystalografie a paramagnetická anizotropie ferikyanidu draselného“ Proceedings of the Royal Society of London, Series A: Mathematical and Physical Sciences 1969, sv. 309, str. 91-118. doi:10.1098 / rspa.1969.0031
- ^ Stroebel, L .; Zakia, R. D. (1993). „Farmářův reduktor“. Fokální encyklopedie fotografie. Focal Press. str. 297. ISBN 978-0-240-51417-8.
- ^ Nakajima, Y., Sato, Y., a Konishi, T. (2007). Antioxidační malé fenolické přísady v Inonotus obliquus (persoon) Pilat (Chaga). Chemický a farmaceutický bulletin, 55 (8), 1222–1276.
- ^ Dunbar, K. R .; Heintz, R. A. (1997). „Chemistry of Transition Metal Kyanide Compounds: Modern Perspectives“. Pokrok v anorganické chemii. Pokrok v anorganické chemii. 45. 283–391. doi:10.1002 / 9780470166468.ch4. ISBN 9780470166468.
- ^ Carson, F. L. (1997). Histotechnology: Samoučivý text (2. vyd.). Chicago: Americká společnost klinických patologů. 209–211. ISBN 978-0-89189-411-7.
- ^ Tafesse, F. (2003). „Srovnávací studie podporující hydrolýzu 4-nitrofenylfosfátu v mikroemulzích na pruskou modrou nebo diaquatetraamin-kobalt (III)“ (PDF). International Journal of Molecular Sciences. 4 (6): 362–370. doi:10,3390 / i4060362.
- ^ Verdaguer, M .; Galvez, N .; Garde, R .; Desplanches, C. (2002). „Elektrony při práci v pruských modrých analogech“ (PDF). Rozhraní elektrochemické společnosti. 11 (3): 28–32. doi:10.1002 / brada.200304218.
- ^ „MSDS for ferricyanide“ (PDF).

