Pyrofosforečnan železitý - Iron(III) pyrophosphate
 | |
| Jména | |
|---|---|
| Ostatní jména Pyrofosforečnan železitý | |
| Identifikátory | |
| |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.030.160 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
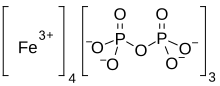
| Fe4(Str2Ó7)3 | |
| Molární hmotnost | 745 224 (anhydrát) 907,348 (nonahydrát) |
| Vzhled | žlutá pevná látka (nonahydrát)[1] |
| nerozpustný | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Triferic, Triferic AVNU |
| AHFS /Drugs.com | Profesionální drogová fakta |
| Licenční údaje | |
| Trasy z správa | Hemodialýza, intravenózní (IV), parenterální |
| ATC kód |
|
| Právní status | |
| Právní status |
|
| Identifikátory | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.030.160 |
| Chemické a fyzikální údaje | |
| Vzorec | C18H24Fe4Ó42P6 |
| Molární hmotnost | 1321.571 g · mol−1 |
Pyrofosforečnan železitý je anorganická chemická sloučenina vzorce Fe4(Str2Ó7)3.
Lékařské použití
Citrát pyrofosforečnanu železitého, prodávané pod značkou Triferic, je produkt nahrazující železo určený k nahrazení železa k udržení hemoglobinu u dospělých závislých na hemodialýze chronické onemocnění ledvin.[2][3]
Mezi nejčastější nežádoucí účinky patří bolest hlavy, periferní edém, astenie, trombóza AV píštěle, infekce močových cest, krvácení v místě píštěle AV, pyrexie, únava, procedurální hypotenze, svalové křeče, bolest končetin, bolesti zad a dušnost.[2]
Citrát pyrofosforečnanu železitého byl schválen pro lékařské použití ve Spojených státech v lednu 2015.[4]
Citrát pyrofosforečnanu železitého je komplex železa se smíšeným ligandem, ve kterém je železo (III) vázáno na pyrofosfát a citrát.[2]
Syntéza
Bezvodý pyrofosforečnan železitý lze připravit zahřátím směsi metafosforečnan železitý a fosforečnan železitý pod kyslík se stechiometrickým poměrem 1: 3. Reaktanty lze připravit reakcí nonahydrát dusičnanu železitého s kyselina fosforečná.[5]
Může být také připraven pomocí následující reakce:[6]
- 3 Na4P2Ó7(aq) + 4 FeCl3(aq) → Fe4(Str2Ó7)3s +12 NaCl (vod.)
Reference
- ^ W.M. Haynes. CRC Handbook of Chemistry and Physics (97. vydání). New York: CRC Press, 2016. s. 4-68
- ^ A b C "Roztok triferic-železitý pyrofosfát Triferic-železitý pyrofosforečnan citrátový prášek Triferic-železitý pyrofosforečnanový roztok". DailyMed. 1. listopadu 2019. Citováno 30. dubna 2020.
- ^ "Triferic AVNU - roztok pyrofosforečnanu železitého". DailyMed. 6. dubna 2020. Citováno 30. dubna 2020.
- ^ „Triferický (pyrofosforečnan železitý) roztok“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 2. března 2016. Citováno 30. dubna 2020.
- ^ Elbouaanani, L.K; Malaman, B; Gérardin, R; Ijjaali, M (2002). „Zušlechťování krystalové struktury a magnetické vlastnosti Fe4 (P2O7) 3 studované neutronovou difrakcí a Mössbauerovými technikami“. Journal of Solid State Chemistry. Elsevier BV. 163 (2): 412–420. doi:10.1006 / jssc.2001.9415. ISSN 0022-4596.
- ^ Rossi L, Velikov KP, Philipse AP (květen 2014). „Koloidní pyrofosforečnanové částice železa“. Food Chem. 151: 243–7. doi:10.1016 / j.foodchem.2013.11.050. PMID 24423528.
externí odkazy
- „Pyrofosforečnan železitý“. Informační portál o drogách. Americká národní lékařská knihovna.
- „Pyrofosforečnan železitý“. Informační portál o drogách. Americká národní lékařská knihovna.
