Feroceniumtetrafluorborát - Ferrocenium tetrafluoroborate
 | |
 | |
 | |
| Jména | |
|---|---|
| Ostatní jména dicyklopentadienyl železitý tetrafluorborát | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.156.161 |
PubChem CID |
|
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti | |
| C10H10BFeF4 | |
| Molární hmotnost | 272,84 g / mol |
| Vzhled | tmavě modrý prášek |
| Bod tání | 178 ° C (352 ° F; 451 K) (rozkládá se) |
| Rozpustnost v acetonitril | Rozpustný[Citace je zapotřebí ] |
| Nebezpečí[1] | |
| Bezpečnostní list | Externí bezpečnostní list |
| Piktogramy GHS |  |
| Signální slovo GHS | Nebezpečí |
| H314 | |
| P280, P305 + 351 + 338, P310 | |
| Související sloučeniny | |
Související sloučeniny | Ferrocen |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
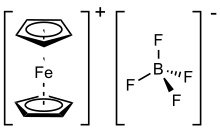
Feroceniumtetrafluorborát je organokovová sloučenina se vzorcem [Fe (C5H5)2] BF4. Tato sůl se skládá z kationtu [Fe (C5H5)2]+ a tetrafluorborát anion (BF−
4). Související hexafluorfosfát je také populární činidlo s podobnými vlastnostmi. Kationt je často zkrácen Fc+ nebo Str2Fe+. Sůl je tmavě modré barvy a paramagnetické Ferrocenové soli se někdy používají jako jednoelektronová oxidační činidla a redukovaný produkt, ferrocen, je inertní a snadno se odděluje od iontových produktů. Pár ferrocen-ferrocenium se často používá jako reference v elektrochemii. Standardní potenciál ferrocen-ferrocenia je 0,400 V vs. normální vodíková elektroda (NHE)[2] a často se předpokládá, že je invariantní mezi různými rozpouštědly.
Příprava
Komerčně dostupná tato sloučenina může být připravena oxidací ferrocenu typicky železitými solemi s následným přidáním kyselina fluoroboritá.[3] Řada dalších oxidantů také dobře funguje, například nitrosyl tetrafluorborát.[4] Je známo mnoho analogických feroceniových solí.[5]
Reference
- ^ „Tetrafluorboritan ferocenitý 482358“. Sigma-Aldrich.
- ^ Bard, A.J .; Parsons, R .; Jordan, J. (1985). Standardní potenciály ve vodném roztoku. New York: IUPAC.
- ^ Connelly, N. G .; Geiger, W. E. (1996). "Chemické redoxní látky pro organokovovou chemii". Chem. Rev. 96 (2): 877–910. doi:10.1021 / cr940053x. PMID 11848774.
- ^ Nielson, Roger M .; McManis, George E .; Safford, Lance K .; Weaver, Michael J. (1989). „Účinky rozpouštědel a elektrolytů na kinetiku samočinné výměny ferrocenium-ferrocen. Přehodnocení“. J. Phys. Chem. 93 (5): 2152. doi:10.1021 / j100342a086.
- ^ Le Bras, J .; Jiao, H .; Meyer, W. E .; Hampel, F .; Gladysz, J. A. (2000). „Syntéza, krystalová struktura a reakce 17-valenčního elektronového rhenia methylového komplexu [(η5-C5Mě5) Re (NO) (P (4-C.)6H4CH3)3) (CH3)]+ B (3,5-C
6H
3(CF
3)
2)−
4: Experimentální a výpočetní srovnání vazeb s 18-elektronovými methylovými a methylidenovými komplexy “. J. Organomet. Chem. 616: 54–66. doi:10.1016 / S0022-328X (00) 00531-3.
