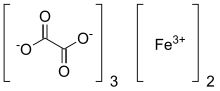
Šťavelan železitý - Ferric oxalate
 | |
| Jména | |
|---|---|
| Systematický název IUPAC železo (3+) etandioát (2: 3) | |
| Ostatní jména Oxalát železitý | |
| Identifikátory | |
| |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.019.047 |
| Číslo ES |
|
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C6Fe2Ó12 | |
| Molární hmotnost | 375,747 g / mol |
| Vzhled | Světle žlutá pevná látka (bezvodá) Vápnozelená pevná látka (hexahydrát) |
| Zápach | bez zápachu |
| málo rozpustný | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Šťavelan železitý, také známý jako oxalát železitý, je chemická sloučenina složen z železitý ionty a šťavelan ligandy; lze jej také považovat za železitou sůl kyselina šťavelová. Bezvodý materiál je světle žlutý; může však být hydratován za vzniku několika hydratuje, jako ferrioxalát draselný nebo Fe
2(C
2Ó
4)
3 • 6H2Ó, který má jasně zelenou barvu.
Struktura
Tetrahydrát

2(C
2Ó
4)
3· 4H2Ó
Krystalová struktura tetrahydrátu Fe
2(C
2Ó
4)
3 • 4H2O bylo stanoveno v roce 2015. Má triclinickou jednotkovou buňku obsahující dva atomy železa. Každý atom železa má oktaedrické koordinační vazby na atomy kyslíku tří molekul oxalátu a jedné molekuly vody. Dva z těchto tří oxalátů, ležící v přibližně kolmých rovinách, jsou tetradentátové a spojují atomy železa do klikatých řetězců. Třetí molekula oxalátu je bidentátní a spojuje atomy železa sousedních řetězců a vytváří strukturu s otevřenou vrstvou. Polovina molekul vody leží nevázaná mezi těmito řetězci. Mössbauerovo spektrum Fe
2(C
2Ó
4)
3 • 4H2O znamená, že železo je přítomno v jedinečném prostředí s posunem izomeru 0,38 mm / s a kvadrupólovým štěpením 0,40 mm / s, což naznačuje vysokou rotaci Fe3+ v oktaedrické koordinaci.[1]
Použití
Zubní lékařství
Stejně jako mnoho oxalátů byl oxalát železitý zkoumán jako krátkodobá léčba hypersenzitivita na dentin.[2] Používá se v určitých formulacích zubních past; jeho účinnost však byla zpochybněna.[3]
Fotografování
Oxalát železitý se používá jako prvek citlivý na světlo v Kallitype proces fotografického tisku; a platinotypový proces Platinum / Palladium Printing.
Baterie
Tetrahydrát oxalátu železitého byl zkoumán jako možný levný materiál pro kladnou elektrodu lithium-železné baterie. Může prokládat lithium ionty o průměrném potenciálu 3,35 V a vykazuje udržitelnou kapacitu 98 mAh / g.[1]
Organická syntéza
Hexahydrát hexalátu železitého se používá s borohydrid sodný za radikální Markovnikov hydrofunkcionalizace reakce alkenů.[4]
Viz také
Je známa řada dalších oxalátů železa: -
Reference
- ^ A b Ahouari, Hania; Rousse, Gwenaëlle; Rodríguez-Carvajal, Juan; Sougrati, Moulay-Tahar; Saubanère, Matthieu; Courty, Matthieu; Recham, Nadir; Tarascon, Jean-Marie (2015). „Odhalení struktury tetrahydrátu oxalátu železitého a jeho schopnosti reverzibilního vkládání Li“. Chemie materiálů. 27 (5): 1631–1639. doi:10,1021 / cm5043149.
- ^ Gillam, D. G .; Newman, H. N .; Davies, E. H .; Bulman, J. S .; Troullos, E. S .; Curro, F. A. (2004). "Klinické hodnocení oxalátu železitého při zmírnění hypersenzitivity dentinu". Journal of Oral Rehabilitation. 31 (3): 245–250. doi:10.1046 / j.0305-182X.2003.01230.x.
- ^ Cunha-Cruz, J .; Stout, J. R .; Heaton, L. J .; Wataha, J. C. (29. prosince 2010). „Hypersenzitivita na dentiny a oxaláty: systematický přehled“. Journal of Dental Research. 90 (3): 304–310. doi:10.1177/0022034510389179. PMC 3144108. PMID 21191127.
- ^ "Hexahydrát hexalátu železitého". Encyklopedie činidel pro organickou syntézu (1. vyd.). Wiley. 2001-04-15. doi:10.1002 / 047084289X.rn02346. ISBN 978-0-471-93623-7.
