Steroidní inhibitor aromatázy - Steroidal aromatase inhibitor
Steroidní inhibitory aromatázy jsou třídou léky které se většinou používají k léčbě rakovina prsu v postmenopauzální ženy. Vysoká úroveň estrogen v prsní tkáni zvyšuje riziko vzniku rakoviny prsu a enzym aromatáza je považován za dobrý terapeutický cíl při léčbě rakoviny prsu kvůli jejímu účasti v posledním kroku estrogenu biosyntetický cesta a také její inhibice neovlivní produkci jiných steroidy. Inhibitory aromatázy jsou rozděleny do dvou kategorií podle jejich struktury, nesteroidní a steroidní; druhý se podobá struktuře androstendion.[1] Inhibitory steroidních aromatáz nevratně inhibují enzym kovalentní vazbou na vazebné místo aromatázy, takže k němu substrát nemá přístup.[2]
Dějiny

Spolupráce vedoucí k objevování
V roce 1944 Worcesterova nadace pro experimentální biologii (WFEB). Základ byl centrem spolupráce mnoha vědců se zájmem o reprodukci, neurofyziologie a steroidní biochemie. Jednou ze základních prací bylo porozumění mechanismu přeměny androgeny na estrogeny. Skupina pracovala na porozumění biosyntéza a metabolismus steroidů, které jsou produkovány nadledviny, testy a vaječníky. Andre Meyer později předpokládal, že aromatizace androstendion byl enzymatický, což bylo prokázáno v 80. letech 20. století při čištění aromatázy.[3] Na začátku 70. let se vyšetřovatelé shodli na skutečnosti, že aromatizaci kruhu A usnadňoval cytochrom P450 zprostředkovaný enzym, prokázaný blokádou aminoglutethimid (AG, o kterém je známo, že blokuje enzymy zprostředkované P450.[3]
Harry a Angela Brodie
Harry Brodie, chemik, se připojil ke skupině WFEB a začal pracovat na porozumění steriochemii vodík eliminace v poloze C-1 během aromatizace. Jeho mechanistické studie ho vedly k poznání terapeutického potenciálu cílení na aromatázu, počátkem sedmdesátých let zahájil vývoj selektivních inhibitorů aromatázy.[3] Spolupráce s manželkou Angela Brodie je přivedl k hlášení první série těchto sloučenin v roce 1973.[4] Uskutečnili systematické studie struktury / funkce u téměř 100 inhibitorů steroidních aromatáz, které vedly k objevu 4-hydroxyandrostendionu (4-OH-A), účinného selektivního inhibitoru aromatázy.[3]
Posun směrem k léčbě rakoviny prsu a klinickým zkouškám
Poté, co Brodies prokázali snížení hladiny estrogenu u hlodavců a jeho biologickou účinnost s regrese krysích nádorů mléčné žlázy Angela Brodie odešla na podzim 1981 do Říma, aby představila svůj výzkum. Na prezentaci bylo Charles Coombes lékařský onkolog který vyjádřil svůj zájem na provedení klinického hodnocení s 4-hydroxy-androstendionem (4-OH-A) k léčbě rakoviny prsu.[4] Spolupráce Angely Brodie, klinického onkologa Charlese Coombese, Paul Goss klinický ongolog a Mitch Dowsett klinický chemik a umožnil to. Další klinický vývoj byl proveden pomocí Ciba-Geigy (nyní Novartis), (4-OH-A) s novým jménem Formestan.[3] V roce 1993 byl Formestane uveden jako Lenatron na trh s indikátory pokročilého karcinomu u postmenauposálních žen, což je první selektivní inhibitor aromatázy.[5]
Kvůli nepříznivým charakterům 4-OH-A je špatný orál biologická dostupnost a nepříznivý metabolismus, skupina vedená E. Di Sallem a P. Lombardim v Farmitalia-Carlo Erba (část Pfizer ) začal pracovat na novém selektivním inhibitoru aromatázy. Skupina navrhla, syntetizovala a vyhodnotila nový nový steroid, exemestan. Exemestane prošel klinickými zkouškami v 90. letech a obdržel FDA schválení v roce 1999, prodáváno jako Aromasin. Indikace pro exemestan je pokročilý karcinom prsu u postmenopauzálních žen, kde karcinom progredoval po léčbě tamoxifenem. Exemestan je prvním perorálním inaktivátorem aromatázy.[5]
Inhibitory steroidních aromatáz dnes
Klinické použití inhibitorů steroidních aromatáz je dnes víceméně omezeno na exemestan. Použití formestanu (Lentaron) je velmi omezené a v některých zemích se již nepoužívá. Formestan byl nahrazen novějšími a lepšími inhibitory s lepší orální dostupností a méně vedlejšími účinky, exemestanem a novější generací nesteroidní inhibitory aromatázy.[4]
Klinické použití
Rakovina
Většina rakovin prsu je závislá na hormonech a většina z nich také vyjadřujeestrogenový receptor a / nebo receptor progesteronu.[6][7][8] To je důvod, proč byly prozkoumány sloučeniny, které inhibují biosyntézu estrogenu, a představují standardní adjuvantní terapie pro rakovinu prsu v postmenopauzální ženy.[6][7] Bylo prokázáno, že karcinom prsu u postmenopauzálních žen lze léčit nebo mu předcházet modulací estrogen receptory nebo jeho ligandy a protože aromatáza je součástí posledního kroku v přeměně na estrogen, je dobrým cílem pro medicínu. Protože aromatáza katalyzuje poslední krok estrogen jeho přeměna nemá žádný vliv na syntézu jiných steroidů kromě estrogenu.[7]
U žen po menopauze produkce estrogenu ve vaječnících přestala. Hlavním zdrojem estrogenu je proto aromatizace androgenů produkovaných nadledvinami.[7] Produkce estrogenu u postmenopauzálních žen se vyskytuje hlavně v periferní tukové tkáni.[6] Mozek, kůže, tuková tkáň normálníprsní tkáň a rakovina prsu buňky mají aromatázu, ale estrogen, který je syntetizován v prsní tkáni a kolem rakovinných buněk, má vliv na růst rakoviny. Inhibitory aromatázy zastavují tuto přeměnu a snižují hladinu estrogenu.[7]
Léčba rakoviny prsu pomocí inhibitory aromatázy je účinný pouze u žen po menopauze z důvodu vysokých hladin aromatázových ligandů (substrátu) ve vaječnících žen před menopauzou. Inhibicí aromatáza u premenopauzálních žen jsou hladiny estrogenu na krátkou dobu sníženy, ale vede to k aktivaci hypotalamus a osa hypofýzy, která podporuje gonadotropin sekrece, která způsobuje vzestup estrogen úrovně stimulací vaječníků.[2][7]
Studie to ukázala křížový odpor ne vždy dochází mezi nesteroidními inhibitory aromatázy a steroidními inhibitory aromatázy.[6][8] Pokud nesteroidní inhibitory aromatázy nepracují nebo u pacientů dochází k relapsu, lze pro lepší výsledky použít použití inhibitorů steroidních aromatáz, než budou pacienti nuceni přejít z endokrinní terapie na cytotoxický chemoterapie a proto se vyhnout vedlejším účinkům a komplikacím těchto vedlejších účinků a oddálit je.[6]
Plodnost
Inhibitory aromatázy se používají k zachování plodnosti stimulací ovulace u pacientů, kteří přežili rakovinu prsu před menopauzou. Inhibicí aromatázy u premenopauzálních žen estrogen úrovně jsou dočasně sníženy, což vede ke zvýšení gonadotropin sekrece a stimulace vaječníků a to způsobuje vzestup estrogen úrovně.[2][7]
Příklady agentů
1. a 2. generace
Testolakton a formestan jsou inhibitory aromatázy 1. a 2. generace. Formestan byl prvním selektivním inhibitorem aromatázy, který byl používán k léčbě rakoviny prsu, ale dnes se klinicky nepoužívá.[3][7]
3. generace
Exemestan je jediný steroidní inhibitor aromatázy 3. generace a má výhodu oproti formestanu v tom, že je účinnější a lze jej podávat orálně. Klinické studie prokázaly, že 25 mg / den způsobuje 97,9% potlačení aromatázy.[2]
 Obrázek 2: Struktura testolaktonu |  Obrázek 3: Struktura formestanu |  Obrázek 4: Struktura exemestanu |
Mechanismus účinku
Estrogen hraje hlavní roli při stimulaci rakovina prsu proliferace buněk u hormonálně závislé rakoviny prsu. Zdá se, že vysoká koncentrace estrogenu podporuje rozvoj rakoviny prsu. V důsledku toho byly vyvinuty dva hlavní přístupy ke kontrole a blokování patologické aktivity estrogenů.[9] První přístup se zaměřuje na inhibici působení estrogenu antiestrogeny, které interagují s estrogenovými receptory. Druhý se zaměřuje na přímou inhibici produkce estrogenu inhibicí estrogen syntetázy aromatáza.[10] Inhibitory steroidních aromatáz jsou identifikovány jako inhibitory typu I, které interagují s vazebným místem pro substrát aromatázy enzym.[11]

Aromatázový enzym
Aromatáza je a cytochrom P450 který katalyzuje tři po sobě jdoucí hydroxylace reakce, konverze C19 androgeny na aromatický C18 estrogeny. Po získání elektronů z NADPH-cytochromu P450 reduktázy se aromatáza převádí androstendion a testosteron na estron a estradiol, resp. Aromatizace androgenu je terminální a krok omezující rychlost v syntéze estrogenu. Nedávné studie se zaměřily na definování oblasti aktivního místa enzymu aromatázy a na vyhodnocení nejslibnějšího mechanismu reakce. Byly také generovány trojrozměrné modely aktivní oblasti aromatázy, ačkoli přesná povaha struktury ještě nebyla plně definována.[12]



Steroidní struktura
Drogy jako exemestan a další steroidní inhibitory aromatázy mají steroidní strukturu, která soutěží s přírodním aromatázovým substrátem androstendion.[11] Inhibitor musí sdílet důležité strukturní rysy s endogenním substrátem a jako rysy androgeny, což jim umožňuje interakci s katalytickým místem na enzymovém proteinu. Díky tomu jsou inhibitory steroidních aromatáz ze své podstaty selektivní.[13] Díky své selektivní inhibici neovlivní produkci druhého steroidy v biosyntetické dráze estrogenu.[9]
Vazba na aktivní web
Léky vázané na katalytické místo se často metabolizují na meziprodukty, které mají mnohem vyšší afinitu k androgennímu receptoru. Vazba meziproduktového metabolitu 17-hydroexemestanu na androgenový receptor je přibližně stokrát větší než vazba mateřské sloučeniny, exemestanu.[11] Když se metabolit váže na aktivní místo na enzymu, zahájí enzym svou typickou sekvenci hydroxylace, ale hydroxylace vede k nerozbitnosti kovalentní vazba mezi inhibitorem a enzymovým proteinem. I když jsou odstraněny všechny nepřipojené části inhibitoru, enzymatická aktivita aromatáza lze obnovit pouze syntézou nových enzymů.[13] Inhibitor tak blokuje aktivitu enzymu i poté, co je léčivo odstraněno z oběhu, což má trvalý účinek in vivo. Pro zachování inhibice není nutná trvalá přítomnost léčiva, což zase snižovalo riziko toxických látek nepříznivé účinky k pacientovi.[10] Vzhledem k nevratné povaze inhibice jsou steroidní AI často uváděny na trh jako inaktivátory nebo inhibitory sebevraždy.[9]
Vztahy mezi strukturou a aktivitou (SAR)
Rovinnost A kruhu je velmi důležitá pro afinitu sloučenin k aromatáza. Jak je vidět na stůl 1, kde sloučeniny 2 a 3 vykazují podstatnou inhibici a také mají stejnou stereochemický požadavky. Stejný účinek lze pozorovat u sloučeniny 5, s inhibicí 34,6% a jeho 4-keto derivátu, sloučeniny 7 s inhibicí 83,3%. Tyto rozdíly ve struktuře AI ukazují důležitost rovinnosti A kruhu pro interakci s aktivním místem aromatázy.[14]
Důležitým aspektem vazebných vlastností sloučenin je stereochemie v sekci C-5, kde poloha atomu vodíku může být v polohách alfa nebo beta (směřující nahoru nebo dolů). 5α-epimery vykazují mnohem větší vazebné vlastnosti než jejich 5p protějšky, jak je vidět u sloučenin 3 /4 a 5 /6 v stůl 1. Tyto výsledky ukazují na důležitost správného úhlu mezi spojením A a B-kruhu pro lepší vazbu na aktivní místo aromatázy.[14]
| Sloučenina | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Struktura inhibitoru |  |  |  |  |  |  |  |  |  |  |  |  |
| Inhibice (%) pro 2 μM |
Výměna D-kroužku cyklopentanon na šestičlenný δ-lakton snížila vazebnou schopnost sloučenin. Sloučenina 9 kombinoval strukturu D-kroužku testolakton a struktura A-kroužku formestan ale měl podstatně nižší inhibici aromatázy než formestan.[14]
Oblast C-4 je důležitá pro interakci AI s vazebnou oblastí a hydrofilní dluhopisy jako hydroxyl nebo karbonyl vazby v této poloze mohou zlepšit interakci s aromatázou.[14]
Pokusy s použitím 3-deoxy steroidů vedly k tomu, že 4β, 19-diol měl největší inhibici aromatázy. To je pravděpodobně příčinou dvou polárních aminokyselin v aktivním místě a podtrhuje význam hydrofilních skupin ve steroidech pro lepší vazebné vlastnosti.[15]
Syntéza
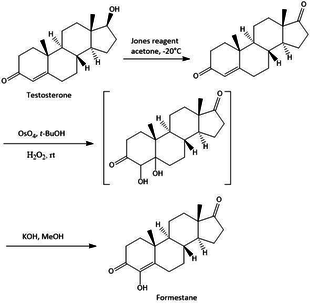
The syntéza inhibitorů steroidních aromatáz se provádí různými způsoby, všechny mají společné to, že jsou syntetizovány z výchozího bodu, kterým je základní struktura steroidů. S různými metodami existuje různý výchozí bod syntézy, např. Testosteron, androstendion a další variace těchto sloučenin. Syntéza formestanu z testosteronu je snadná třístupňová syntéza, jak je znázorněno na obrázku 2. Syntéza má celkový 23% výtěžek formestanu. Prvním krokem je oxidace testosteronu s Jonesovo činidlo poskytnout androst-4-en-3,17-dion se 73% výtěžkem. Krok 2 je hydroxylace androst-4-en-3,17-dionu s OsO4, následovaný krokem 3 s alkalickou dehydratací výsledných diolů za vzniku formestanu.[16]
Syntéza exemestanu také sestává ze tří kroků, jak je znázorněno na obrázku 3. Nejprve, a Vilsmeier-Haackovo činidlo se připravuje refluxováním paraformaldehyd a dimethylaminhydrochlorid v isopentanol při teplotě 131 ° C za současného odstraňování vody z isopentanolu za použití a Dean-Starkův oddělovač. Před přidáním komerčně dostupného boldenonu (androsta-1,4-dien-17p-ol-3-on) se vnitřní teplota činidla ochladí na 10–15 ° C. Reakční směs se poté 15 hodin zahřívá ke zpětnému toku, čímž se získá 6-methylenderivát, 6-methyleneandrosta-l, 4-dien-17p-ol-3-on. Následně Jonesova oxidace derivátu v acetonu při -10 ° C poskytne exemestan v 79% výtěžku po rekrystalizaci. Pro proces rekrystalizace se použije směs 65:35 ethanolu a vody.[17]

Reference
- ^ Ahmad, I .; Shagufta (2015). „Poslední vývoj v oblasti steroidních a nesteroidních inhibitorů aromatázy pro chemoprevenci estrogen-dependentního karcinomu prsu“. European Journal of Medicinal Chemistry. 102: 375–386. doi:10.1016 / j.ejmech.2015.08.010. PMID 26301554.
- ^ A b C d Van Asten, K .; Neven, P .; Lintermans, A .; Wildiers, H .; Paridaens, R. (2014). „Inhibitory aromatázy na klinice pro léčbu rakoviny prsu: zaměření na exemestan“. Rakovina související s endokrinním systémem. 21 (1): R31 – R49. doi:10.1530 / Erc-13-0269. PMID 24434719.
- ^ A b C d E F Santen, R. J .; Brodie, H .; Simpson, E. R .; Siiteri, P. K .; Brodie, A. (2009). „Historie aromatázy: Sága důležitého biologického mediátoru a terapeutického cíle“. Endokrinní hodnocení. 30 (4): 343–375. doi:10.1210 / er.2008-0016. PMID 19389994.
- ^ A b C Chumsri, S .; Howes, T .; Bao, T .; Sabnis, G .; Brodie, A. (2011). „Aromatáza, inhibitory aromatázy a rakovina prsu“. The Journal of Steroid Biochemistry and Molecular Biology. 125 (1–2): 13–22. doi:10.1016 / j.jsbmb.2011.02.001. PMC 3104073. PMID 21335088.
- ^ A b Lombardi, P (2002). "Exemestane, nový steroidní aromatázový inhibitor klinického významu". Biochimica et Biophysica Acta (BBA) - Molekulární základ choroby. 1587 (2–3): 326–337. doi:10.1016 / S0925-4439 (02) 00096-0. PMID 12084475.
- ^ A b C d E Beresford, M .; Tumur, I .; Chakrabarti, J .; Barden, J .; Rao, N .; Makris, A. (2011). „Kvalitativní systematický přehled základu důkazů o nekřížové rezistenci mezi steroidními a nesteroidními inhibitory aromatázy u metastatického karcinomu prsu“. Clin Oncol (R Coll Radiol). 23 (3): 209–215. doi:10.1016 / j.clon.2010.11.005. PMID 21134732.
- ^ A b C d E F G h Chumsri, S (2015). "Klinické využití inhibitorů aromatázy u rakoviny prsu". Int J Zdraví žen. 7: 493–499. doi:10.2147 / IJWH.S69907. PMC 4427607. PMID 26005359.
- ^ A b Miller, W. R .; Bartlett, J .; Brodie, A. M. H .; Brueggemeier, R. W .; Di Salle, E .; Lonning, P.E .; Goss, P. E. (2008). „Inhibitory aromatázy: Existují rozdíly mezi steroidními a nesteroidními inhibitory aromatázy a záleží na nich?“. Onkolog. 13 (8): 829–837. doi:10.1634 / theoncologist.2008-0055. PMID 18695261.
- ^ A b C Ahmad, Irshad (2015-09-18). „Nejnovější vývoj v oblasti steroidních a nesteroidních inhibitorů aromatázy pro chemoprevenci estrogen-dependentního karcinomu prsu“. European Journal of Medicinal Chemistry. 102: 375–386. doi:10.1016 / j.ejmech.2015.08.010. PMID 26301554.
- ^ A b Njar, V. C .; Brodie, A. M. (01.08.1999). "Komplexní farmakologie a klinická účinnost inhibitorů aromatázy". Drogy. 58 (2): 233–255. doi:10.2165/00003495-199958020-00003. ISSN 0012-6667. PMID 10473018.
- ^ A b C Campos, Susana M. (2004-04-01). "Inhibitory aromatázy pro rakovinu prsu u postmenopauzálních žen". Onkolog. 9 (2): 126–136. doi:10.1634 / theoncologist.9-2-126. ISSN 1083-7159. PMID 15047917.
- ^ Hong, Yanyan; Chen, Shiuan (01.11.2006). „Inhibitory aromatázy“. Annals of the New York Academy of Sciences. 1089 (1): 237–251. doi:10.1196 / annals.1386.022. ISSN 1749-6632. PMID 17261771.
- ^ A b Buzdar, Aman U. (01.01.2003). „Farmakologie a farmakokinetika inhibitorů aromatázy nové generace“. Klinický výzkum rakoviny. 9 (1): 468s – 472s. ISSN 1078-0432.
- ^ A b C d Cepa, M. M .; Tavares; da Silva, E. J .; Correia-da-Silva, G .; Roleira, F. M .; Teixeira, N. A. (2005). „Vztahy mezi strukturou a aktivitou nových A, D-kruhů modifikovaných steroidů jako inhibitorů aromatázy: design, syntéza a hodnocení biologické aktivity“ (PDF). J Med Chem. 48 (20): 6379–6385. doi:10.1021 / jm050129p. hdl:10316/10522. PMID 16190763.
- ^ Numazawa, M .; Yamada, K .; Nitta, S .; Sasaki, C .; Kidokoro, K. (2001). „Role hydrofilních interakcí při vazbě hydroxylovaných 3-deoxy C19 steroidů na aktivní místo aromatázy“. J Med Chem. 44 (24): 4277–4283. doi:10.1021 / jm010282t. PMID 11708928.
- ^ Martin, G. D .; et al. (2013). "Syntéza a biokonverze formestanu". J Nat Prod. 76 (10): 1966–1969. doi:10.1021 / np400585t. PMID 24074257.
- ^ Li, Jie Jack (01.01.2007). Johnson, Douglas S .; Li, Jie Jack (eds.). Inhibitory aromatázy pro rakovinu prsu: Exemestan (Aromasin), Anastrozol (Arimidex) a Letrozol (Femara). John Wiley & Sons, Inc., str. 30–38. doi:10.1002 / 9780470134979.ch3. ISBN 978-0-470-13497-9.
