Endoteliální NOS - Endothelial NOS
Endoteliální NOS (eNOS), také známý jako syntáza oxidu dusnatého 3 (NOS3) nebo konstitutivní NOS (cNOS), je enzym že u lidí je kódován NOS3 gen nachází se v oblasti 7q35-7q36 chromozomu 7.[5] Tento enzym je jedním ze tří izoformy které syntetizují oxid dusnatý (NO), malá plynná a lipofilní molekula, která se účastní několika biologických procesů.[6][7] Mezi další izoformy patří neuronální syntáza oxidu dusnatého (nNOS), který je konstitutivně exprimován ve specifických neuronech mozku[8] a indukovatelná syntáza oxidu dusnatého (iNOS), jehož výraz je obvykle vyvolán v zánětlivá onemocnění.[9] eNOS je primárně odpovědný za generování NO v EU vaskulární endotel,[10] monovrstva plochých buněk lemujících vnitřní povrch krevních cév, na rozhraní mezi cirkulující krví v lumenu a zbytkem stěny cévy.[11] NO produkovaný eNOS ve vaskulárním endotelu hraje klíčovou roli v regulaci vaskulárního tonusu, buněčné proliferace, leukocyty adheze a agregace krevních destiček.[12] Proto je funkční eNOS nezbytný pro zdravý kardiovaskulární systém.
Struktura a katalytické aktivity
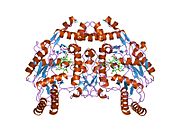
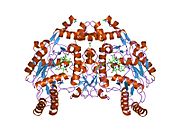
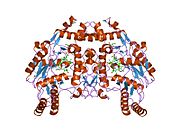
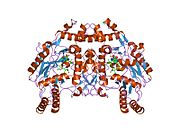
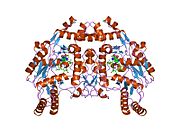
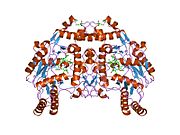
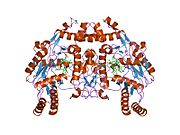
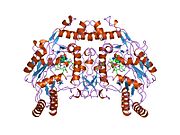
eNOS je dimer obsahující dva identické monomery 134 kD tvořené doménou reduktázy, která zobrazuje vazebná místa pro nikotinamid adenin dinukleotid fosfát (NADPH), flavin mononukleotid (FMN) a flavin adenin dinukleotid (FAD) a oxidázová doména, která zobrazuje vazebná místa pro hemovou skupinu, zinek, kofaktor tetrahydrobiopterin (BH4 ) a substrát L-arginin.[13] Doména reduktázy je spojena s doménou oxidázy pomocí a klimodulin -vázací sekvence.[14]Ve vaskulárním endotelu je NO syntetizován pomocí eNOS z L-argininu a molekulární kyslík, který se váže na hemovou skupinu eNOS, je redukován a nakonec začleněn do L-argininu za vzniku NO a L-citrulin.[15][16] Vazba kofaktoru BH4 je nezbytná pro to, aby eNOS účinně generoval NO.[17] Při absenci tohoto kofaktoru se eNOS přesouvá z dimerní do monomerní formy, čímž se stává odpojeným.[18] V této konformaci místo syntézy NO vzniká eNOS superoxidový anion, vysoce reaktivní volné radikály se škodlivými následky pro kardiovaskulární systém.[19][20]
Funkce
Systém eNOS má ochrannou funkci v kardiovaskulárním systému, což se připisuje produkci NO. Regulace vaskulárního tonusu je jednou z nejznámějších rolí NO v kardiovaskulárním systému. Jakmile je NO produkován v endotelových buňkách, difunduje přes buněčné membrány vaskulárního hladkého svalstva a aktivuje rozpustný enzym guanylátcykláza (sGC), který katalyzuje přeměnu guanosin trifosfát do cyklický guanosinmonofosfát (cGMP).[21] cGMP zase aktivuje protein kinázu G (PKG), která podporuje vícenásobnou fosforylaci buněčných cílů snižujících buněčné cíle Ca.2+ koncentrace a podpora vaskulární relaxace.[22]NO má antiproliferativní účinky inhibicí Ca závislou na cGMP2+ příliv nebo přímou inhibicí aktivity arginázy a ornithin dekarboxylázy, což snižuje tvorbu polyamidů potřebných pro syntézu DNA.[23][24] NO má také antitrombotické účinky, které jsou výsledkem jeho difúze přes membránu krevních destiček a aktivace sGC, což vede k inhibici agregace krevních destiček.[25] Kromě toho NO ovlivňuje adhezi leukocytů k vaskulárnímu endotelu inhibicí jaderného faktoru kappa B (NF-kB ), který indukuje vaskulární endoteliální expresi chemokiny a adhezní molekuly.[26]Kromě těchto funkcí má NO produkovaný eNOS antioxidační vlastnosti, protože snižuje tvorbu superoxidových aniontů v důsledku zvýšení exprese NO vyvolaného NO superoxiddismutáza, antioxidační enzym, který katalyzuje přeměnu superoxidového aniontu na peroxid vodíku.[27] Část antioxidačních vlastností NO lze dále připsat up-regulaci exprese hem-oxygenázy-I a feritinu, které snižují koncentrace aniontů superoxidu v cévách.[28]
Nařízení
Exprese a aktivita eNOS jsou pečlivě řízeny několika vzájemně propojenými mechanismy regulace přítomnými na transkripční, posttranskripční a posttranslační úrovni. Vazba transkripčních faktorů, jako je Sp1, Sp3, Ets-1, Elf-1, a YY1 k NOS3 promotér a Methylace DNA představuje důležitý mechanismus regulace transkripce.[29] Posttranskripčně je eNOS regulován modifikacemi primárního transkriptu, stabilitou mRNA, subcelulární lokalizací a nukleocytoplazmatickým transportem.[30] Posttranslační modifikace eNOS zahrnují acylaci mastných kyselin, interakce protein-protein, dostupnost substrátu a kofaktoru a stupeň fosforylace. Důležité je, že eNOS je připojen pomocí myristoylace a palmitoylace na Caveolae, kapesní invaginace na membráně bohaté na cholesterol a sfingolipidy.[31] Při vazbě eNOS na caveolae je enzym inaktivován díky silné a přímé interakci eNOS s caveolin-1.[32] Vazba kalmodulinu aktivovaného vápníkem na eNOS vytěsňuje kaveolin-1 a aktivuje eNOS. Navíc je aktivace eNOS dynamicky regulována více fosforylačními místy v tyrosin, serin, a threonin zbytky.[13]
Klinický význam
Zhoršená produkce NO se podílí na patogeneze několika nemocí, jako je hypertenze, preeklampsie, diabetes mellitus, obezita, erektilní dysfunkce a migréna. V tomto ohledu to prokázalo velké množství studií polymorfismy v NOS3 genu ovlivňují náchylnost k těmto chorobám. Přestože je NOS3 vysoce polymorfní gen, byly v tomto genu široce studovány tři genetické polymorfismy: jednonukleotidové polymorfismy (SNP) g.-786T> C (kde „g.“ označuje genomický změna, která má za následek změnu Glu298Asp v kódovaném proteinu), která se nachází v promotoru NOS3, respektive v exonu 7, a variabilní počet tandemových opakování (VNTR ) charakterizovaný opakováním 27 bp v intronu 4.[33] Alela C pro polymorfismus g.-786T> C, která vede ke snížené expresi eNOS a produkci NO,[34] bylo spojeno se zvýšeným rizikem hypertenze,[35] preeklampsie,[36] diabetická nefropatie,[37] a retinopatie,[38] migréna,[39] a erektilní dysfunkce.[40] Přítomnost alely „Asp“ pro polymorfismus Glu298Asp snižuje aktivitu eNOS,[41] a byla spojena s vyšší náchylností k hypertenzi,[42][43] preeklampsie,[44] diabetes mellitus,[45] migréna,[39] a erektilní dysfunkce.[46][47] VNTR v intronu 4 ovlivňuje expresi eNOS,[48] a náchylnost k hypertenzi,[35] preeklampsie,[36] obezita,[49] a diabetes mellitus.[45] Rostoucí důkazy podporují asociaci nemocí s NOS3 haplotypy (kombinace alel v těsné blízkosti, uvnitř bloku DNA). Tento přístup může být více informativní než analýza genetických polymorfismů jeden po druhém.[50] Haplotypy včetně SNP g.-786T> C a Glu298Asp a VNTR v intronu 4 ovlivnily náchylnost k hypertenzi,[51][52][53][54] preeklampsie,[55] a hypertenze u diabetiků.[56]Varianty NOS3 mohou také ovlivnit reakce na léky, které ovlivňují signalizaci NO, jako jsou statiny, inhibitory enzymu konvertujícího angiotensin (ACEi ) a inhibitory fosfodiesterázy typu 5 (PDE-5) (PDE5i ). Statin léčba byla účinnější při zvyšování biologické dostupnosti NO u subjektů nesoucích genotyp CC pro polymorfismus g.-786T> C než u nosičů TT.[57][58] Hypertenzní pacienti nesoucí genotypy TC / CC a alela C pro polymorfismus g.-786T> C vykazovali lepší antihypertenzní odpovědi na ACEi enalapril.[59] Podobně pacienti s erektilní dysfunkcí nesoucí alelu C pro polymorfismus g.-786T> C vykazovali lepší odpovědi na inhibitor PDE-5 sildenafil.[60][61] Společně tyto studie naznačují, že statiny, ACEi a inhibitory PDE-5 mohou obnovit zhoršenou produkci NO u subjektů nesoucích variantní alelu / genotyp polymorfismu g.-786T> C NOS3, čímž se snižuje kardiovaskulární riziko. Kromě individuální analýzy genetických polymorfismů bylo prokázáno, že haplotypy zahrnující SNP g.-786T> C a Glu298Asp a VNTR v intronu 4 ovlivňují odpovědi na sildenafil u pacientů s erektilní dysfunkcí.[60]
Poznámky
Verze tohoto článku z roku 2015 byla aktualizována externím odborníkem na základě modelu dvojího publikace. Korespondence akademický recenzent článek byl publikován v Gen a lze jej citovat jako: Gustavo H Oliveira-Paula, Riccardo Lacchini, Jose E Tanus-Santos (28. září 2015). „Endoteliální syntáza oxidu dusnatého: Od biochemie a genové struktury ke klinickým důsledkům polymorfismů NOS3“. Gen. 575 (2 Pt 3): 584–599. doi:10.1016 / J.GENE.2015.09.061. PMC 6728140. PMID 26428312.CS1 maint: používá parametr autoři (odkaz) |
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000164867 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000028978 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Marsden PA, Schappert KT, Chen HS, Flowers M, Sundell CL, Wilcox JN, Lamas S, Michel T (srpen 1992). "Molekulární klonování a charakterizace lidské endoteliální syntázy oxidu dusnatého". FEBS Lett. 307 (3): 287–93. doi:10.1016 / 0014-5793 (92) 80697-F. PMID 1379542. S2CID 36429463.
- ^ Cockcroft JR (prosinec 2005). „Zkoumání vaskulárních výhod oxidu dusnatého odvozeného od endotelu“. American Journal of Hypertension. 18 (12 Pt 2): 177S - 183S. doi:10.1016 / j.amjhyper.2005.09.001. PMID 16373196.
- ^ Villanueva C, Giulivi C (srpen 2010). „Subcelulární a buněčné lokace izoforem syntázy oxidu dusnatého jako determinanty zdraví a nemoci“. Radikální biologie a medicína zdarma. 49 (3): 307–16. doi:10.1016 / j.freeradbiomed.2010.04.004. PMC 2900489. PMID 20388537.
- ^ Förstermann U, Sessa WC (duben 2012). "Syntázy oxidu dusnatého: regulace a funkce". European Heart Journal. 33 (7): 829–37, 837a – 837d. doi:10.1093 / eurheartj / ehr304. PMC 3345541. PMID 21890489.
- ^ Oliveira-Paula GH, Lacchini R, Tanus-Santos JE (únor 2014). "Indukovatelná syntáza oxidu dusnatého jako možný cíl při hypertenzi". Aktuální drogové cíle. 15 (2): 164–74. doi:10.2174/13894501113146660227. PMID 24102471.
- ^ Fish JE, Marsden PA (leden 2006). „Endoteliální syntáza oxidu dusnatého: pohled na buněčně specifickou regulaci genů ve vaskulárním endotelu“. Buněčné a molekulární biologické vědy. 63 (2): 144–62. doi:10.1007 / s00018-005-5421-8. PMID 16416260. S2CID 22111996.
- ^ Sumpio BE, Riley JT, Dardik A (prosinec 2002). "Zaměřené buňky: endotelová buňka". International Journal of Biochemistry & Cell Biology. 34 (12): 1508–12. doi:10.1016 / s1357-2725 (02) 00075-4. PMID 12379270.
- ^ Förstermann U, Münzel T (duben 2006). „Endoteliální syntáza oxidu dusnatého při vaskulárním onemocnění: od zázraku k hrozbě“. Oběh. 113 (13): 1708–14. doi:10.1161 / CIRCULATIONAHA.105.602532. PMID 16585403.
- ^ A b Qian J, Fulton D (2013). "Posttranslační regulace endoteliální syntázy oxidu dusnatého ve vaskulárním endotelu". Hranice ve fyziologii. 4: 347. doi:10.3389 / fphys.2013.00347. PMC 3861784. PMID 24379783.
- ^ Alderton WK, Cooper CE, Knowles RG (srpen 2001). "Syntázy oxidu dusnatého: struktura, funkce a inhibice". The Biochemical Journal. 357 (Pt 3): 593–615. doi:10.1042 / bj3570593. PMC 1221991. PMID 11463332.
- ^ Fleming I, Busse R (srpen 1999). "Přenos signálu aktivace eNOS". Kardiovaskulární výzkum. 43 (3): 532–41. doi:10.1016 / s0008-6363 (99) 00094-2. PMID 10690325.
- ^ Verhaar MC, Westerweel PE, van Zonneveld AJ, Rabelink TJ (květen 2004). „Produkce volných radikálů nefunkčním systémem eNOS“. Srdce. 90 (5): 494–5. doi:10.1136 / hrt.2003.029405. PMC 1768213. PMID 15084540.
- ^ Dudzinski DM, Igarashi J, Greif D, Michel T (2006). "Regulace a farmakologie endoteliální syntázy oxidu dusnatého". Roční přehled farmakologie a toxikologie. 46: 235–76. doi:10.1146 / annurev.pharmtox.44.101802.121844. PMID 16402905.
- ^ Maron BA, Michel T (2012). "Subcelulární lokalizace oxidantů a redoxní modulace endoteliální syntázy oxidu dusnatého". Deník oběhu. 76 (11): 2497–512. doi:10.1253 / circj.cj-12-1207. PMID 23075817.
- ^ Albrecht EW, Stegeman CA, Heeringa P, Henning RH, van Goor H (leden 2003). "Ochranná role endoteliální syntázy oxidu dusnatého". The Journal of Pathology. 199 (1): 8–17. doi:10,1002 / cesta.1250. PMID 12474221. S2CID 24066479.
- ^ Luo S, Lei H, Qin H, Xia Y (2014). "Molekulární mechanismy rozpojování endoteliální NO syntázy". Současný farmaceutický design. 20 (22): 3548–53. doi:10.2174/13816128113196660746. PMID 24180388.
- ^ Denninger JW, Marletta MA (květen 1999). "Guanylátcykláza a signální dráha .NO / cGMP". Biochimica et Biophysica Acta. 1411 (2–3): 334–50. doi:10.1016 / s0005-2728 (99) 00024-9. PMID 10320667.
- ^ Surks HK, Mochizuki N, Kasai Y, Georgescu SP, Tang KM, Ito M, Lincoln TM, Mendelsohn ME (listopad 1999). „Regulace myosin fosfatázy specifickou interakcí s cGMP-dependentní protein kinázou Ialfa“. Věda. 286 (5444): 1583–7. doi:10.1126 / science.286.5444.1583. PMID 10567269.
- ^ Cornwell TL, Arnold E, Boerth NJ, Lincoln TM (listopad 1994). „Inhibice růstu buněk hladkého svalstva oxidem dusnatým a aktivace proteinkinázy závislé na cAMP cGMP“. Americký žurnál fyziologie. 267 (5 Pt 1): C1405–13. doi:10.1152 / ajpcell.1994.267.5.C1405. PMID 7977701.
- ^ Ignarro LJ, Buga GM, Wei LH, Bauer PM, Wu G, del Soldato P (březen 2001). „Role dráhy arginin-oxid dusnatý v regulaci proliferace buněk hladkého svalstva cév“. Sborník Národní akademie věd Spojených států amerických. 98 (7): 4202–8. doi:10.1073 / pnas.071054698. PMC 31203. PMID 11259671.
- ^ Walford G, Loscalzo J (říjen 2003). "Oxid dusnatý ve vaskulární biologii". Journal of trombózy a hemostázy. 1 (10): 2112–8. doi:10.1046 / j.1538-7836.2003.00345.x. PMID 14521592. S2CID 22128603.
- ^ Chen F, Castranova V, Shi X, Demers LM (leden 1999). „Nové poznatky o úloze nukleárního faktoru-kappaB, všudypřítomného transkripčního faktoru při iniciaci nemocí“. Klinická chemie. 45 (1): 7–17. doi:10.1093 / clinchem / 45.1.7. PMID 9895331.
- ^ Fukai T, Siegfried MR, Ushio-Fukai M, Cheng Y, Kojda G, Harrison DG (červen 2000). „Regulace vaskulární extracelulární superoxid dismutázy oxidem dusnatým a cvičení“. The Journal of Clinical Investigation. 105 (11): 1631–9. doi:10.1172 / JCI9551. PMC 300857. PMID 10841522.
- ^ Balla G, Jacob HS, Balla J, Rosenberg M, Nath K, Apple F, Eaton JW, Vercellotti GM (září 1992). „Ferritin: cytoprotektivní antioxidační strategie endotelu“. The Journal of Biological Chemistry. 267 (25): 18148–53. PMID 1517245.
- ^ Karantzoulis-Fegaras F, Antoniou H, Lai SL, Kulkarni G, D'Abreo C, Wong GK, Miller TL, Chan Y, Atkins J, Wang Y, Marsden PA (leden 1999). "Charakterizace lidského endoteliálního promotoru syntázy oxidu dusnatého". The Journal of Biological Chemistry. 274 (5): 3076–93. doi:10.1074 / jbc.274.5.3076. PMID 9915847.
- ^ Searles CD (listopad 2006). "Transkripční a posttranskripční regulace exprese endoteliální syntázy oxidu dusnatého". American Journal of Physiology. Fyziologie buněk. 291 (5): C803–16. doi:10.1152 / ajpcell.00457.2005. PMID 16738003.
- ^ Lisanti MP, Scherer PE, Tang Z, Sargiacomo M (červenec 1994). „Caveolae, kaveolin a membránové domény bohaté na kaveolin: signální hypotéza“. Trendy v buněčné biologii. 4 (7): 231–5. doi:10.1016/0962-8924(94)90114-7. PMID 14731661.
- ^ Ju H, Zou R, Venema VJ, Venema RC (červenec 1997). „Přímá interakce endoteliální syntázy oxidu dusnatého a kaveolin-1 inhibuje aktivitu syntázy“. The Journal of Biological Chemistry. 272 (30): 18522–5. doi:10.1074 / jbc.272.30.18522. PMID 9228013.
- ^ Lacchini R, Silva PS, Tanus-Santos JE (květen 2010). „Farmakogenetický přístup ke snížení kardiovaskulární úmrtnosti s profylaktickým použitím statinů“. Základní a klinická farmakologie a toxikologie. 106 (5): 357–61. doi:10.1111 / j.1742-7843.2010.00551.x. PMID 20210789.
- ^ Nakayama M, Yasue H, Yoshimura M, Shimasaki Y, Kugiyama K, Ogawa H, Motoyama T, Saito Y, Ogawa Y, Miyamoto Y, Nakao K (červen 1999). „Mutace T-786 → C v 5'-ohraničující oblasti genu endoteliální syntázy oxidu dusnatého je spojena s koronárním křečem“. Oběh. 99 (22): 2864–70. doi:10.1161 / 01.cir.99.22.2864. PMID 10359729.
- ^ A b Niu W, Qi Y (2011). „Aktualizovaná metaanalýza endoteliálního genu syntázy oxidu dusnatého: tři dobře charakterizované polymorfismy s hypertenzí“. PLOS ONE. 6 (9): e24266. Bibcode:2011PLoSO ... 624266N. doi:10.1371 / journal.pone.0024266. PMC 3166328. PMID 21912683.
- ^ A b Dai B, Liu T, Zhang B, Zhang X, Wang Z (duben 2013). „Polymorfismus pro gen endoteliální syntázy oxidu dusnatého, úroveň oxidu dusnatého a riziko preeklampsie: metaanalýza“. Gen. 519 (1): 187–93. doi:10.1016 / j.gene.2013.01.004. PMID 23375994.
- ^ Shoukry A, Shalaby SM, Abdelazim S, Abdelazim M, Ramadan A, Ismail MI, Fouad M (červen 2012). „Polymorfismy genu pro endoteliální syntézu oxidu dusnatého a riziko diabetické nefropatie u diabetes mellitus 2. typu“. Genetické testování a molekulární biomarkery. 16 (6): 574–9. doi:10.1089 / gtmb.2011.0218. PMID 22313046.
- ^ Taverna MJ, Elgrably F, Selmi H, Selam JL, Slama G (srpen 2005). „Polymorfismy genu pro endoteliální syntézu oxidu dusnatého T-786C a C774T nezávisle na sobě ovlivňují průběh nástupu těžké diabetické retinopatie“. Oxid dusnatý. 13 (1): 88–92. doi:10.1016 / j.niox.2005.04.004. PMID 15890549.
- ^ A b Eröz R, Bahadir A, Dikici S, Tasdemir S (září 2014). „Sdružení polymorfismů genu pro syntézu oxidu dusnatého na endotel (894G / T, -786T / C, G10T) a klinické nálezy u pacientů s migrénou“. Neuromolekulární medicína. 16 (3): 587–93. doi:10.1007 / s12017-014-8311-0. PMID 24845269. S2CID 13894932.
- ^ Safarinejad MR, Khoshdel A, Shekarchi B, Taghva A, Safarinejad S (červen 2011). „Sdružení polymorfismů T-786C, G894T a 4a / 4b genu endoteliální syntázy oxidu dusnatého s vaskulogenní erektilní dysfunkcí u íránských subjektů“. BJU International. 107 (12): 1994–2001. doi:10.1111 / j.1464-410X.2010.09755.x. PMID 20955262. S2CID 27400035.
- ^ Joshi MS, Mineo C, Shaul PW, Bauer JA (září 2007). „Biochemické důsledky variace NOS3 Glu298Asp v lidském endotelu: změněná jeskynní lokalizace a zhoršená reakce na smykové napětí“. FASEB Journal. 21 (11): 2655–63. doi:10.1096 / fj.06-7088com. PMC 7460804. PMID 17449720.
- ^ Liu J, Wang L, Liu Y, Wang Z, Li M, Zhang B, Wang H, Liu K, Wen S (březen 2015). „Souvislost mezi polymorfismem genu pro syntézu oxidu dusnatého v endotelu G894T a hypertenzí v čínštině Han: případová kontrolní studie a aktualizovaná metaanalýza“. Annals of Human Biology. 42 (2): 184–94. doi:10.3109/03014460.2014.911958. PMID 24846690. S2CID 8979107.
- ^ Pereira TV, Rudnicki M, Cheung BM, Baum L, Yamada Y, Oliveira PS, Pereira AC, Krieger JE (září 2007). „Tři polymorfismy genů endoteliálního oxidu dusnatého (NOS3) u hypertenzních a normotenzních jedinců: metaanalýza 53 studií odhaluje důkazy o zkreslení publikace“. Journal of Hypertension. 25 (9): 1763–74. doi:10.1097 / HJH.0b013e3281de740d. PMID 17762636. S2CID 36745404.
- ^ Serrano NC, Casas JP, Díaz LA, Páez C, Mesa CM, Cifuentes R, Monterrosa A, Bautista A, Hawe E, Hingorani AD, Vallance P, López-Jaramillo P (listopad 2004). „Genotyp endoteliální NO syntázy a riziko preeklampsie: multicentrická případová kontrolní studie“. Hypertenze. 44 (5): 702–7. doi:10.1161 / 01.HYP.0000143483.66701.ec. PMID 15364897.
- ^ A b Jia Z, Zhang X, Kang S, Wu Y (2013). „Sdružení polymorfismů genu pro syntézu oxidu dusnatého v endotelu s diabetes mellitus 2. typu: metaanalýza“. Endokrinní deník. 60 (7): 893–901. doi:10.1507 / endocrj.ej12-0463. PMID 23563728.
- ^ Lee YC, Huang SP, Liu CC, Yang YH, Yeh HC, Li WM, Wu WJ, Wang CJ, Juan YS, Huang CN, Hour TC, Chang CF, Huang CH (březen 2012). "Sdružení polymorfismu eNOS G894T s metabolickým syndromem a erektilní dysfunkcí". The Journal of Sexual Medicine. 9 (3): 837–43. doi:10.1111 / j.1743-6109.2011.02588.x. PMID 22304542.
- ^ Hermans MP, Ahn SA, Rousseau MF (červenec 2012). „eNOS [Glu298Asp] polymorfismus, erektilní funkce a oční tlak u diabetu 2. typu“. European Journal of Clinical Investigation. 42 (7): 729–37. doi:10.1111 / j.1365-2362.2011.02638.x. PMID 22224829. S2CID 31746130.
- ^ Zhang MX, Zhang C, Shen YH, Wang J, Li XN, Chen L, Zhang Y, Coselli JS, Wang XL (září 2008). "Vliv 27nt malé RNA na expresi endoteliální syntázy oxidu dusnatého". Molekulární biologie buňky. 19 (9): 3997–4005. doi:10,1091 / mbc.E07-11-1186. PMC 2526692. PMID 18614799.
- ^ Souza-Costa DC, Belo VA, Silva PS, Sertorio JT, Metzger IF, Lanna CM, Machado MA, Tanus-Santos JE (březen 2011). „Haplotyp eNOS spojený s hypertenzí u obézních dětí a dospívajících“. International Journal of Obesity. 35 (3): 387–92. doi:10.1038 / ijo.2010.146. PMID 20661250.
- ^ Crawford DC, Nickerson DA (2005). "Definice a klinický význam haplotypů". Roční přehled medicíny. 56: 303–20. doi:10.1146 / annurev.med.56.082103.104540. PMID 15660514.
- ^ Sandrim VC, Coelho EB, Nobre F, Arado GM, Lanchote VL, Tanus-Santos JE (červen 2006). „Citlivé a ochranné haplotypy eNOS u hypertenzních černobílých subjektů“. Ateroskleróza. 186 (2): 428–32. doi:10.1016 / j.atheroskleróza.2005.08.003. PMID 16168996.
- ^ Sandrim VC, de Syllos RW, Lisboa HR, Tres GS, Tanus-Santos JE (listopad 2006). „Haplotypy endoteliální syntázy oxidu dusnatého ovlivňují náchylnost k hypertenzi u pacientů s diabetes mellitus 2. typu“. Ateroskleróza. 189 (1): 241–6. doi:10.1016 / j.atheroskleróza.2005.12.011. PMID 16427644.
- ^ Sandrim VC, Yugar-Toledo JC, Desta Z, Flockhart DA, Moreno H, Tanus-Santos JE (prosinec 2006). „Haplotypy endoteliální syntázy oxidu dusnatého souvisí se zvýšením krevního tlaku, ale ne s rezistencí na antihypertenzní farmakoterapii“. Journal of Hypertension. 24 (12): 2393–7. doi:10.1097 / 01.hjh.0000251899.47626.4f. PMID 17082721. S2CID 20666422.
- ^ Vasconcellos V, Lacchini R, Jacob-Ferreira AL, prodej ML, Ferreira-Sae MC, Schreiber R, Nadruz W, Tanus-Santos JE (duben 2010). „Haplotypy endoteliální syntázy oxidu dusnatého spojené s hypertenzí nemají predispozici k srdeční hypertrofii.“ DNA a buněčná biologie. 29 (4): 171–6. doi:10.1089 / dna.2009.0955. PMID 20070154.
- ^ Sandrim VC, Palei AC, Sertorio JT, Cavalli RC, Duarte G, Tanus-Santos JE (červenec 2010). „Účinky polymorfismů eNOS na tvorbu oxidu dusnatého ve zdravém těhotenství a v preeklampsii“. Molekulární lidská reprodukce. 16 (7): 506–10. doi:10,1093 / mol / gaq030. PMID 20457799.
- ^ de Syllos RW, Sandrim VC, Lisboa HR, Tres GS, Tanus-Santos JE (prosinec 2006). „Genotyp a haplotyp endoteliální syntázy oxidu dusnatého nejsou spojeny s diabetickou retinopatií u pacientů s diabetem typu 2“. Oxid dusnatý. 15 (4): 417–22. doi:10.1016 / j.niox.2006.02.002. PMID 16581274.
- ^ Nagassaki S, Sertório JT, Metzger IF, Bem AF, Rocha JB, Tanus-Santos JE (říjen 2006). „Polymorfismus genu eNOS T-786C moduluje atorvastatinem indukované zvýšení dusitanu v krvi“. Radikální biologie a medicína zdarma. 41 (7): 1044–9. doi:10.1016 / j.freeradbiomed.2006.04.026. PMID 16962929.
- ^ Andrade VL, Sertório JT, Eleuterio NM, Tanus-Santos JE, Fernandes KS, Sandrim VC (září 2013). „Léčba simvastatinem zvyšuje hladinu dusitanů u obézních žen: modulace polymorfismem T (-786) C eNOS“. Oxid dusnatý. 33: 83–7. doi:10.1016 / j.niox.2013.07.005. hdl:11449/76257. PMID 23876348.
- ^ Silva PS, Fontana V, Luizon MR, Lacchini R, Silva WA, Biagi C, Tanus-Santos JE (únor 2013). „Genotypy eNOS a BDKRB2 ovlivňují antihypertenzní odpovědi na enalapril.“ Evropský žurnál klinické farmakologie. 69 (2): 167–77. doi:10.1007 / s00228-012-1326-2. PMID 22706620. S2CID 2063573.
- ^ A b Muniz JJ, Lacchini R, Rinaldi TO, Nobre YT, Cologna AJ, Martins AC, Tanus-Santos JE (duben 2013). „Genotypy a haplotypy endoteliální syntázy oxidu dusnatého modifikují reakce na sildenafil u pacientů s erektilní dysfunkcí“. The Pharmacogenomics Journal. 13 (2): 189–96. doi:10.1038 / tpj.2011.49. PMID 22064666.
- ^ Lacchini R, Tanus-Santos JE (srpen 2014). „Farmakogenetika erektilní dysfunkce: navigace do nezmapovaných vod“. Farmakogenomika. 15 (11): 1519–38. doi:10.2217 / str.14.110. PMID 25303302.
Další čtení
- de la Monte SM, Lu BX, Sohn YK, Etienne D, Kraft J, Ganju N, Wands JR (2000). „Aberantní exprese syntázy oxidu dusnatého III u Alzheimerovy choroby: význam pro mozkovou vaskulopatii a neurodegeneraci“. Neurobiologie stárnutí. 21 (2): 309–19. doi:10.1016 / S0197-4580 (99) 00108-6. PMID 10867216. S2CID 34155727.
- Shaul PW (2002). "Regulace endoteliální syntázy oxidu dusnatého: umístění, umístění, umístění". Roční přehled fyziologie. 64: 749–74. doi:10,1146 / annurev.physiol.64.081501.155952. PMID 11826287.
- Wu KK (květen 2002). "Regulace endoteliální aktivity syntázy oxidu dusnatého a genové exprese". Annals of the New York Academy of Sciences. 962 (1): 122–30. Bibcode:2002NYASA.962..122W. doi:10.1111 / j.1749-6632.2002.tb04062.x. PMID 12076969. S2CID 20537144.
- Alp NJ, Channon KM (březen 2004). "Regulace endoteliální syntázy oxidu dusnatého tetrahydrobiopterinem při vaskulárním onemocnění". Arterioskleróza, trombóza a vaskulární biologie. 24 (3): 413–20. doi:10.1161 / 01.ATV.0000110785.96039.f6. PMID 14656731.
- Tai SC, Robb GB, Marsden PA (březen 2004). „Endoteliální syntáza oxidu dusnatého: nové paradigma pro regulaci genů v poškozené cévě“. Arterioskleróza, trombóza a vaskulární biologie. 24 (3): 405–12. doi:10.1161 / 01.ATV.0000109171.50229,33. PMID 14656742.
- Kawashima S, Yokoyama M (červen 2004). „Dysfunkce endoteliální syntázy oxidu dusnatého a ateroskleróza“. Arterioskleróza, trombóza a vaskulární biologie. 24 (6): 998–1005. doi:10.1161 / 01.ATV.0000125114.88079.96. PMID 15001455.
- Duda DG, Fukumura D, Jain RK (duben 2004). "Role eNOS v neovaskularizaci: NE pro endotelové progenitorové buňky". Trendy v molekulární medicíně. 10 (4): 143–5. doi:10.1016 / j.molmed.2004.02.001. PMID 15162796.